microRNA-181c在重癥肌無力患者外周血單個核細胞中的表達及其意義
郭明鳳, 陳 政, 趙紅梅, 董瑞國, 張 勇, 孫 虹
microRNA-181c在重癥肌無力患者外周血單個核細胞中的表達及其意義
郭明鳳1, 陳 政1, 趙紅梅1, 董瑞國2, 張 勇2, 孫 虹1
目的探討microRNA-181c(miR-181c)在重癥肌無力(myasthenia gravis,MG)患者中的表達水平及其臨床意義。方法收集2015年6月-2017年6月收治的22例MG患者和20例健康人的外周靜脈血樣,提取外周血單個核細胞(peripheral blood mononuclear cell,PBMC)中總RNA,采用實時定量PCR(quantitative real-time PCR,qRT-PCR)技術檢測PBMC中miR-181c的相對表達水平,并分析miR-181c表達水平與患者的MG定量評分體系(quantitative myasthenia gravis score,QMG)的相關性。結果MG患者PBMC中miR-181c的相對表達水平(0.303±0.150)較對照組(1.000±0.262)顯著降低(P<0.01),其中全身型患者(0.182±0.056)低于眼肌型患者(0.404±0.126)(P<0.05),同時miR-181c表達水平與QMG呈負相關(R2=-0.359,P<0.05)。結論MG患者PBMC中miR-181c表達水平的降低可能與病情嚴重程度有關。
重癥肌無力; 人外周血單個核細胞; miR-181c
MG是一種由乙酰膽堿受體抗體(acetylcholine receptor antibody,AChR-Ab)介導、細胞免疫依賴、補體參與、累及神經肌肉接頭突觸后膜、引起神經肌肉接頭傳遞障礙、出現骨骼肌收縮無力的獲得性自身免疫性疾病。MG主要臨床表現為骨骼肌無力、易疲勞、活動后加重,休息和應用膽堿酯酶抑制劑后癥狀明顯緩解[1]。但其確切發病機制目前仍尚不明確。microRNA作為廣泛存在于生物體內的高度保守的短小RNA,在調控細胞增殖、分化、凋亡及免疫、炎癥反應等多種生物學功能中發揮重要作用[2~4]。近年來關于miR-181c的研究發現,其在腫瘤的發生發展及自身免疫性疾病中可能起到關鍵作用[5~7]。因此我們以miR-181c為研究對象,通過檢測其在MG患者PBMC中的相對表達水平來探討其臨床意義。
1 材料與方法
1.1 材料
1.1.1 研究對象 收集2015年6月-2017年6月南京醫科大學附屬淮安第一醫院收治的22例MG患者(包括眼肌型12例,全身型10例),同時以20例健康體檢者作為對照組。實驗組納入標準:根據臨床癥狀、疲勞試驗、新斯的明試驗、神經電生理檢查或相關血清抗體的檢測確診為重癥肌無力的患者,且就診前3 m內未使用過激素或免疫抑制劑;不伴其他自身免疫性或炎性疾病;女性患者處于非妊娠、非哺乳期。對照組納入標準:體檢各項指標正常;3 m內未使用過激素或免疫抑制劑,無自身免疫性或炎性疾病的健康人。根據患者癥狀采用QMG評分表分別進行評分。分別對兩組(MG組與健康對照組;眼肌型與全身型)年齡進行t檢驗、性別構成比進行χ2檢驗,兩組研究對象在年齡、性別構成比方面均無顯著性差異(P>0.05),具有可比性(見表1)。
1.1.2 主要試劑及儀器 淋巴細胞分離液(天津灝洋生物制品公司);Trizol試劑(美國Invitrogen公司);SYBR Green Realtime RT 試劑盒、SYBR Green Realtime PCR試劑盒(上海艾博思生物科技有限公司);Roche LightCycler 480 PCR儀(羅氏公司)。
1.2 方法
1.2.1 標本采集及cDNA提取 所有受試者空腹采血,采用Ficoll分層液法分離得到PBMC,Trizol 法提取PMBC中總RNA,進行RNA純度及完整性測定(見圖1)。以上述RNA為模板制備cDNA,所得cDNA-20 ℃保存作為PCR反應模板。
1.2.2 檢測PBMC中miR-181c的相對表達水平 以cDNA為模板,按說明書建立PCR反應體系后上PCR儀器檢測,PCR循環參數設定:95 ℃,預變性,3min;變性,95 ℃,15 s;退火延伸,60 ℃,40 s;共45個循環,作融解曲線及擴增曲線(見圖2、圖3)驗證擴增產物的特異性,反應完成后設定基線值(Baseline)和閾值(Threshold),讀取閾循環(Ct)值。根據公式[8]ΔCt =[Ct (目的基因miR-181c )]-[Ct (內參基因U6)]和ΔΔ Ct =[ Δ Ct (研究組)]-[ Δ Ct (對照組)],計算出相對表達量 =2 -ΔΔCt 。
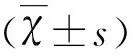
2 結 果
2.1 研究發現 MG組PBMC中miR-181c的相對表達水平(0.303±0.150)顯著低于健康對照組(1.000±0.262)(見圖4A),差異具有統計學意義(★★P<0.01),其中全身型亞組表達水平(0.182±0.056)低于眼肌型亞組(0.404±0.126)(見圖4B),差異具有統計學意義(▲P<0.05)。
2.2 在研究重癥肌無力組PBMC中miR-181c的表達量與患者的QMG相關性顯示 MG組的表達水平與QMG呈負相關性,R2=-0.359,P<0.05,具有統計學意義(見圖5)。

表1 重癥肌無力組患者與健康對照組一般資料比較

圖1 RNA電泳條帶圖

圖2 miR-181c 溶解曲線及擴增曲線

圖3 U6溶解曲線及擴增曲線

圖4 MG組與健康對照組PBMC中miR-181c的表達水平(A);眼肌型亞組與全身型亞組PBMC中miR-181c的表達水平(B)(★★P<0.01,▲P<0.05)

miR-181c相對表達量
圖5 外周血單個核細胞中miR-181c相對表達量與QMG呈負相關(P<0.05)
3 討 論
microRNA在控制和調節免疫方面的研究已日漸增多,近期有研究報道[9],對實驗性自身免疫性重癥肌無力(experimental autoimmune myasthenia gravis,EAMG)模型大鼠外周血淋巴細胞差異表達的miRNAs進行篩選,發現有11個miRNAs 表達差異顯著:其中8 個miRNAs 表達下調(miR-24、miR-151、miR-423、miR-181c、miR-145、miR-326、miR-143和miR-328a);3 個miRNAs表達上調(miR-101a、miR-193和miR-33),而miR-181c就是其中表達的下調基因。
miR-181c作為miR-181家族成員,位于第19號染色體正鏈,其基因組結構在進化上非常保守,含有共同的5’端“種子”序列-ACAUUCA。Xue等[10]報道了在原始T細胞和活化CD4+T細胞中篩選鑒定差異表達的miRNAs時,發現miR-181c 有調控CD4+T淋巴細胞活化的潛力,進一步的體外實驗證實miR-181c 表達水平在T細胞活化過程中降低,轉染miR-181c模擬物可以部分抑制T細胞的活化,從而證實了miR-181c對CD4+T細胞的負調控作用。目前越來越多的研究發現miR-181c在多種腫瘤中表達異常,包括膠質母細胞瘤、卵巢癌、胰腺癌等。He[11]等發現可以通過miR-181c過表達,下調TGFBR1、TGFBR2和TGFBRAP1表達水平,抑制TGF-β信號傳導,從而在膠質母細胞瘤細胞侵襲、遷移和間質轉化中起到關鍵作用。Yao[12]等研究報道miR-181c通過與3’-UTR結合靶向調節PRKCD的表達,從而使A2780細胞的增殖和轉移減少,來抑制卵巢癌轉移和進展。Chen[13]等研究發現miR-181c可以直接抑制人胰腺癌細胞中的MST、LATS2、MOB1和SAV1的表達;miR-181c的過度表達誘導YAP/TAZ的高活化并增強Hippo信號傳導下游基因CTGF,BIRC5和BLC2L1的表達,導致體外和體內胰腺癌細胞存活和化學耐藥的發生。
目前miR-181c在自身免疫性疾病中的報道較為少見。Haghikia 等[7]研究發現,與復發-緩解型多發性硬化患者(relapsing-remitting MS,RRMS)相比,繼發進展型多發性硬化患者(secondary progressive MS,SPMS)腦脊液(cerebrospinal fluid,CSF)中miR-181c表達水平降低。Abdelsadik A[14]的研究發現Toll樣受體(TLR)這一類受體家族,其通過宿主的先天免疫系統識別入侵病原體的存在,而不恰當的TLR信號傳導可導致自身免疫疾病的發生。而另外一項研究發現miR-181c-TLR4通路在缺氧小膠質細胞激活和神經元激活中起到重要作用,miR-181c通過與其3’-UTR結合抑制TLR4的表達,從而抑制NF-κB的活化和下游促炎性介質的產生[15]。上述研究均提示miR-181c可能在神經免疫疾病中具有重要意義。本研究發現MG患者外周血單個核細胞中miR-181c的相對表達水平顯著低于對照組,且全身型低于眼肌型。同時miR-181c的表達水平與QMG呈負相關,提示其表達水平的降低可能與病情嚴重程度有關。由于本研究時間有限,收集病例數相對較少,還需擴大樣本量,進一步深入探究miR-181c在MG中具體可能的作用機制。
[1]中華醫學會神經病學分會神經免疫學組,中國免疫學會神經免疫學分會.中國重癥肌無力診斷和治療指南2015[J].中華神經科雜志,2015,48(11):934-940.
[2]Geisler A,Fechner H.MicroRNA-regulated viral vectors for gene therapy[J].World J Exp Med,2016,6(2):37-54.
[3]Araldi E,Chamorro JA,Van SC,et al.Therapeutic potential of modulating microRNAs in atherosclerotic vascular disease[J].Curr Vasc Pharmacol,2015,13(3):291-304.
[4]Qiu L,Tan EK,Zeng L.microRNAs and Neurodegenerative diseases[J].Adv Exp Med Biol,2015,888(6):85-105.
[5]Cui MH, Hou XL,Lei XY,et al.Upregulation of microRNA 181c expression in gastric cancer tissues and plasma[J].Asian Pac J Cancer Prev,2013,14(5):3063-3066.
[6]Xu Z,Jiang J,Xu C,et al.MicroRNA-181 Regulates CARM1 and histone arginine methylation to promote differentiation of human embryonic stem cells[J].PLoS One,2013,8(1):e53146.
[7]Haghikia A,Haghikia A,Hhllwig K,et al.Regulated microRNAs in the CSF of patients with multiple sclerosis:a case-control study[J].NLM,2012,7(9):2166-2170.
[8]Livak KJ,Schmittgen TD.Analysis of relative gene expression data using real-time quantitative PCR and the 2-Delta Delta C(T) Method[J].Methods,2001,25(4):402-408.
[9]Wang J,Zheng S,Xin N,et al.Identification of novel MicroRNA signatures linked to experimental autoimmune myasthenia gravis pathogenesis:down-regulated miR-145 promotes pathogenetic Th17 cell response[J].J Neuroimmune Pharm,2013,8(5):1287-1302.
[10]Xue Q,Guo ZY,Li W,et al.Human activated CD4+T lymphocytes increase IL-2 expression by downregulating microRNA-181c[J].Mol Immunol,2011,48(4):592-599.
[11]He X,Liu Z,Peng Y,et al.MicroRNA-181c inhibits glioblastoma cell invasion,migration and mesenchymal transition by targeting TGF-β pathway[J].Biochem Biophys Res Commun,2016,469(4):1041-1048.
[12]Yao L,Wang L,Li F,et al.MiR181c inhibits ovarian cancer metastasis and progression by targeting PRKCD expression [J].Int J Exp Med,2015,8(9):15198-15205.
[13]Chen M,Wang M,Xu S,et al.Upregulation of miR-181c contributes to chemoresistance in pancreatic cancer by inactivating the Hippo signaling pathway [J].Oncotarget,2015,6(42):44466-44479.
[14]Abdelsadik A,Trad A.Toll-like receptors on the fork roads between innate and adaptive immunity[J].Hum Immunol,2011,72(12):1188-1193.
[15]Zhang L,Li YJ,Wu XY,et al.MicroRNA-181c negatively regulates the inflammatory response in oxygen-glucose-deprived microglia by targeting Toll-like receptor 4[J].J Neurochem,2015,132(6):713-723.
ExpressionofmicroRNA-181cinperipheralbloodmononuclearcellsfrompatientswithmyastheniagravisanditssignificance
GUOMingfeng,CHENZheng,ZHAOHongmei,etal.
(DepartmentofEmergencyMedicine,Huai’anFirstPeople’sHospital,NanjingMedicalUniversity,Huai’an223300,China)
ObjectiveTo evaluate the expression and clinical significance of miR-181c in patients with myasthenia gravis.MethodsPlasma blood samples from 22 patients with MG and 20 healthy subjects were collected from June 2015 to June 2017,and the total RNA was extracted from peripheral blood mononuclear cells.To detect the relative expression of miR-181c in PBMC by Real-time quantitative polymerase chain reaction and to analyze the correlation between the expression level of miR-181c and the quantitative myasthenia gravis score (QMG) in MG patients.ResultsThe relative expression level of miR-181c in PBMC of MG patients (0.303±0.150) was significantly lower than that of control group (1.000±0.262) (P<0.01),and the level of miR-181c in generalized patients (0.182±0.056) was lower than that in ocular patients (0.404±0.126) (P<0.05),meanwhile the expression level of miR-181c was negatively correlated with QMG (R2=-0.359,P<0.05).ConclusionThe decrease of miR-181c expression in PBMC of MG patients may be related to the severity of the disease.
Myasthenia gravis; PBMC; miR-181c
R746.1
A
1003-2754(2017)10-0916-03
2017-08-12;
2017-10-03
(1.南京醫科大學附屬淮安第一醫院急診科,江蘇 淮安 223300;2.徐州醫科大學附屬醫院神經內科,江蘇 徐州 221000)
孫 虹,E-mail:hayyzb@126.com

