神經型一氧化氮合酶參與脂多糖誘導的大鼠腦微出血的相關性研究
曾 靜, 李丹丹, 劉志新, 趙弘軼, 遲麗屹, 黃勇華
神經型一氧化氮合酶參與脂多糖誘導的大鼠腦微出血的相關性研究
曾 靜1,2, 李丹丹1, 劉志新3, 趙弘軼1, 遲麗屹4, 黃勇華1
目的改進并穩定脂多糖(LPS)誘導腦微出血(CMBS)動物模型的建立方法,為進一步研究提供穩定成熟的技術手段;探討神經型一氧化氮合酶(nNOS)在CMBS過程中的作用。方法40只SD大鼠,隨機分成LPS給藥組(n=20)和生理鹽水對照組(n=20),分別于0 h、12 h和24 h腹腔注射1 mg/ml、3 mg/kg LPS或相同劑量的生理鹽水,48 h后行頭部MRI掃描,SWI序列顯示出血灶;免疫熒光染色顯示小膠質細胞標記分子Iba的表達;蛋白印跡法分析nNOS和ZO-1(血腦屏障標記分子)的表達情況。結果3 mg/kg LPS給藥后,MRI顯示散在SWI序列點狀低信號影,蛋白印跡法及免疫熒光結果顯示ZO-1明顯減少,Iba及nNOS表達顯著增多。結論LPS可能通過增加全身炎癥反應,促進腦內小膠質細胞增殖,增加nNOS的表達,對中樞神經系統血腦屏障產生破壞作用,從而導致微出血的產生。
腦微出血; 脂多糖; 神經型一氧化氮合酶; 磁敏感加權成像; 血腦屏障
腦小血管病(cerebral small vessel disease,CSVD)是指在多種病因共同作用下,導致腦的穿支動脈、小動脈(直徑40~200 μm)、毛細血管和小靜脈受損,進而損傷腦深部灰質和腦白質,進而出現一些特征性的病理學和影像學改變以及認知功能障礙的臨床綜合征[1]。其影像學改變主要包括新發的皮質下梗死、可能為血管起源的腔隙、可能為血管起源的白質高信號、血管周圍間隙擴大、腦萎縮以及腦微出血[2]。
腦微出血(cerebral microbleeds,CMBS)是腦內微小血管破裂導致的微小出血,病理上表現為受損血管周圍小的陳舊性出血灶以及含鐵血黃素沉積[3]。然而,這種出血灶在常規的影像學檢查上難以發現,較多的研究顯示,磁敏感加權成像(SWI)顯示CMBS的敏感性明顯優于常規序列,顯示出較高的臨床應用價值[4]。CMBS在SWI上表現為多發性小灶性(<10 mm)的信號缺失,周圍沒有水腫形成。關于CMBS,目前認為,炎癥反應是其重要的發病機制之一[5]。
神經型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)是NOS3種亞型之一,又稱為NOS1,在中樞和外周的神經元持續表達,具有調節中樞神經系統突觸可塑性、調節血壓、松弛血管平滑肌、舒張血管等作用[6]。nNOS為Ca2+依賴型,高活性的nNOS,刺激大量的Ca2+內流,激活NMDA受體介導神經細胞凋亡[7]。
脂多糖(LPS)是革蘭陰性細菌細胞壁的組成成分之一,是一種良好的炎癥刺激因子。Sumbria等[8]通過 C57BL/6小鼠腹腔注射LPS構建腦微出血動物模型。本課題參考并改進該方法建立SD大鼠腦微出血動物模型,并探討nNOS在腦微出血病理進程中的作用。
1 材料與方法
1.1 實驗動物及材料 雄性清潔級SD大鼠,體重(220±20)g,購于斯貝福實驗動物科技有限公司;7.0T核磁(BioSpec,首都醫科大學);脂多糖(086M4159V,Sigma);NOS1(A-11)(sc-5302,SANTA CRUZ);ZO-1 Polyclonal ANTIBODY(21773-1-AP,proteintech);Anti-Iba1 antibody(ab178847,abcam);Mouse anti β-tubulin antibody(GB13017-2,谷歌生物);HRP標記的山羊抗小鼠IgG(GB23301,谷歌生物);Goat Anti-Rabbit IgG-HRP(M21002,Abmart);Alexa Fluor 488 標記山羊抗兔IgG(H+L)(A0423,碧云天)。
1.2 分組處理 配制1 mg/ml的脂多糖。將40只雄性SD大鼠,隨機分成LPS給藥組(n=20)和生理鹽水對照組(n=20),LPS給藥組從第一天晚上20:00開始,分別于0 h、12 h、24 h后腹腔注射LPS 3 mg/kg,對照組給予等量生理鹽水。
1.3 MRI LPS給藥后48 h,采用7.0T核磁進行頭部冠狀位全層掃描,層厚為0.7 mm,SWI序列評估微出血的部位及數目。
1.4 免疫熒光 LPS給藥后48 h,每組各取10只大鼠,4 ml/kg 10%水合氯醛腹腔注射麻醉,依次經心臟灌注生理鹽水300 ml、4%多聚甲醛溶液300 ml,完整取出腦組織,依次置入4%多聚甲醛溶液、20%蔗糖溶液、30%蔗糖溶液各6 h固定腦組織,然后進行冰凍切片,厚度為10 μm,每隔100微米取一層。采用免疫熒光的方法標記小膠質細胞的特異性標記物Iba,確定LPS誘導的腦微出血炎癥反應的程度。其中一抗為Anti-Iba1 antibody(1∶100);二抗為Alexa Fluor 488 標記山羊抗兔IgG(1∶500),DAPI對細胞核進行染色。
1.5 蛋白印跡法 LPS給藥后48 h,每組各取10只大鼠,足量水合氯醛充分麻醉,快速取出腦組織,然后取額葉、基底節、小腦對應部位等量大小的腦組織,立即置于液氮中保存,需要時采用勻漿器充分研磨腦組織,加入RIPA裂解液(PMSF與RIPA Lysis Buffer按1∶500配制)冰上孵育30 min,4 ℃、12000 rpm離心15 min,取上清,加入上樣緩沖液,混勻后煮沸10 min,然后按蛋白印跡法的操作步驟進行,一抗為nNOS(1∶200)和ZO-1(1∶1000),內參為β-tubulin(1∶2000);二抗為Goat Anti-Rabbit IgG-HRP(1∶4000)和HRP標記的山羊抗小鼠IgG(1∶4000)。利用BIO-RAD XRS+Software顯影,采用Image J圖像分析軟件對顯影結果進行灰度分析。
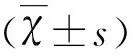
2 結 果
2.1 死亡率 給藥后48 h,LPS給藥組大鼠死亡2只,存活率為90%,對照組因麻醉意外死亡1只。因灌注失敗LPS給藥組和空白組各死亡1只。
2.2 腦表面微出血 給藥后48 h,LPS給藥組經過生理鹽水及多聚甲醛灌注后的腦組織表面微出血數目為(5.4±1.2)個,顯著高于生理鹽水對照組(P<0.01)(見圖1)。
2.3 MRI LPS或生理鹽水給藥后48 h,MRI的SWI序列,微出血在SWI序列上呈點狀低信號,LPS給藥組在SWI序列上低信號的數目為(8.5±0.9),顯著高于生理鹽水對照組(P<0.01)(見圖2)。
2.4 免疫熒光 免疫熒光結果顯示,相同部位,LPS給藥組小膠質細胞特異性標記分子Iba的數目為36.30±3.59,生理鹽水對照組為16.30±3.09,LPS給藥組顯著高于對照組(P<0.01)(見圖3)。
2.5 蛋白印跡法 蛋白電泳結果顯示,與生理鹽水對照組相比,額葉、基底節、小腦3個部位的LPS給藥組血腦屏障標記分子ZO-1均明顯減少(P<0.01),nNOS表達均顯著增加(P<0.01)(見圖4)。

圖1 灌注后的腦組織,左側為對照組,右側為LPS給藥組,箭頭所指為腦表面微出血

圖2 左側為生理鹽水對照組,右側為LPS給藥組,箭頭所指即為微出血的部位

圖3 左側上為生理鹽水對照組,右側上為LPS給藥組,藍色熒光為DAPI,綠色熒光為Iba陽性小膠質細胞標記物

圖4 額葉、小腦、基底節3個部位對應的ZO-1、nNOS分別與內參β-tubulin的灰度比值
3 討 論
腦微出血是腦小血管病的表現形式之一,是腦內基底核區或皮質下微血管破裂所致的腦實質損害,大多數患者無臨床癥狀,但CMS卻有很高的發病率。丁健等[9]通過對285例急性腦梗死患者研究顯示,急性腦梗死伴CMS的患者占37.5%。而無癥狀或健康老年人群CMS患病率約為5%~6%[10]。CMS的發病機制目前還不十分清楚,很多研究表明炎癥反應在其發生發展過程中發揮著重要作用,Mitaki等[11]通過對519個神經功能正常且沒有任何神經系統或精神疾病病史的受試者研究表明,CMS與血清C-反應蛋白(CRP)增高相關。Shoamanesh等[12]對15種炎癥標志物與腦小血管病的相關性研究表明,循環中高水平的腫瘤壞死因子2(TNFR2)和髓過氧化物酶與CMS相關,且不同的炎癥通路可能會導致缺乏或出血不同的表現。
最近的研究表明,血管內皮細胞不僅可以表達內皮型一氧化氮合酶,還可以表達nNOS,表達于血管內皮細胞的nNOS具有維持心血管系統穩定重要作用[13]。在生理條件下,nNOS的表達產物除了一氧化氮,還可以產生一些非神經細胞信號物質如過氧化物、超氧化物等[14]。在體內,nNOS有單體和二聚體兩種形式混合存在,二聚體是其活性形式,四氫生物蝶呤(BH4)和L-精氨酸是其形成的必要物質,缺乏BH4或者L-精氨酸會導致nNOS解偶聯,從而增加超氧化物的產生[15]。
通過本次研究,我們改進并穩定了脂多糖快速誘導腦微出血的大鼠模型,通過大體標本、HE染色、MRI的SWI序列均表明腦內及腦表面有微出血的存在。全身炎癥反應或者炎癥相關標記物的增加與正常老化[16]、腦卒中[17]、高血壓[18]等有顯著的相關性。急性炎癥可以導致內皮細胞損傷和血腦屏障破壞[19]。LPS通過增加全身炎癥反應,促進小膠質細胞增生,對血腦屏障的結構和功能產生破壞作用,從而導致微出血的產生。本研究中,我們發現,生理條件下nNOS的表達很少,而在LPS誘導的CMBS的病理過程中,nNOS活性顯著增強,參與CMBS的形成。
但是,就目前的研究而言,nNOS活性增強和腦微出血之間的因果關系及二者之間相互作用的機制都不十分清楚,后續實驗將圍繞這兩方面的問題展開研究,希望對CMBS有更進一步的認識。
[1]Pantoni L.Cerebral small vessel disease:from pathogenesis and clinical characteristics to therapeutic challenges[J].Lancet Neurology,2010,9(7):689-701.
[2]Zhiyou C,Chuanling W,Wenbo H,et al.Cerebral small vessel disease and Alzheimer’s disease[J].Clinical Interventions in Aging,2015,10:1695-1704.
[3] Chen L,Zhang W W,Wang GQ.Research progress on cerebral microbleeds[J].Chinese Journal of Cerebrovascular Diseases,2014,11(9):500-504.
[4]Wang SJ,Wang LW,Huang H,et al.The value of susceptibility weighted imaging in the diagnosis of cerebral micro-bleeding[J].Chinese Journal of Magnetic Resonance Imaging,2013,4(5):335-338.
[5]Miwa K,Tanaka M,Okazaki S,et al.Relations of blood inflammatory marker levels with cerebral microbleeds[J].Stroke,2011,42(11):3202-3206.
[6]Frstermann U,Sessa WC.Nitric oxide synthases:regulation and function[J].European Heart Journal,2012,33(7):829-842.
[7] Lipton SA,Choi YB,Pan ZH,et al.A redox-based mechanism for the neuroprotective and neurodestructive effects of nitric oxide and related nitroso-compounds[J].Nature,1993,364:626-632.
[8]Sumbria RK,Grigoryan MM,Vasilevko V,et al.A murine model of inflammation-induced cerebral microbleeds[J].Journal of Neuroinflammation,2016,13(1):218-224.
[9]丁 建,李 銳,高建梅,等.腦梗死伴腦微出血的危險因素分析[J].醫學綜述,2015,21(6):1108-1110.
[10]Cordonnier C,Alshahi SR,Wardlaw J.Spontaneous brain microbleeds:systematic review,subgroup analyses and standards for study design and reporting[J].Brain,2007,130(8):1988-1995.
[11]Mitaki S,Nagai A,Oguro H,et al.C-reactive protein levels are associated with cerebral small vessel-related lesions[J].Acta Neurologica Scandinavica,2015,133(1):68-74.
[12]Shoamanesh A,Preis SR,Beiser AS,et al.Inflammatory biomarkers,cerebral microbleeds,and small vessel disease:Framingham Heart study[J].Neurology,2015,84(8):825-832.
[13]Costa ED,Rezende BA,Cortes SF,et al.Neuronal nitric oxide synthase in vascular physiology and diseases[J].Frontiers in Physiology,2016,7(1):105-110.
[14]Cortes LSA,Gomes MA.Neuronal nitric oxide synthase-derived hydrogen peroxide is a major endothelium-dependent relaxing factor[J].Am J Physiol Heart Circ Physiol,2008,295(6):2503-2511.
[15]Feng C,Chen L,Li W,et al.Dissecting regulation mechanism of the FMN to heme interdomain electron transfer in nitric oxide synthases[J].Journal of Inorganic Biochemistry,2014,130(1):130-138.
[16]Franceschi C,Campisi J.Chronic inflammation (inflammaging) and its potential contribution to age-associated diseases[J].Journal of Gerontology,2014,69(Suppl 1):264-270.
[17]Dziedzic T.Systemic inflammation as a therapeutic target in acute ischemic stroke[J].Expert Review of Neurotherapeutics,2015,15(5):523-531.
[18]Pauletto P,Rattazzi M.Inflammation and hypertension:the search for a link[J].Nephrology,Dialysis,Transplantation,2006,21(4):850-853.
[19]Abbott NJ.Inflammatory mediators and modulation of blood-brain barrier permeability[J].Cellular & Molecular Neurobiology,2000,20(2):131-147.
Neuronalnitricoxidesynthaseisinvolvedincerebralmicrobleedsinducedbylipopolysaccharideinrats
ZENGJing,LIDandan,LIUZhixin,etal.
(ArmyGeneralHospitalofPLA,Beijng100700,China)
ObjectiveTo improve the method of cerebral microbleeds(CMBS) model induced by lipopolysaccharide (LPS) and investigate the effect of neuronal nitric oxide synthase (nNOS) in CMBS.MethodsAnimals were classified into two groups:LPS treatment group (n=20) and saline control group (n=20).LPS group were treated with 1 mg/ml,3 mg/kg,LPS or the same dose of saline by intraperitoneal injection on 0 h、12 h and 24 h.After 48 h,head MRI scan,SWI sequence showed microbleeds.Immunofluorescence staining showed that the expression of microglia marker Iba.Western blot analysis the expression of nNOS and ZO-1 (molecular markers of the blood brain barrier).ResultsAdministration of 3 mg/kg LPS group appeared point low signal in the SWI sequence.Western blot and immunofluorescence showed that ZO-1 significantly reduced while Iba and nNOS expression increased significantly.ConclusionLPS may increase the systemic inflammatory response,promote the proliferation of microglia in the brain,increase the expression of nNOS,and destroy the blood-brain barrier of the central nervous system,leading to the occurrence of CMBS.
Cerebral microbleeds; Lipopolysaccharide; Neuronal nitric oxide synthase; SWI; Blood-brain barrier
R743.34
A
1003-2754(2017)10-0868-04
2017-08-14;
2017-10-03
(1.中國人民解放軍陸軍總醫院神經內科,北京 100700;2.陜西中醫藥大學,陜西 咸陽 712046;3.北京四環制藥有限公司,北京 101113;4.中國人民解放軍第四五一醫院神經內科,陜西 西安 710054)
黃勇華,E-mail:huangyh@163.com

