miR-181家族在膠質母細胞瘤中的表達及其臨床意義
王成德 李群 盧江龍 蔡霖 高志超 蘇志鵬
miR-181家族在膠質母細胞瘤中的表達及其臨床意義
王成德 李群 盧江龍 蔡霖 高志超 蘇志鵬
目的 探討miR-181家族在人多形性腦膠質母細胞瘤(GBM)中的表達及其與臨床病理特征的關系。方法 采用莖環實時熒光定量PCR(RT-qPCR)法檢測40例膠質母細胞瘤中miR-181a、miR-181b、miR-181c、miR-181d的表達水平,并分析其與膠質母細胞瘤臨床病理特征的關系。采用慢病毒轉染上調膠質瘤細胞系U251 miR-181a的表達,分析miR-181a對U251克隆形成、細胞增殖和凋亡的影響。結果 miR-181a高表達的GBM患者生存預期明顯延長(P<0.05);且miR-181a表達水平越高,GBM瘤周水腫越明顯(P<0.05)。O6-甲基鳥嘌呤-DNA甲基轉移酶(MGMT)陽性組的GBM miR-181a表達明顯高于陰性組(P<0.05)。上調miR-181a的表達后,U251膠質瘤細胞克隆形成數明顯少于對照組(P<0.05),且細胞生長抑制在第5天最明顯,差異有統計學意義(P<0.01);對細胞凋亡起促進作用(P<0.05)。結論 miR-181a表達水平與GBM患者的臨床預后相關。miR-181a表達減少與GBM的發生密切相關。
miR-181 膠質母細胞瘤 MGMT
microRNA是一種內源性、高度保守的微小RNA,不編碼任何蛋白質,但能夠高效調控癌基因或抑癌基因的表達,在腫瘤的發生、發展中起著重要的調控作用[1]。腦多形性膠質母細胞瘤(Glioblastoma,GBM)是最常見的星形細胞來源的大腦原發性惡性腫瘤[2]。盡管有現代醫學的各種治療手段,但是GBM患者的預后仍然極差[3]。目前臨床上缺少準確預測GBM患者生存預后的指標。近年來,發現miR-181a、miR-181b能抑制GBM的生長[4],miR-181a能提高GBM對放化療的敏感性[5-6]。本研究采用莖環實時熒光定量PCR(RT-qPCR)和免疫組化方法檢測GBM組織標本中miR-181家族及O6-甲基鳥嘌呤-DNA 甲基轉移酶(MGMT)、Ki-67、p53等蛋白的表達水平,分析miR-181家族的表達與GBM臨床病理特征的關系;此外,通過慢病毒轉染膠質瘤細胞系U251來上調其表達,分析其對細胞增殖、凋亡及細胞周期的影響,以驗證miR-181家族的功能效應。
1 材料和方法
1.1 材料 人miR-181a轉染病毒LV-hsa-mir-181a-1(序號 LVKL17475-1)及對照病毒(序號 KL8781-1)由上海吉凱基因化學技術有限公司提供。U251購自中科院上海細胞庫;DMEM購自美國Gibco公司;FBS購自北京元亨圣馬生物科技公司;Trizol購自美國Invitrogen公司;M-MLV逆轉錄酶、RNA酶抑制劑、SYBR Mastermix購自日本東洋紡(上海)生物科技有限公司;PCR Marker(100 bpDNAlad-der)購自杭州吉諾生物醫藥技術有限公司;Matrigel購自美國BD Bioscience公司;凋亡試劑盒購自美國eBioscience公司。PI購自美國Sigma公司,RNase A購自美國Fermentas公司。GIEMSA染色液購自上海鼎國生物技術有限公司。引物由上海英駿生物技術有限公司合成。一抗特異性兔抗人多克隆抗體固定液購于美國Abcan公司,兔二抗、羊血清封閉液和DAB顯色液購置于北京中杉金橋生物公司。
1.2 方法
1.2.1 標本采集及處理 GBM組織標本來源于溫州醫科大學附屬第一醫院神經外科2008—2013年40例手術切除的腫瘤組織(腫瘤組織切除后立即予液氮冷凍備用),病理類型的判斷標準參照WHO腦膠質瘤的病理學分類。術后對患者行標準化同步放化療加輔助化療。患者中男 20 例,女 20 例;年齡 14~75(53.15±14.97)歲。1.2.2 免疫組化染色 取出液氮冷凍腫瘤組織并置于冰凍切片機冷架上(溫度-18~22℃),解凍后投入冷凍的丙酮;取出在空氣中二次解凍;10%福爾馬林浸泡過夜,常規石蠟包埋。將石蠟塊作3μm連續切片,脫蠟,3%甲醇-過氧化氫浸泡,檸檬酸修復液抗原修復;一抗4℃過夜,二抗、三抗各孵育 30min;DAB顯色,蘇木精復染對比;脫水、樹膠封片等具體操作步驟按常規進行。各步驟間用PBS緩沖液漂洗3×5min,用PBS作為一抗陰性對照。免疫組化染色后陽性細胞呈黃色、棕黃色或棕褐色。在高倍鏡(10×20)下,隨機選擇5個視野,每個視野計數1 000個細胞以上,計算腫瘤細胞陽性率。腫瘤細胞陽性率評分標準:陽性細胞<5%為0分,5%~25%為1分,>25%~50%為2分,>50%為3分;陽性著色評分標準:無色為0分,黃色為1分,棕黃色為2分,棕褐色為3分;以上兩種評分相加所得的總分:<3分為陰性(-),3分為弱陽性(+),≥4分為強陽性(++)。
1.2.3 小RNA抽提 取液氮保存的GBM組織標本,在液氮中碾碎至粉狀,按Trizol試劑說明書提取總RNA,DEPC處理水溶解。抽提的RNA溶液按DNase I說明書步驟進一步純化。采用NanoDrop2000超微量分光光度計(美國Thermo公司)檢測RNA溶液吸光值(OD260、OD280),計算RNA濃度、純度,OD260/OD280>1.8方可用于檢測。1.0%瓊脂糖變性凝膠電泳檢測RNA的完整性。
1.2.4 RT-qPCR GBM組織及細胞中miRNA-181的檢測:取GBM組織200mg,勻漿后根據Trizol試劑盒說明書提取腫瘤組織中總RNA。U251細胞中miRNA-181a/b/c/d按照mirVa-naTMRT-PCR miRNA檢測試劑盒操作。均采用U6作為內參照。變性條件:93~94℃,1min;退火條件:40℃,30s;延伸條件:70℃,1min;共30個循環。擴增完成后,在ABI 7300 System軟件上分析,用2-ΔΔCt方法計算相對表達量。
1.2.5 穩定過表達miR-181a U251的建立 慢病毒載體質粒LV-hsa-mir-181a-1(17475-1,導入基因片段序列為 hsa-mir-181a-1 序列,5′-AACAUUCAACGCUGUCGGUGAGU-3′),對照病毒 KL8781-1(導入基因片段序列為 5′-TTCTCCGAACGTGTCACGTTTC-3′),均由上海吉凱基因化學技術有限公司制備。載體質粒含有綠色熒光蛋白(GFP)及嘌呤霉素抗性基因。96孔板中進行感染,每孔接種細胞數為3.5×103,加入100μl完全培養基,感染細胞的病毒滴度為5×108TU/ml。分別于48、72、96、120h后在熒光顯微鏡下觀察細胞發光情況,確定U251在感染72h后熒光達到最強。換用含抗生素(puromycin)的培養基篩選細胞。篩選2周后取一定量細胞,調整濃度為1.0×105個/ml,應用流式細胞儀檢測1.0×104個細胞中發光細胞數,確定發光效率。篩選培養期間根據細胞的生長狀況進行傳代。實驗分為3個組:實驗組(OE組,U251+hsa-mir-181a-1基因mirco up病毒感染的細胞)、陰性對照組(NC組,U251+陰性對照病毒感染的細胞),另設置一組未經病毒感染的空白對照組(CON組)。
1.2.6 MTT實驗 取消化生長對數期的兩組細胞,調整細胞濃度為1.0×104個/ml。按100μl/孔接種于96孔板,分別于接種后 24、48、72、96、124h 以每孔濃度 0.5mg/ml加入MTT溶液,培養箱繼續培養4h后吸棄培養液。再每孔加入150μl二甲基亞砜(DMSO),37℃恒溫搖床上低速震蕩10min,使結晶物充分溶解。置于酶聯免疫檢測儀490nm波長處測量各孔吸光值(OD490),實驗重復3次。
1.2.7 細胞克隆形成實驗 取消化生長對數期細胞,調整細胞濃度為0.8×103個/ml。取1ml細胞分別接種于6孔板中,37℃、5%CO2培養箱培養;每3d更換一次培養液。培養10d后,吸棄每孔培養液,0.5%結晶紫染色顯微鏡下計數克隆數。>50個細胞的集落計數為1個克隆團。實驗重復3次。
1.2.8 細胞凋亡實驗 培養細胞融合度達85%,消化細胞,完全培養基重懸成細胞懸液,與上清液細胞收集于同一個5ml離心管中,每組設3個復孔。1 300rmp離心5min,棄上清液,4℃預冷的 D-Hanks(pH7.2~7.4)洗滌細胞沉淀。1×染色緩沖液洗滌細胞沉淀1次,1 300rmp離心3min,收集細胞。200μl 1×染色緩沖液重懸細胞沉淀。加入10μl Annexin V-APC染色,室溫避光10~15min。根據細胞量,補加400~800μl 1×染色緩沖液,上機檢測。1.3 統計學處理 應用Graphpad Prism 5統計軟件。由于miR-181相對表達量不符合正態分布,予-lg轉化使數據近似正態分布,用表示,組間比較采用兩獨立樣本t檢驗。總生存期(OS)的統計以GBM患者手術時間當日起至病死日期為止,以d為單位,數據用M(P25,P75)表示,組間比較采用log-rank檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 膠質瘤標本中miR-181家族檢測特異性分析 miR-181a、miR-181b、miR-181c 及 miR-181d 的 RT-PCR產物的熔解曲線為單峰,見圖1(插頁);說明莖環RT-qPCR可以特異檢測該4條microRNA。
2.2 熒光顯微鏡觀察轉染效率 在熒光顯微鏡觀察V-hsa-mir-181a-1(17475-1)及對照病毒 KL8781-1 感染U251的效率,結果顯示70%~80%的U251可見熒光,說明具有較高的感染效率,可以滿足后續試驗要求,見圖 2(插頁)。
2.3 miR-181表達水平與GBM臨床特征的關系 分別按 miR-181a、miR-181b、miR-181c、miR-181d 相對表達量0.1、0.03、0.002和0.02為界限,將GBM患者分成高表達組、低表達組,miR-181a高表達組總生存期較低表達組明顯延長(P<0.05),miR-181b、miR-181c、miR-181d高、低表達組總生存期比較差異均無統計學意義(均PP>0.05),見表1和圖3。此外,miR-181a與GBM瘤周水腫程度有關,即輕微水腫患者的miR-181a相對表達量低于明顯水腫患者(P<0.05),見表2。
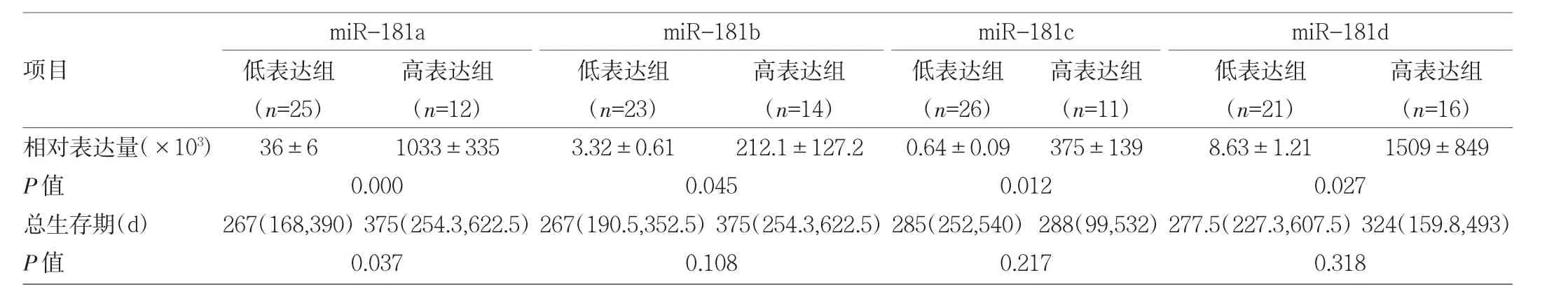
表1 miR-181高、低表達組總生存期比較
2.4miR-181表達水平與GBM病理特征的關系 MGMT陰性組miR-181a、miR-181c表達水平均明顯低于MGMT陽性組(均P<0.05),miR-181b、miR-181d表達水平比較差異均無統計學意義(均PP>0.05)。miR-181a、miR-181b、miR-181c、miR-181d表達水平與p53免疫組化結果未見明顯關系(均PP>0.05)。因研究納入的GBM標本Ki-67(-)只有2例,故將Ki-67表達分為弱表達(-,+)與強表達(++)兩組進行比較,發現 miR-181a、miR-181b、miR-181c、miR-181d 表達水平與 Ki-67 免疫組化結果未見明顯關系(均PP>0.05),見表3。
2.5 MTT實驗結果 各實驗組細胞于接種后連續5d用MTT法檢測細胞增殖情況,所測得的OD值作細胞生長曲線,見圖4a。miR-181a高表達對U251的增殖產生抑制作用。OE組與NC組相比較,miR-181a抑制U251生長作用在第5天最為明顯,OD值分別為0.616±0.0061和0.832±0.0012,兩組比較差異有統計學意義(t=73.02,P<0.05),見圖 4b。
2.6 克隆形成實驗 OE組克隆形成數為(36±3)個,明顯少于NC組的(54±8)個(兩組均種植1 000個細胞;t=3.87,P<0.05),見圖 5。
2.7 細胞凋亡實驗結果 OE組細胞凋亡率為(8.99±0.43)%明顯高于 NC 組的(4.28±0.20)%(t=16.98,P<0.05),見圖 6。
3 討論
microRNA作為癌基因和抑制癌基因對腫瘤的發生、發展過程進行調控,目前已被廣泛認同。miR-181家族在正常腦組織中呈現高表達[7],而在GBM中低表達,miR-181a、miR-181b在人膠質瘤細胞上具有腫瘤抑制作用,它們在膠質瘤細胞系及WHO-Ⅱ-Ⅳ級的膠質瘤組織標本中的表達均明顯降低;此外,miR-181a的表達與腫瘤級別呈負相關[4,8]。在GBM的治療方面,Chen等[5]研究表明miR-181a能通過靶向Bcl-2來提高膠質瘤對放療的靈敏度。在GBM的化療方面,海兔素可使膠質瘤細胞中的miR-181的表達增高,進而抑制其靶基因MEK1的表達,最終協同提高替莫唑胺化療的靈敏度[9-10]。同時,She等[6]認為miR-181可通過Rap1B介導的細胞骨架重塑而增加GBM對替莫唑胺化療的靈敏度。關于miR-181對同步放化療的作用亦有文獻報道,miR-181b、miR-181c可作為GBM同步放化療靈敏度的預測指標[11]。
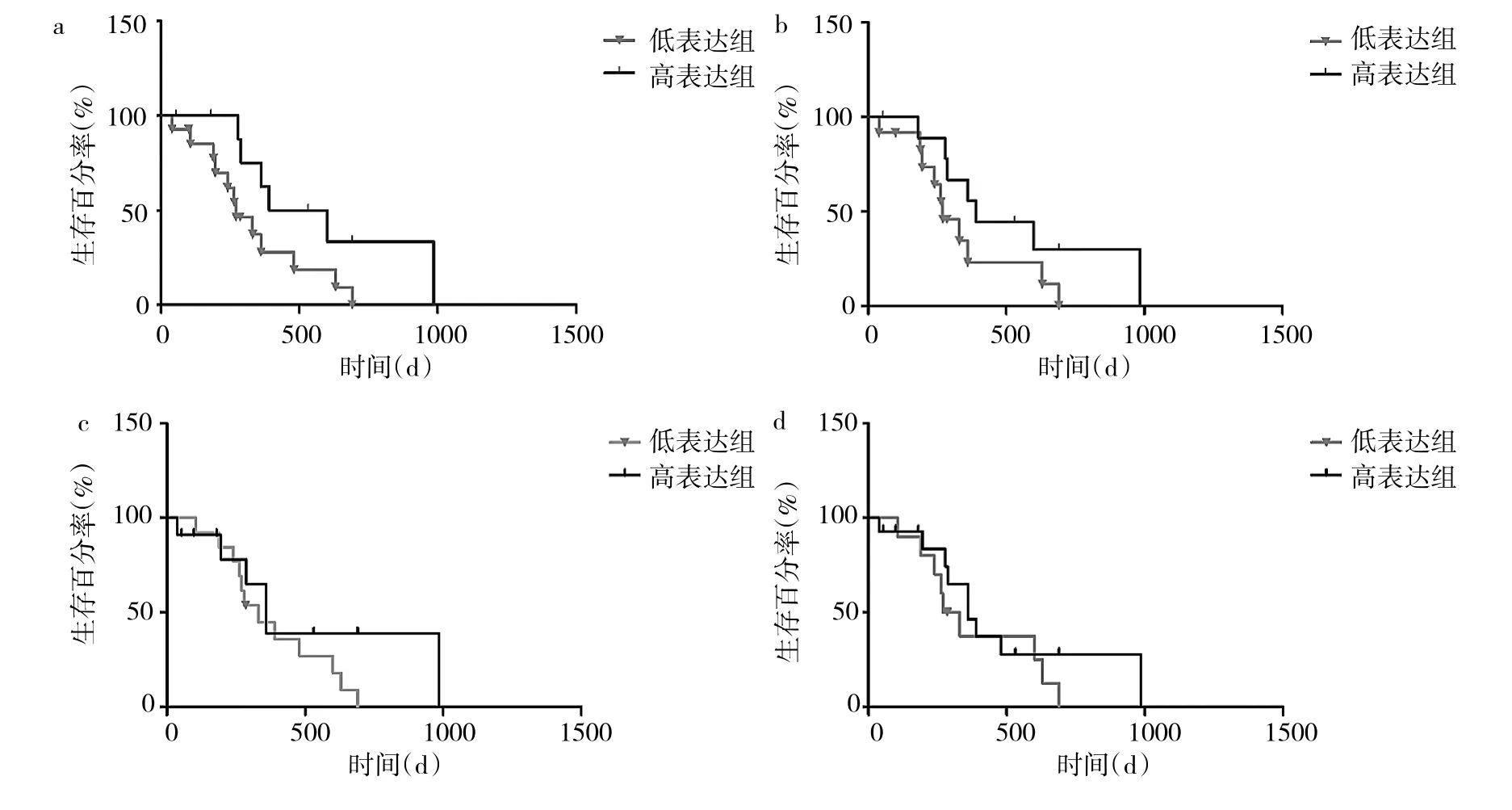
圖3 miR-181表達與GBM患者總生存期的關系(a:mir-181a;b:mir-181b;c:mir-181c;d:mir-181d)
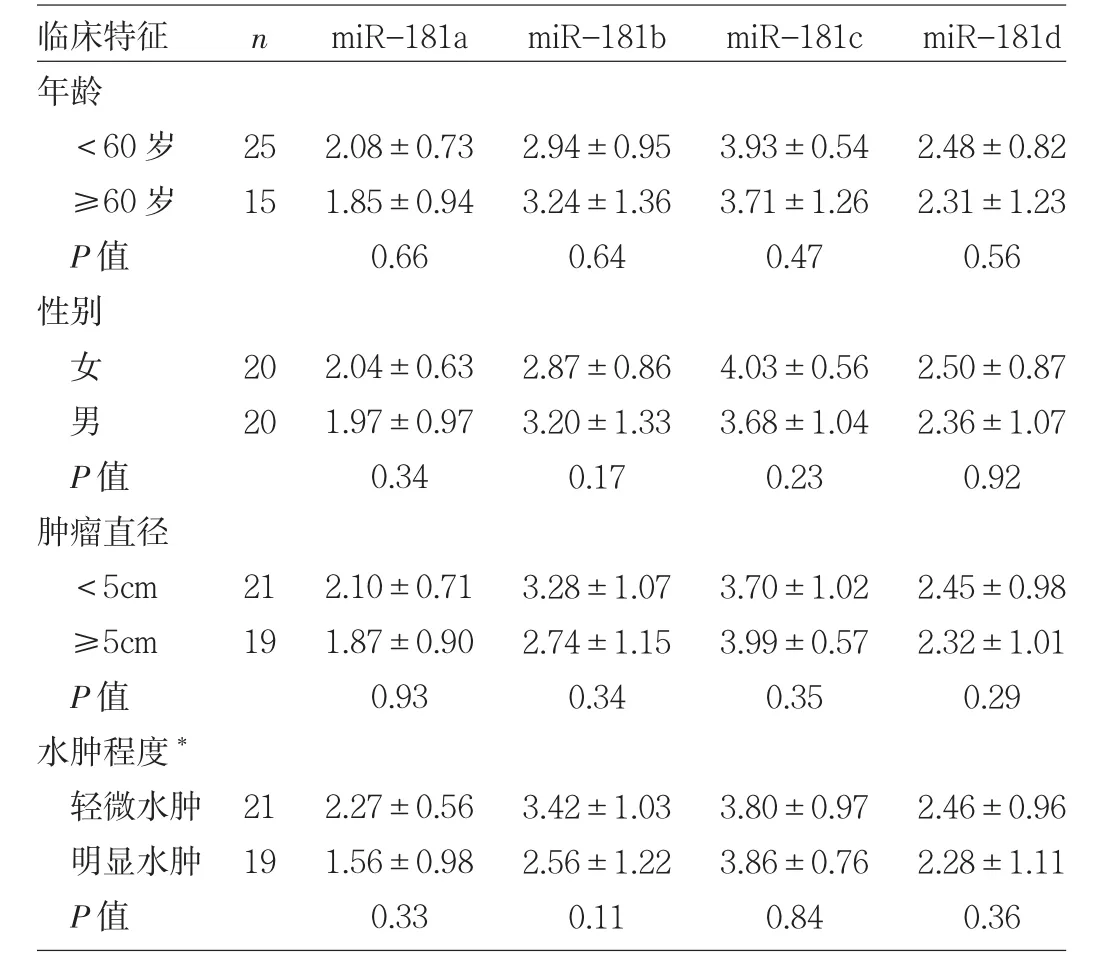
表2 miR-181表達水平與GBM臨床特征的關系
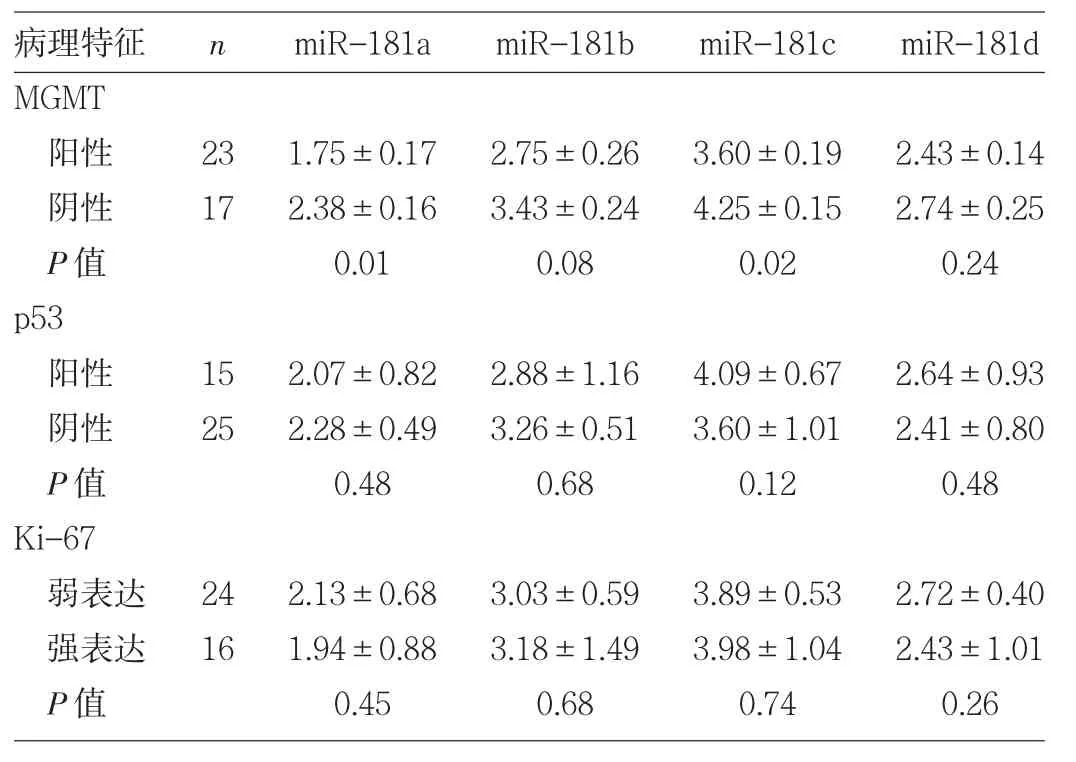
表3 miR-181表達水平與GBM病理特征的關系
筆者對GBM樣本進行檢測,結果顯示miR-181a表達與GBM患者的生存預后存在相關性。miR-181a表達水平越高,患者生存期越長。由于本研究納入病例均為WHOⅣ級的GBM患者,術后均按指南進行標準放化療,故生存期延長的這部分患者可能與miR-181a高表達致腫瘤對放療及替莫唑胺化療的靈敏度增加有關。以上研究結果具與本文一致,提示miR-181a表達量可能成為臨床判斷GBM患者預后的指標,并進一步支持miR-181a高表達水平會給GBM患者帶來明顯生存受益的觀點。本研究數據發現miR-181b、miR-181c、miR-181d與GBM患者預后差異均無統計學意義,可能是與miR-181b、miR-181c、miR-181d在 GBM 標本中的相對表達量偏低以及入選病例數偏少等有關。
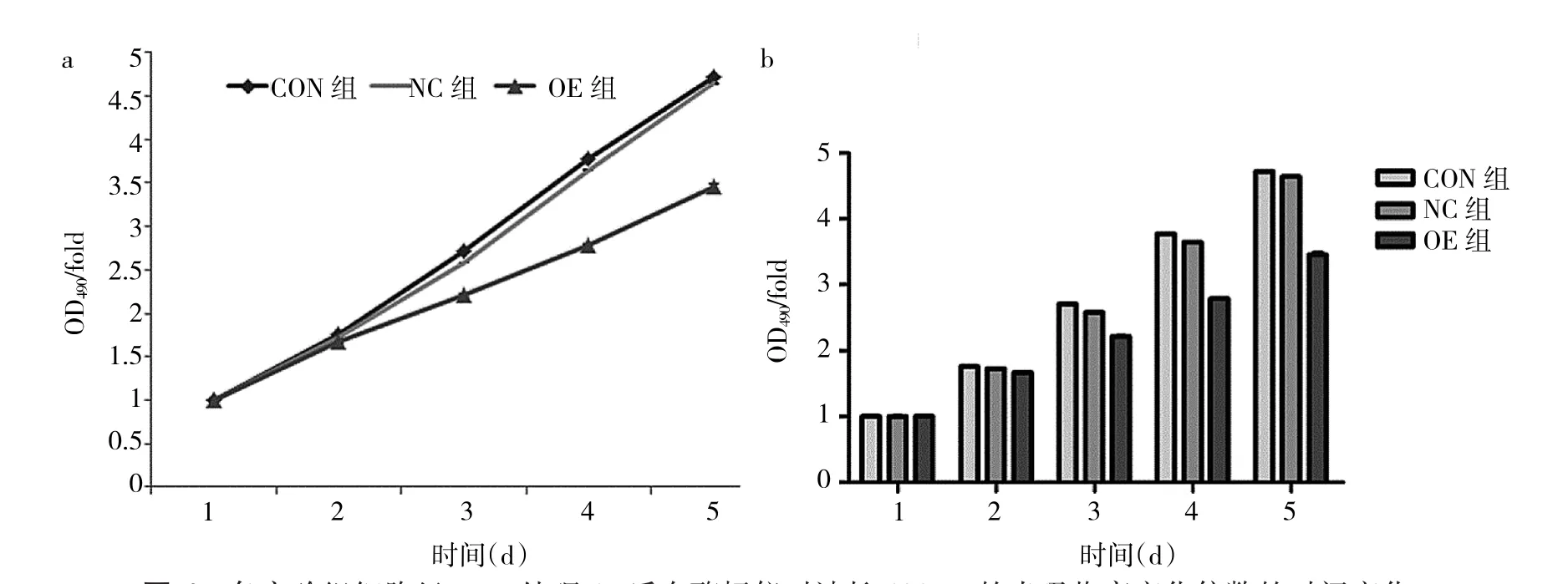
圖4 各實驗組細胞經MTT處理4h后在酶標儀對波長490nm的光吸收率變化倍數的時間變化

圖5 培養板內細胞克隆形成集落及100倍下單個集落明場合綠色熒光視野(a:NC組;b:OE組)
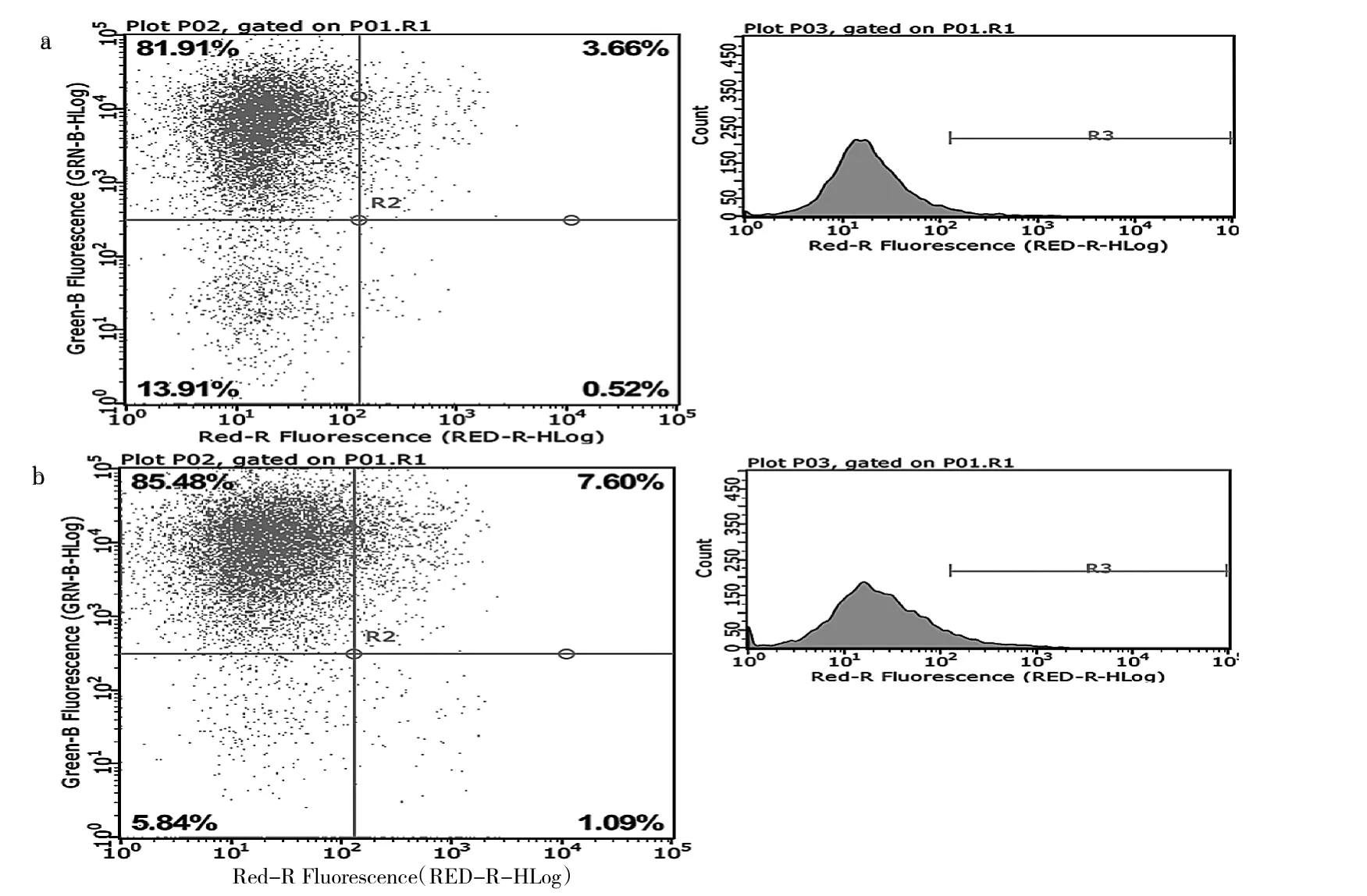
圖6 Annexin V-APC法流式細胞檢測散點圖(a:NC組;b:OE組)
本研究通過慢病毒轉染,使用miR-181a表達升高的U251細胞株,并通過MMT、細胞克隆形成和細胞凋亡等實驗檢測細胞功能改變。實驗結果表明轉染miR-181a后,U251增殖和克隆形成能力均明顯減弱,凋亡發生率明顯增加。與GBM組織標本中的miR-181a PCR實驗相互印證,為后期分子生物學研究提供了理論基礎。Ouyang等[12]利用熒光素酶標記法證實,miR-181能通過與目標基因mRNA的3′UTRs區特異性結合調節Bcl-2家族中的Bcl-2、Bcl-2-L11/Bim和Mcl-1(野生型)的表達;進一步用microRNA模擬物、microRNA抑制劑改變miR-181,發現miR-181對Bcl-2家族中的Bcl-2調控程度最高。Bcl-2能減少促凋亡因子(如細胞色素c等)從線粒體內釋放,抑制Caspase的激動,從而抑制凋亡的發生[13-14];本實驗結果顯示miR-181a增高可以正向調控凋亡的發生,間接印證了上述結論。相關文獻表明microRNA可直接靶向甲基轉移酶 DNMT,引起DNA甲基化改變而影響特定基因的表達[15-17]。本研究結果發現,在GBM中miR-181a的表達與MGMT蛋白呈正相關。因此,筆者推測MGMT并不是miR-181a的直接靶基因,miR-181a可能通過靶向甲基轉移酶而正向影響MGMT的蛋白表達。本研究還發現miR-181a與GBM瘤周水腫存在統計學關系。Ma等[18]發現miR-181a能通過靶向KLF6增加血瘤屏障的通透性,同時發現miR-181a的表達能抑制ZO-1、occludin和claudin-5蛋白的表達;而這些蛋白與內皮細胞之間的緊密連接通透性密切相關[19-20]。以上研究發現的機制在一定程度上解釋了miR-181a可增加GBM瘤周水腫的原因。
[1] Lewis B P,Burge C B,Bartel D P.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNAtargets[J].Cell,2005,120(1):15-20.
[2] Schwartzbaum J A,Fisher J L,Aldape K D,et al.Epidemiology and molecular pathology of glioma[J].Nat Clin Pract Neurol,2006,2(9):494-503.
[3] Ohgaki H,Dessen P,Jourde B,et al.Genetic pathways to glioblastoma:a population-based study[J].Cancer Res,2004,64(19):6892-6899.
[4] ShiL,Cheng Z,Zhang J,et al.hsa-mir-181a and hsa-mir-181b function as tumor suppressors in human glioma cells[J].Brain Res,2008,1236:185-193.
[5] Chen G,Zhu W,Shi D,et al.MicroRNA-181a sensitizes human malignant glioma U87MG cells to radiation by targeting Bcl-2[J].OncolRep,2010,23(4):997-1003.
[6] She X,Yu Z,Cui Y,et al.miR-181 subunits enhance the chemosensitivity of temozolomide by Rap1B-mediated cytoskeleton remodeling in glioblastoma cells[J].Medical Oncology,2014,31(4):1-10.
[7] Miska E A,Alvarez-Saavedra E,Townsend M,et al.Microarray analysis of microRNA expression in the developing mammalian brain[J].Genome Biol,2004,5(9):R68.
[8] Ciafre S A,Galardi S,Mangiola A,et al.Extensive modulation of a set of microRNAs in primary glioblastoma[J].Biochem Biophys Res Commun,2005,334(4):1351-1358.
[9] Wang J,Sai K,Chen F R,et al.miR-181b modulates glioma cell sensitivity to temozolomide by targeting MEK1[J].Cancer Chemother Pharmacol,2013,72(1):147-158.
[10] Gong A,Ge N,Yao W,et al.Aplysin enhances temozolomide sensitivity in glioma cells by increasing miR-181 level[J].Cancer Chemother Pharmacol,2014,74(3):531-538.
[11] Slaby O,Lakomy R,Fadrus P,et al.MicroRNA-181 family predicts response to concomitant chemoradiotherapy with temozolomide in glioblastoma patients[J].Neoplasma,2010,57(3):264-269.
[12] Ouyang YB,Lu Y,Yue S,et al.miR-181 targets multiple Bcl-2 family members and influences apoptosis and mitochondrial function in astrocytes[J].Mitochondrion,2012,12(2):213-219.
[13] Lucken-Ardjomande S,Martinou J C.Regulation of Bcl-2 proteins and of the permeability of the outer mitochondrial membrane[J].C R Biol,2005,328(7):616-631.
[14] Yang E,Korsmeyer S J.Molecular thanatopsis:a discourse on the BCL2 family and celldeath[J].Blood,1996,88(2):386-401.[15] Xiang Y,Ma N,Wang D,et al.MiR-152 and miR-185 co-contribute to ovarian cancer cells cisplatin sensitivity by targeting DNMT1 directly:a novel epigenetic therapy independent of decitabine[J].Oncogene,2014,33(3):378-386.
[16]Wang YS,Chou W W,Chen K C,et al.MicroRNA-152 mediates DNMT1-regulated DNA methylation in the estrogen receptor alpha gene[J].PLoS One,2012,7(1):e30635.
[17] Garzon R,Liu S,Fabbri M,et al.MicroRNA-29b induces global DNA hypomethylation and tumor suppressor gene reexpression in acute myeloid leukemia by targeting directly DNMT3A and 3B and indirectly DNMT1[J].Blood,2009,113(25):6411-6418.
[18] Ma J,Yao Y,Wang P,et al.MiR-181a regulates blood-tumor barrier permeability by targeting Kruppel-like factor 6[J].J Cereb Blood Flow Metab,2014,34(11):1826-1836.
[19] Rubin L L,Staddon J M.The cell biology of the blood-brain barrier[J].Annu Rev Neurosci,1999,22:11-28.
[20] Vorbrodt A W,Dobrogowska D H.Molecular anatomy of intercellular junctions in brain endothelial and epithelial barriers:electron microscopist's view[J].Brain Res Brain Res Rev,2003,42(3):221-442.
Expression of miR-181 family in glioblastoma and its clinical significance
WANG Chengde,LI Qun,LU Jianglong,et al.
Department of Neurosurgery,the First Affiliated Hospital of Wenzhou Medical University,Whenzhou 325000,China
Objective To investigate the expression of miR-181 family in multiform glioblastoma(GBM)and its correlation with clinicopathological characteristics of the tumor. Methods The expression of miR-181a,miR-181b,miR-181c and miR-181d was detected by loop RT-qPCR in tumor tissue specimens of 40 GBM patients.The relationship between miR-181 expression and clinicopathological characteristics was analyzed.The lentiviral vector carrying miR-181a was transfected into U251 cells,the proliferation clone-forming ability and apoptosis of miR-181a-transfected U251 cells were determined. Results The up-regulation of miR-181a expression was correlated with the survival of patients and peritumoral brain edema(P<0.05).Expression of miR-181a was significantly higher in patients with O6-methylguanine-DNA methyltransferase(MGMT)positive than those with MGMT negative(P<0.05).Cell studies indicated that the over-expression of miR-181a significantly inhibited the proliferation of U251 cells(P<0.01),reduced clone-forming ability(P<0.05),and increased apoptosis(P<0.05). Conclusion The expression of MiR-181a may be associated with the prognosis of GBM,and down-expression of miR-181a may be involved in the development of GBM.
miR-181 Glioblastoma MGMT
2016-11-30)
(本文編輯:陳丹)
10.12056/j.issn.1006-2785.2017.39.18.2016-2010
浙江省自然科學基金項目(LY16H160053);浙江省醫藥衛生科技計劃項目(2012RCA042);溫州市科技計劃項目(Y20120008)
325000 溫州醫科大學附屬第一醫院神經外科
蘇志鵬,E-mail:drsuzhipeng@163.com

