中和熱測(cè)定實(shí)驗(yàn)裝置改進(jìn)
程春春

摘 要:高三化學(xué)實(shí)驗(yàn)中和熱的測(cè)定,實(shí)驗(yàn)裝置的密閉性和保溫性不是十分理想,可利用初中物理實(shí)驗(yàn)所用的量熱杯進(jìn)行改進(jìn),并且在量熱杯的中間添加碎泡沫做填料,以增加隔熱效果。在量熱杯的蓋板上涂抹凡士林,以隔絕空氣的對(duì)流傳熱。將氫氧化鈉溶液注入鹽酸的操作過(guò)程中使用注射器,操作迅速簡(jiǎn)便,熱量散失的損失小。
關(guān)鍵詞:實(shí)驗(yàn)改進(jìn) 中和熱的測(cè)定 量熱杯 醫(yī)用注射器
高三化學(xué)實(shí)驗(yàn)中和熱的測(cè)定,是利用一個(gè)大燒杯、一個(gè)小燒杯和一塊塑料蓋板以及一些碎泡末填料,做成一套保溫隔熱裝置。由于燒杯與蓋板的密合性不是十分好,所以保溫效果不是很好。可以借用初中物理實(shí)驗(yàn)所用的量熱杯,在量熱杯中填充碎泡末。而且,在將氫氧化鈉溶液中倒入量熱器的小杯內(nèi),蓋上蓋板的過(guò)程中,耗費(fèi)時(shí)間,并且操作過(guò)程中容易將溶液灑到外面,所以改用醫(yī)用注射器進(jìn)行注入,使得操作更加簡(jiǎn)便迅速。
一、實(shí)驗(yàn)用品
量熱杯 蓋板 溫度計(jì) 注射器 環(huán)形攪拌棒 5ml量筒
碎塑料泡沫或者紙團(tuán) 0.50mol/L鹽酸溶液 0.55mol/L氫氧化鈉溶液
二、儀器制作
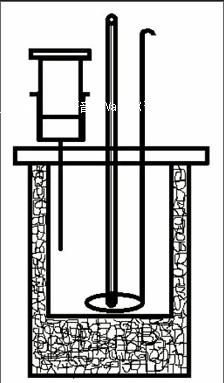
量熱杯的結(jié)構(gòu)為:外層為一個(gè)大的陶瓷圓筒杯,里面有一個(gè)小杯子。外面的大陶瓷杯和里面的小杯子之間填充碎塑料泡沫或紙團(tuán),作為隔熱層。上面的蓋板為圓形塑料板,塑料蓋板上有三個(gè)小孔,分別插入溫度計(jì)、環(huán)形攪拌棒、注射器針頭。蓋板上涂抹凡士林,以確保塑料蓋板和陶瓷大圓筒杯之間的縫隙被密封,沒(méi)有空氣流通,以達(dá)到隔熱保溫,減少實(shí)驗(yàn)過(guò)程中的熱量損失。(如圖所示)
三、實(shí)驗(yàn)步驟
用一個(gè)量筒取0.50mol/L的鹽酸50ml,倒入到量熱杯的里層小杯中,并用溫度計(jì)測(cè)量鹽酸的溫度,記入表中。然后,把溫度計(jì)上的鹽酸用水沖洗干凈。
用量筒取0.55mol/L氫氧化鈉溶液50ml,并用溫度計(jì)測(cè)量氫氧化鈉溶液的溫度,記入表中。再把量筒中的氫氧化鈉溶液抽入到注射器中,然后把注射器的針頭插入蓋板上的小孔中。
把插有溫度計(jì)、環(huán)形攪拌棒和注射器(裝有50ml氫氧化鈉溶液)的塑料蓋板蓋在量熱杯上。
將注射器內(nèi)的氫氧化鈉溶液注入到小杯的鹽酸中,用環(huán)形攪拌棒輕輕攪動(dòng)溶液,使溶液充分反應(yīng)完全,并準(zhǔn)確讀取反應(yīng)后混合溶液的最高溫度,記為終止溫度。
再重復(fù)實(shí)驗(yàn)2次。取3次實(shí)驗(yàn)數(shù)據(jù)的平均值,計(jì)算中和熱。
(T2-T1)的平均值=3.0℃
0.418(T2-T1)
ΔΗ= - ———————— KJ/mol
0.025
計(jì)算得:ΔΗ=-50.16 KJ/mol
中和熱測(cè)定實(shí)驗(yàn)的誤差分析:
1.為了保證0.50mol/L的鹽酸完全被中和,采用0.55mol/L的NaOH溶液。這是因?yàn)椋簤A液會(huì)吸收空氣中的CO2,使得堿液的濃度下降。
2.如果使用0.50mol/L的NaOH溶液,可以量取稍微多一點(diǎn)的堿液,但要注意:計(jì)算時(shí),溶液的總質(zhì)量也會(huì)增加。
3.不能以空氣的溫度去代替酸堿溶液的溫度,也不能以水的溫度去代替酸堿溶液的溫度,因?yàn)榭諝獾臏囟取⑺臏囟群腿芤旱臏囟炔皇且粯拥模怯胁罹嗟摹?/p>
4.不要使用剛配制好的溶液,最好使用前一天配置的溶液。這是因?yàn)椋呵耙惶炫渲频娜芤海瑴囟纫呀?jīng)穩(wěn)定下來(lái)了。
5.實(shí)驗(yàn)的環(huán)境溫度最好是在20℃左右,不宜低于10℃。在低溫的環(huán)境下,溶液容易散熱,會(huì)使得中和熱的測(cè)定值明顯偏低。
6.這個(gè)實(shí)驗(yàn)使用的是稀溶液,如果使用的是濃溶液,由于水溶劑的量不夠,即使是強(qiáng)酸強(qiáng)堿,若沒(méi)有足夠的水分子,也就不能完全電離為自由移動(dòng)的離子。酸堿溶液混合以后,發(fā)生中和反應(yīng)。在中和反應(yīng)的過(guò)程中,會(huì)伴隨著酸堿的電離和離子的水化。電離要吸收熱量,水化要放出熱量,就會(huì)導(dǎo)致不同濃度的溶液的這個(gè)熱量也不同,沒(méi)有一個(gè)統(tǒng)一的標(biāo)準(zhǔn)。但溶液的濃度也不宜太小,否則產(chǎn)生的中和熱太少,溫度變化很小,不易測(cè)出。本實(shí)驗(yàn)的酸堿濃度在0.10mol/L-1.0mol/L之間為宜。
7.本實(shí)驗(yàn)在測(cè)定的過(guò)程中,有許多難以克服的因素,會(huì)導(dǎo)致實(shí)驗(yàn)數(shù)據(jù)有誤差。比如,反應(yīng)容器要吸收一些熱量,反應(yīng)的空間要吸收一些熱量,實(shí)驗(yàn)數(shù)據(jù)的讀取也會(huì)產(chǎn)生誤差。
8.本實(shí)驗(yàn)的結(jié)果往往偏低,造成實(shí)驗(yàn)數(shù)據(jù)偏低的原因主要是:儀器的保溫效果差,避免不了熱量散失。容器和攪拌棒也會(huì)吸收少量的熱量。
9.在計(jì)算公式中,沒(méi)有采取酸堿溶液的比熱容和酸堿溶液的密度,而是采取了水的比熱容4.18J/g·℃和水的密度1g/cm3。實(shí)際上,酸堿溶液的比熱容、密度要比水的比熱容、密度要大一些,因此計(jì)算出的結(jié)果也比實(shí)際偏低。
10.溫度計(jì)應(yīng)使用有0.1分刻度的溫度計(jì),讀數(shù)盡量要準(zhǔn)。溫度計(jì)的水銀部分要全部浸沒(méi)在溶液中。要等反應(yīng)完全后,穩(wěn)定一段時(shí)間,再讀取溫度計(jì)的數(shù)據(jù)。
11.實(shí)驗(yàn)操作時(shí),動(dòng)作要快,盡量減少操作過(guò)程中的熱量散失。endprint

