胰島素結構改造的研究進展
李修政,林於紅,董家瀟,葉光明,姜云云
(1.安徽醫科大學解放軍九八臨床學院,浙江 湖州 230032;2.杭州康恩貝制藥有限公司,浙江 杭州 310051;3.解放軍101醫院,江蘇 無錫 214044)
胰島素結構改造的研究進展
李修政1,林於紅2,董家瀟1,葉光明3*,姜云云3*
(1.安徽醫科大學解放軍九八臨床學院,浙江 湖州 230032;2.杭州康恩貝制藥有限公司,浙江 杭州 310051;3.解放軍101醫院,江蘇 無錫 214044)
胰島素是一種由胰腺分泌的激素,一直是治療Ⅱ型糖尿病的一線藥物。由于胰島素是一種天然的多肽類化合物,因此存在穩定性差、體內代謝快等缺陷。針對這些問題,科研人員一直致力于對胰島素進行結構改造以開發出新型的胰島素類抗Ⅱ型糖尿病藥物。簡述了胰島素的結構及作用特點,綜述了近年來胰島素結構改造的研究進展,如對胰島素二硫鍵的修飾、胰島素序列的改造、胰島素肽鏈N-末端的修飾等,指出了開發高活性、低成本、高穩定性的胰島素結構改造類似物將是該領域未來發展的主要方向。
胰島素;類似物;結構改造;二硫鍵;糖尿病
Abstract:Insulin is a hormone secreted by the pancreas,which has been a first-line drug for the treatment of type Ⅱ diabetes.As a natural peptide compound,insulin has defects of poor stability and rapid metabolism invivo.Aiming at these problems,researchers have been committed to the structural modification of insulin in order to develop new types of insulin-like anti-type Ⅱ diabetic drugs.We briefly introduce the structure and characteristics of insulin,and emphatically review the research progress in the structural modification of insulin in recent years,such as the modification of disulfide bond of insulin,insulin sequences,and the N-terminus of insulin peptide chain.We also point out that development of insulin structural modification analogues with high activity,low cost,and high stablibity will be the main direction of future development.
Keywords:insulin;analogues;structural modification;disulfide bond;diabetes
1922年,Banting和Best第一次將胰島素用于臨床治療中,并取得了較好的效果。但胰島素最初只能從動物的胰腺中提取,而且得到的是粗產品。直到1960年,色譜技術被發現后,胰島素的分離純化才逐步被完善。我國在1965年完成了人工牛胰島素的全合成,這對于國際多肽合成領域的發展具有重大意義;20世紀70年代末,丹麥諾和諾德公司生產出半合成胰島素;1982年,美國禮來公司首次利用DNA重組技術合成人胰島素。胰島素是一種天然的多肽類化合物,存在穩定性差、體內代謝快等缺陷。針對這些問題,科研人員一直致力于對胰島素進行結構改造,1996年,第一個胰島素類似物通過對胰島素化學結構的改造和修飾而得到。目前,已經有300多個胰島素類似物被開發出來,有些已進入臨床應用[1]。作者綜述了近年來胰島素結構改造的研究進展,以期為合成高性能的胰島素類似物提供參考。
1 胰島素的結構及其作用特點
胰島素含有2條肽鏈,共有51個氨基酸殘基(圖1)。A鏈由11種21個氨基酸殘基組成,N端到C端依次是GIVEQCCTSICSLYQLENYCN,其中A6-A11由二硫鍵相連成環;B鏈由16種30個氨基酸殘基組成,從N端到C 端依次是 FVNQHLCGSHLVEALYLVCGERGFFYTPKT,而A鏈和B鏈又通過2個二硫鍵在CysA7-CysB7和CysA20-CysB19上相連構成胰島素分子。不同動物胰島素的組成中,氨基酸殘基的排列順序大都不相同[2]。研究發現,在諸多動物胰島素中,豬胰島素結構與人胰島素比較接近,所以早期人們常常使用豬胰島素作為臨床上的治療劑,也在此基礎上進行合成和改造。
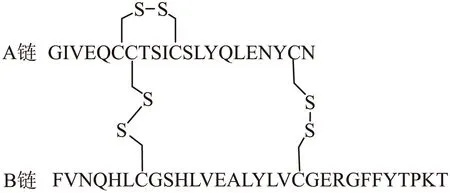
圖1 胰島素的化學結構Fig.1 Chemical structure of insulin
2 胰島素結構改造的研究進展
目前,市場上使用的胰島素大多通過DNA重組技術生產[3],以滿足巨大的全球需求。然而,如果化學合成的新型胰島素有效,則可以作為小眾市場(熱穩定性是一個區域性的問題)的治療劑。由于常規胰島素及其類似物有3個完全保守的二硫鍵的經典結構,這些結構對胰島素的穩定性至關重要,所以研究人員致力于開發較穩定且高效的胰島素及其類似物。胰島素及其類似物進入人體后,也存在許多潛在的問題:二硫鍵對某些還原劑(如硫醇)以及二硫化物異構酶不穩定,易導致結構重排和活性喪失。基于這種情況,研究人員向胰島素分子中引入更穩定的電子等排體,例如,用三唑[4-6]、硫醚[7]、硒醚[8]、內酰胺[9-10]等替換結構中的一個或幾個二硫鍵,以使其具有更好的熱穩定性。此外,胰島素序列的改造、末端修飾也具有重要意義。
2.1 基于二硫鍵的修飾
2.1.1 三唑替換CysA7-CysB7 中的二硫鍵
研究表明,CysA7-CysB7二硫鍵不同于其它2個二硫鍵,其占據胰島素的表面和空間結構中不整齊的區域,潛在地允許用一些穩定的模擬物替代這個二硫鍵。基于這個因素,Williams等[11]在前人工作的基礎上,提出了一種用1,2,3-三唑替換CysA7-CysB7二硫鍵的新的修飾方法。這種方法是通過固相肽合成(solid phase peptide synthesis,SPPS)方法在A鏈中的A7位置上形成一個炔丙基,在A20位置上用Acm作巰基的保護基。而B鏈是在類似于Wang樹脂的結構上進行,使其在B7位置上形成一個疊氮,B19同樣用Acm作巰基的保護基。在一定條件下,這2條鏈可形成一個多肽,然后對其切割,緊接著進行固相氧化,形成二硫鍵,再加入CuI通過Click反應[12]最終實現用三唑替換二硫鍵的結構修飾(圖2)。Williams等[11]在芋螺毒素MrIA中用三唑替換二硫鍵,使去甲腎上腺素的抑制活性功能保留,由此推測是由于對部分結構的還原和相關的空間折疊敏感性降低。Holland-Nell等[4]在Tachypiesin I中,用三唑替換二硫鍵,使抗菌肽的結構更接近完美的模擬,并且還顯示出較好的抗微生物活性。在A7和B7位置上成功引入1,2,3-三唑環,說明用三唑作為一個替代物在理論上是可行的,甚至在體內有耐降解的可能性,但分析結果表明,該替代物在體內的作用不明顯。所以,該模擬物在鏈中的位置以及替代的基團需要進一步研究。
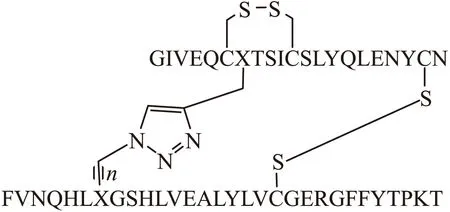
圖2 三唑替換二硫鍵的胰島素化學結構Fig.2 Chemical structure of insulin with triazole replace of disulfide bond
2.1.2 硫醚替換二硫鍵
基于胰島素及其類似物的結構特點,研究人員選用硫醚替換二硫鍵[13-15],因為硫醚更接近于模擬生物活性肽和蛋白質中的二硫鍵(圖3)。研究人員通過SPPS方法,使A鏈上的二硫鍵脫去一個硫[S-CH2]。二硫鍵的脫硫是形成硫醚的一種方法[16],這個反應在固相載體[17]上進行。通過游離硫醇鹽和鹵化側鏈之間發生的SN2反應,最終形成一個大環。但由于鹵素的空間位阻較大和易發生水解反應,反應的產率較低。針對這個弊端,使用預先形成的具有正交保護的硫醚結構單元[13-14],與內酰胺反應,最后生成大環。類似的替換方法還有很多,例如,Araujo等[8]發現硒醚可以很好地模擬胰島素中的二硫鍵,并且使其更加穩定。這種方法的功效已經在肽(催產素)中得到證實,其中合成的硒醚類似物的熱穩定性增加了20倍。
Cui等[13]制備了多種二碳環肽,其結構接近于天然產物,并且可以增強在生物體內的結構穩定性。
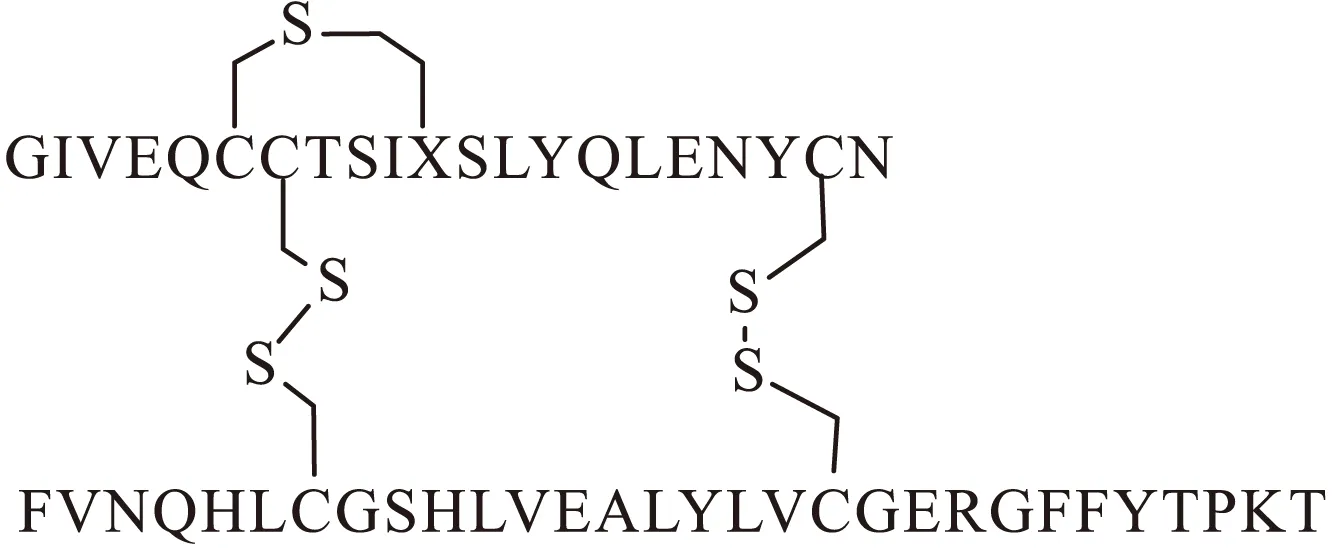
圖3 硫醚替換二硫鍵的胰島素化學結構Fig.3 Chemical structure of insulin with thioether replace of disulfide bond
2.2 基于胰島素序列的改造
Brems等[18]將B29位的賴氨酸與脯氨酸的殘基進行交換獲得修飾物1(圖4)。該修飾物能降低寡聚形式的穩定性,使胰島素更快地解離,進入到循環系統中,達到治療效果。類似的策略在天冬胰島素和谷氨酸胰島素中也被應用,在其B鏈上含有2個取代:天冬酰胺取代B3中的賴氨酸(修飾物2,圖4),谷氨酸取代B29中的賴氨酸(修飾物3,圖4)。第一種作為長效藥物上市的是NPH胰島素[19],其作用時間大約持續15~18 h;但是這種藥物也存在問題,因為胰島素在進入人體內6 h后達到峰值,因此,它不能在睡前服用,以避免夜間低血糖的發生。為此,Vague等[20]開發了甘精胰島素,A21位的天冬酰胺被甘氨酸取代,2個精氨酸殘基被添加到B鏈的C-末端(修飾物4,圖4)。甘精胰島素的等電點向中性pH值移動,減慢了毛細血管對藥物的吸收,在很大程度上降低了夜間低血糖的發生率。然而,由于該制劑顯酸性,不能與其它短效制劑混合使用,并且可能在注射期間導致疼痛。后來Kurtzhals[21]在甘精胰島素的基礎上對其進行改造,將B鏈的C-末端截短,消除了B30處的蘇氨酸殘基,B29處的賴氨酸被肉豆蔻基部分酰化(修飾物5,圖4)。使其不僅具有類似甘精胰島素的藥代動力學分布,而且可以配制成pH中性溶液。Kalra[22]進一步用脂肪二酸替換肉豆蔻基(修飾物6,圖4),使它在體內形成一個低聚物,這樣可以大大增強藥物的穩定性,使胰島素的生物活性在體內可持續24 h。
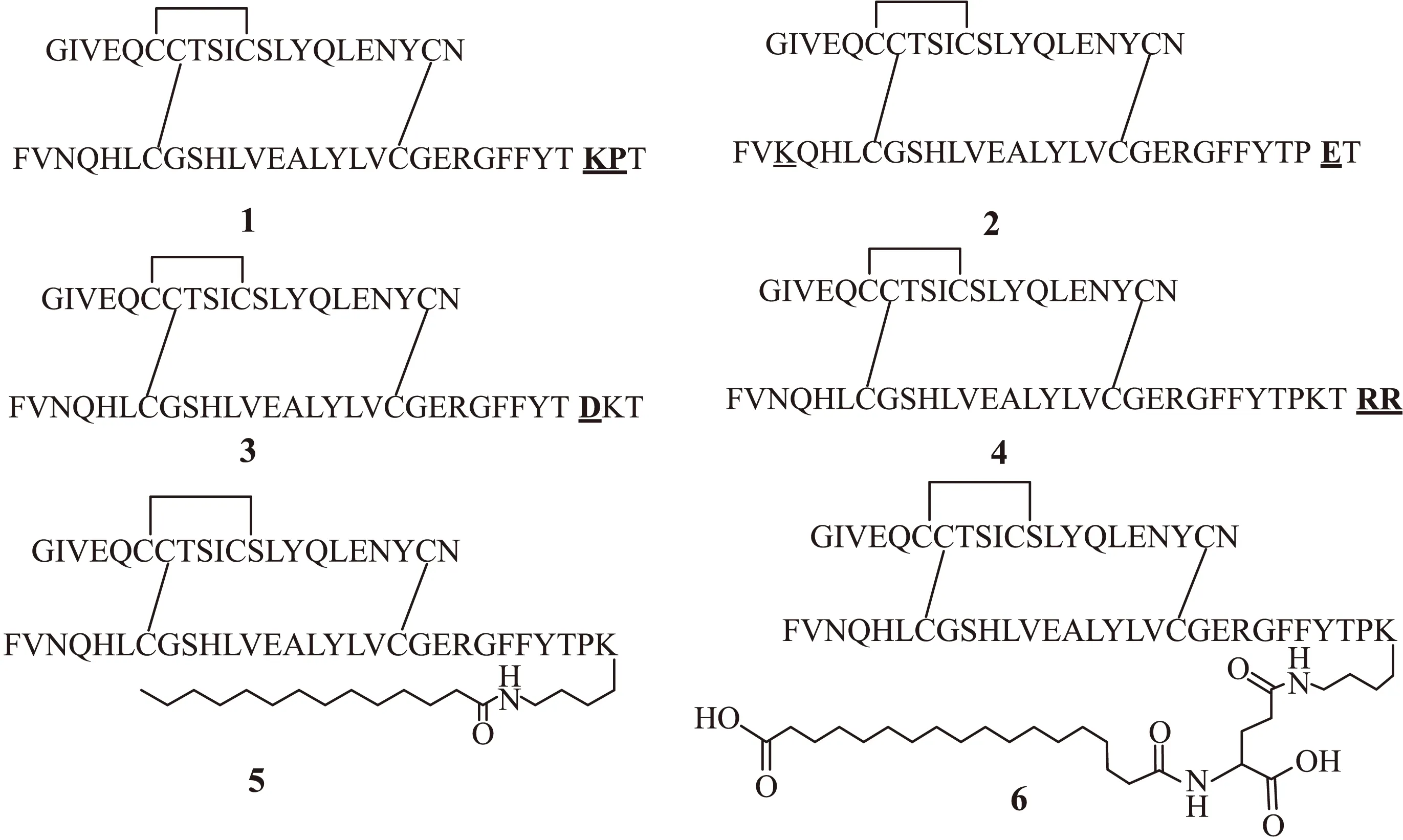
圖4 基于胰島素序列改造的系列化合物結構Fig.4 Structures of serial compounds based on the modification of insulin sequences
2.3 基于胰島素肽鏈N-末端的修飾
胰島素的2條鏈各有一個N-末端,分別是甘氨酸和苯丙氨酸,此外,其內部還有一個賴氨酸。Chen等[23]通過還原胺基化或酰化來選擇性地合成修飾胰島素A鏈的N-末端(圖 5),B鏈的N-末端用Fmoc保護起來。所得到N-芐基的修飾物7和N-苯甲酰基的修飾物8具有相似的結構,但是通過HEK293細胞測量Ser473的p-Akt水平可以發現,修飾物7比修飾物8的活性高5倍,并且與HI(人胰島素)也有相似的活性。這表明對于胰島素N-末端的修飾是可行的。為了進一步驗證該結果,將標有熒光素的胰島素在HEK293的細胞培養物中溫育30 min,然后觀察到修飾物7可以結合胰島素受體并且進入細胞,這表明該修飾不影響受體結合。雖然現在還沒有對此做進一步的臨床試驗,但為胰島素的N-末端修飾提供了一個生物學研究依據。

圖5 胰島素肽鏈N-末端的修飾Fig.5 Modification of the N-terminus of the insulin peptide chain
2.4 其它類型的修飾
研究表明,額外添加二硫鍵的胰島素類似物具有更好的熱穩定性和功能活性[24]。Vinther等[25]在A鏈的第10個氨基酸和B鏈的第4個氨基酸加入一個二硫鍵(圖6),所得到的胰島素類似物對胰島素受體的親和力增強,并且在動物(大鼠)體內的藥效動力學效能顯著增強。加入二硫鍵之后的胰島素類似物的熔融溫度升高了34.6 ℃,并且在高物理應力下阻止了胰島素原纖維的形成,這表明直接參與原纖維形成的B鏈的C-末端未被改變。重要的是,該胰島素類似物在加入Zn2+時能夠形成六聚體(六聚體形式的胰島素更穩定),其晶體結構與經典胰島素的結構僅存在微小差別。
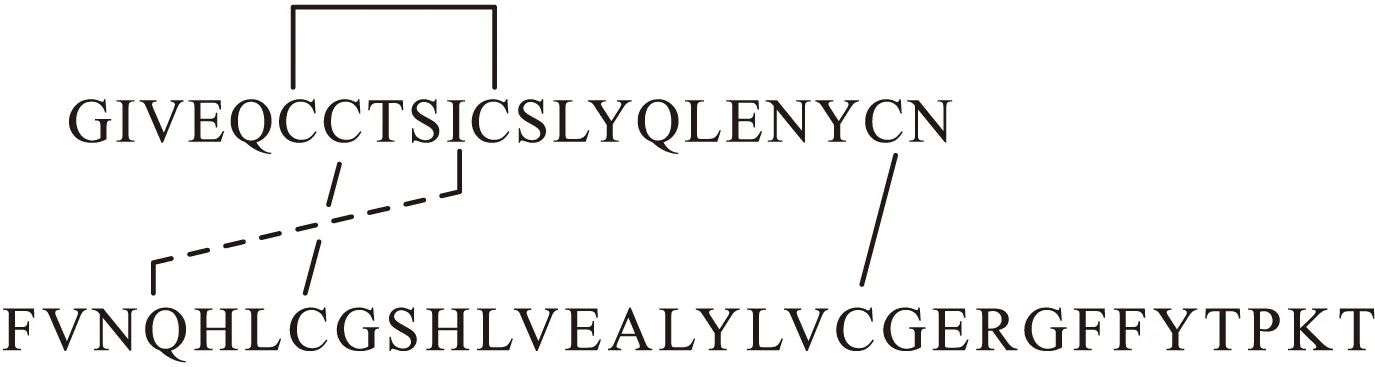
圖6 胰島素附加二硫鍵的結構Fig.6 Structure of insulin with additional disulfide bond
Hua等[26]通過一條多肽鏈(1-2:RKQLSGELALPQLSGAGPGGGLEVQGVQLDEAERR)將胰島素2條鏈連接在一起(圖7)。該肽鏈是單鏈前體胰島素原的產物,其含有A鏈和B鏈連接的無序多肽序列。雖然胰島素原保留了天然胰島素的部分,但其活性比胰島素低50倍。將連接肽(胰島素原中的35個殘基)切除后,激素可以通過專門的通道在含有Zn2+的六聚體中儲存。六聚體在門靜脈循環中解離,使激素能夠作為無鋅單體在血液中發揮作用。
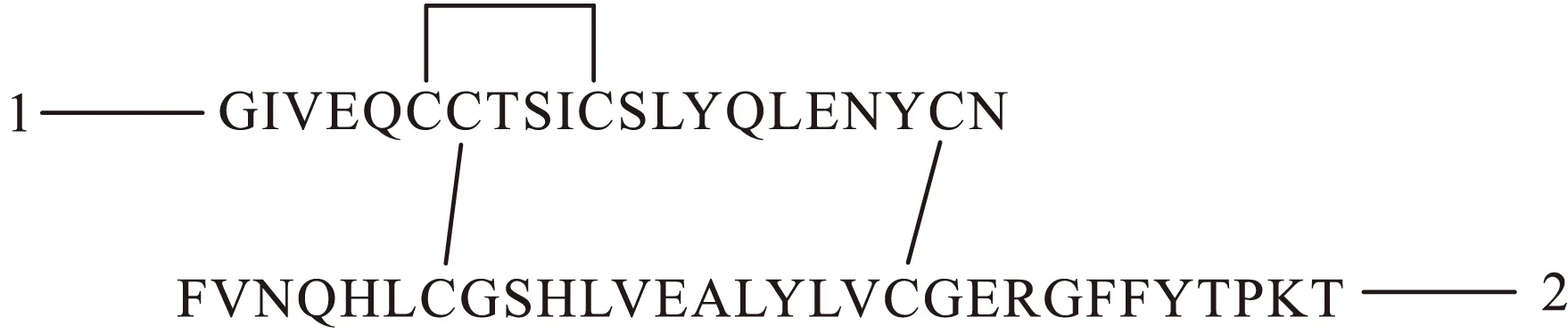
圖7 單鏈胰島素的結構Fig.7 Structure of single chain insulin
3 結語
作為治療Ⅱ型糖尿病的一線藥物,胰島素的結構改造已成為當前糖尿病藥物開發領域的研究熱點。隨著對胰島素及其類似物構效關系的進一步闡明以及多肽合成技術的快速發展,人們通過胰島素結構修飾必將獲得高活性、低成本和穩定性強的胰島素替代物,以便更好地造福糖尿病患者。
[1] 張春云,蔡永明,張駿,等.胰島素及其類似物的研究進展[J].藥物評價研究,2010,33(6):436-441.
[2] 葉蘊華.淺談胰島素的結構與生物活性[J].大學化學,2010,25(B4):19-23.
[3] KROEF E P,OWENS R A,CAMPBELL E L,et al.Production scale purification of biosynthetic human insulin by reversed-phase high-performance liquid chromatography[J].Journal of Chromatography,1989,461(1):45-61.
[4] HOLLAND-NELL K,MELDAL M.Maintaining biological activity by using triazoles as disufide bond mimetics[J].Angewandte Chemie International Edition,2011,50(22):5204-5206.
[5] EMPTING M,AVRUTINA O,MEUSINGER R,et al.“Triazole bridge”:disulfide-bond replacement by ruthenium-catalyzed formation of 1,5-disubstituted 1,2,3-triazoles[J].Angewandte Chemie International Edition,2011,50(22):5207-5211.
[6] GORI A,WANG C I A,HARVEY P J,et al.Stabilization of the cysteine-rich conotoxin MrIA by using a 1,2,3-triazole as a disulfide bond mimetic[J].Angewandte Chemie International Edition,2015,54(4):1361-1364.
[7] KARAS J A,PATIL N A,TAILHADES J,et al.Total chemical synthesis of an intra-A-chain cystathi onine human insulin analogue with enhanced thermal stability[J].Angewandte Chemie International Edition,2016,55(47):14743-14747.
[8] de ARAUJO A D,MOBLI M,CASTRO J,et al.Selenoether oxytocin analogues have analgesic properties in a mouse model of chronic abdominal pain[J].Nature Communications,2014,5(1):3165.
[9] BüLLESBACH E E,SCHWABE C.Replacement of disulfides by amide bonds in the relaxin-like factor(RLF/INSL3) reveals a role for the A11-B10 link in transmembrane signaling[J].Biochemistry,2012,51(20):4198-4205.
[10] KARAS J,SHABANPOOR F,HOSSAIN M A,et al.Total che-mical synthesis of a heterodimeric interchain bis-lactam-linked peptide:application to an analogue of human insulin-like peptide 3[J].International Journal of Peptides,2013,2013(23):504260.
[11] WILLIAMS G M,LEE K,LI X,et al.Replacement of the CysA7-CysB7 disulfide bond with a 1,2,3-triazole linker causes unfolding in insulin glargine[J].Organic & Biomolecular Chemistry,2015,13(13):4059-4063.
[12] ROICE M,JOHANNSEN I,MELDAL M.High capacity poly(ethylene glycol) based amino polymers for peptide and organic synthesis[J].Molecular Informatics,2004,23(8):662-673.
[13] CUI H K,GUO Y,HE Y,et al.Diaminodiacid-based solid-phase synthesis of peptide disulfide bond mimics[J].Angewandte Chemie International Edition,2013,52(36):9558-9562.
[14] KNERR P J,TZEKOU A,RICKLIN D,et al.Synthesis and activity of thioether-containing analogues of the complement inhibitor compstatin[J].ACS Chemical Biology,2011,6(7):753-760.
[15] DEKAN Z,VETTER I,DALY N L,et al.α-Conotoxin ImI incorporating stable cystathionine bridges maintains full potency and identical three-dimensional structure[J].Journal of the American Chemical Society,2011,133(40):15866-15869.
[16] GALANDE A K,TRENT J O,SPATOLA A F.Understanding base-assisted desulfurization using a variety of disulfide-bridged peptides[J].Peptide Science,2003,71(5):534-551.
[17] MAYER J P,HEIL J R,ZHANG J,et al.An alternative solid-phase approach to C1-oxytocin[J].Tetrahedron Letters,1995,36(41):7387-7390.
[18] BREMS D N,ALTER L A,BECKAGE M J,et al.Altering the association properties of insulin by amino acid replacement[J].Protein Engineering,1992,5(6):527-533.
[19] CLARKE J,HENRICK K,FERSHT A R.Disulfide mutants of barnase Ⅰ:changes in stability and structure assessed by biophysical methods and X-ray crystallography[J].Journal of Molecular Biology,1995,253(3):493-504.
[20] VAGUE P, SELAM J L, SKEIE S,et al.Insulin detemir is associated with more predictable glycemic control and reduced risk of hypoglycemia than NPH insulin in patients with type 1 diabetes on a basal-bolus regimen with premeal insulin aspart[J].Diabetes Care,2003,26(3):590-596.
[21] KURTZHALS P. Engineering predictability and protraction in a basal insulin analogue: the pharmacology of insulin detemir[J].International Journal of Obesity,2004,28(S2):23-28.
[22] KALRA S.Insulin degludec:a significant advancement in ultralong-acting basal insulin[J].Diabetes Therapy,2013,4(2):167-173.
[23] CHEN D,DISOTUAR M,XIONG X,et al.Selective N-terminal functionalization of native peptides and proteins[J].Chemical Science,2017,8(4):2717-2722.
[24] MCAULEY A,JACOB J,KOLVENBACH C G,et al.Contributions of a disulfide bond to the structure,stability,and dimerization of human IgG1 antibody CH3 domain[J].Protein Science,2008,17(1):95-106.
[25] VINTHER T N,NORRMAN M,RIBEL U,et al.Insulin analog with additional disulfide bond has increased stability and preserved activity[J].Protein Science,2013,22(3):296-305.
[26] HUA Q,NAKAGAWA S H,JIA W,et al.Design of an active ultrastable single-chain insulin analog synthesis,structure,and ther-apeutic implications[J].Journal of Biological Chemistry,2008,283(21):14703-14716.
ResearchProgressinStructuralModificationofInsulin
LI Xiu-zheng1,LIN Yu-hong2,DONG Jia-xiao1,YE Guang-ming3*,JIANG Yun-yun3*
(1.PLA98thClinicalCollege,AnhuiMedicalUniversity,Huzhou230032,China;2.HangzhouCONBAPharmaceuticalCo.,Ltd.,Hangzhou310051,China;3.PLA101Hospital,Wuxi214044,China)
TQ467.2
A
1672-5425(2017)09-0015-04
2017-04-09
李修政(1992-),男,山東棗莊人,碩士研究生,研究方向:藥物化學,E-mail:1826881912@qq.com;通訊作者:葉光明,副主任藥師,副教授,E-mail:shygm98@163.com;姜云云,副主任藥師,E-mail:20791374@qq.com。
10.3969/j.issn.1672-5425.2017.09.003
李修政,林於紅,董家瀟,等.胰島素結構改造的研究進展[J].化學與生物工程,2017,34(9):15-18,23.

