堿脅迫應答基因GsARHP的克隆及轉基因紫花苜蓿的耐堿性分析
陳冉冉,朱娉慧,賈博為,宋雪薇,王子君,李佶娜,李強,丁曉東,朱延明
(東北農業(yè)大學農業(yè)生物功能基因重點實驗室,黑龍江 哈爾濱 150030)
堿脅迫應答基因GsARHP的克隆及轉基因紫花苜蓿的耐堿性分析
陳冉冉**,朱娉慧**,賈博為,宋雪薇,王子君,李佶娜,李強,丁曉東,朱延明*
(東北農業(yè)大學農業(yè)生物功能基因重點實驗室,黑龍江 哈爾濱 150030)
本研究基于實驗室前期野生大豆堿脅迫轉錄組數(shù)據(jù),篩選出一個堿脅迫下上調表達的假定蛋白基因,暫命名為GsARHP(alkali stress related hypothetical protein gene)。首先利用Real-time PCR方法驗證了GsARHP基因受堿脅迫誘導表達。生物信息學分析表明,該基因編碼一個含有130個氨基酸的親水蛋白,含有信號肽但無跨膜結構域;構建了GsARHP植物超量表達載體,利用農桿菌介導的子葉節(jié)侵染法轉化肇東紫花苜蓿,通過PCR,Southern Blot和RT-PCR方法檢測獲得了3個超量表達GsARHP基因的轉基因株系,并對其耐堿性進行了分析。結果表明,在0,100和150 mmol/L NaHCO3處理14 d后,非轉基因株系明顯萎蔫、黃化甚至死亡,而轉基因株系則長勢良好;進一步分析其生理指標顯示,相對質膜透性與丙二醛含量均顯著低于非轉基因株系(P<0.01),而葉綠素含量與CAT活性顯著高于非轉基因株系(P<0.01),說明GsARHP基因的超量表達可以增強紫花苜蓿的耐堿能力。
野生大豆;GsARHP基因;堿脅迫;紫花苜蓿;遺傳轉化
目前,世界各地主要的農作物減產是由非生物脅迫造成的[1]。植物長期處于不良環(huán)境中,會使植物體內產生相關生理代謝反應,致使植物機體產生結構和功能上的改變,嚴重時甚至會造成不可逆的損傷,導致整個植株死亡[2]。其中,鹽堿脅迫是影響植物生長最主要的環(huán)境因素之一,大面積的鹽堿化土地嚴重限制了農業(yè)可持續(xù)發(fā)展和生態(tài)環(huán)境的恢復,制約著全世界作物產量[3]。鹽堿對土壤的危害是由于土壤中對作物有害的陰、陽離子富集所致,如CO32-、HCO3-、Cl-等陰離子和Na+、Ca2+等陽離子[4]。土壤內積累大量鹽分會引起土壤肥力降低,有機質含量減少,理化性狀改變等現(xiàn)象,研究表明土壤鹽分的積累,會擾亂植物體內離子平衡,破壞植物正常的新陳代謝機能,阻礙蛋白質的合成與水解,引起可溶性鹽離子在體內的積聚,從而產生離子毒害,危及植物的生長發(fā)育[5],導致植物代謝受阻,生長發(fā)育受到抑制,進一步萎蔫甚至死亡[6]。合理開發(fā)利用鹽堿化土地成為推動現(xiàn)代農業(yè)發(fā)展、改善生態(tài)環(huán)境的重要任務之一[2-7]。目前,關于鹽堿脅迫,研究較集中在中性鹽(NaCl)對植物的危害[8-13],但是,堿土除了具有中性鹽的脅迫特征外,還具有高pH特征,堿土高度離散,濕時膨脹,干時板結,通透性很差,嚴重妨礙作物的生長發(fā)育,比中性鹽的危害更嚴重,因此對堿性鹽的研究更具有現(xiàn)實意義。
紫花苜蓿(Medicagosativa)是一種世界性廣泛種植的優(yōu)良牧草,富含蛋白質、多種維生素和礦物質,是營養(yǎng)豐富的飼料植物[14]。紫花苜蓿具有較強的抗逆性,擁有抗寒、耐旱、耐鹽堿等特性[1],是改良和開發(fā)鹽堿地的重要作物之一。牧草作物一般具有發(fā)達的根系,在鹽堿化土地上種植可以使土壤惡化的理化性質逐漸得到改善,減輕鹽堿化土地對植物的危害,可以在培育牧草的過程中達到改善鹽堿土地的目的[14-16]。但紫花苜蓿有限的耐堿能力[17],限制了它的栽種范圍,所以亟需對其耐堿性狀進行改良,培育耐堿性強的紫花苜蓿新品種,增強其在鹽堿地區(qū)的生長能力,擴大種植范圍,以期充分開發(fā)利用鹽堿化土地資源。采用傳統(tǒng)的育種方法,培育耐鹽堿新品種進展緩慢耗時耗力。目前,利用基因工程技術向植物導入抗逆相關的目的基因,提高植物的耐鹽堿性,已成為提高農牧業(yè)生產,培育抗逆新品種的重要途徑。
根據(jù)實驗室對東北野生大豆(Glycinesoja)Gs07256轉錄組測序數(shù)據(jù),堿脅迫下對照組與不同時間點處理組的表達差異,從野生大豆根中篩選出3380個堿脅迫應答基因[18],在分析野生大豆鹽堿脅迫應答的差異表達基因時,篩選出一個堿脅迫后上調表達的假定蛋白基因GsARHP,假定蛋白是指因功能未知而未被鑒定的新基因編碼的蛋白[19],其在堿脅迫基因表達圖譜中呈現(xiàn)上調表達[18],因此推測GsARHP很可能也參與了植物對堿脅迫的響應。
為確定該基因在堿脅迫應答中的作用,本研究以紫花苜蓿為受體材料,構建由強組成型啟動子CaMV35S調控的超量表達GsARHP基因的植物表達載體,利用根癌農桿菌EHA105對紫花苜蓿進行遺傳轉化,獲得轉基因植株。通過PCR,Southern Blot,RT-PCR的方法鑒定轉基因植株。分析轉基因植株的生長發(fā)育狀況和耐堿能力,初步確定該假定蛋白基因在堿脅迫應答中的功能。本研究為進一步研究假定蛋白基因GsARHP在堿脅迫應答調控中的作用機制奠定了重要的理論基礎,對于建立紫花苜蓿分子育種技術體系,培育耐堿功能顯著的轉基因紫花苜蓿新株系,充分利用并改良我國鹽堿地資源,具有重要的實際應用價值和廣闊的開發(fā)前景。
1 材料與方法
1.1實驗材料
野生大豆(Gs07256),采自吉林省白城市鹽堿地。大腸桿菌DH5α、農桿菌EHA105菌株與植物表達載體pCAMBIA330035Su均由東北農業(yè)大學農業(yè)生物功能基因重點實驗室保存;轉化受體為肇東紫花苜蓿,由黑龍江省農業(yè)科學院草業(yè)研究所提供。
1.2GsARHP基因的克隆與表達模式分析
根據(jù)野生大豆與大豆的高度同源性,利用同源克隆技術,根據(jù)GsARHP在栽培大豆中的同源基因(Glyma17g07720)序列設計特異的PCR引物(GsARHP-S:5′-ATGGCCGCTACTATGAAG-3′;GsARHP-AS:5′-TTACTTTCCATTACCACCG-3′),以野生大豆cDNA作為模板,通過PCR擴增獲得目的基因的完整CDS區(qū)。
選取長勢一致的3周齡的野生大豆幼苗,置于50 mmol/L NaHCO3條件下處理0,1,3,6,12,24 h后迅速剪取根尖部分,提取總RNA,經(jīng)反轉錄得到cDNA,以野生大豆GAPDH基因作為內參,結合基因特異性引物進行Real-time PCR,實驗設置3次生物學重復以及3次技術重復,分析目的基因在堿脅迫處理下的表達模式。
1.3GsARHP基因生物信息學分析
通過ORF Finder(http://www.ncbi.nlm.nih.gov/gorf/orfig.cgi)查找序列的開放閱讀框,最終確定基因GsARHP完整的全長序列。通過TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM-2.0/)預測蛋白質親疏水性與蛋白質跨膜結構域;經(jīng)SignalP4.1(http://www.cbs.dtu.dk/services/SignalP/)預測基因產物信號肽;TargetP(http://www.cbs.dtu.dk/services/TargetP/)預測蛋白質亞細胞定位;分析蛋白一級結構。利用GOR4(http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)預測蛋白質二級結構,MotifScan(http://myhits.isb-sib.ch/cgi-bin/motif_scan)軟件尋找蛋白質的結構域;確定該假定蛋白基本特性。
1.4植物表達載體的構建及轉基因紫花苜蓿的培育
采用基于USERTM克隆技術的pCAMBIA330035Su載體作為植物超量表達載體。根據(jù)GsARHP基因序列設計的基因特異PCR擴增引物,在其上游引物中添加GGCTTAAU接頭,在下游引物中添加GGTTTAAU接頭。采用PfuTurbo Cx Hotstart DNA polymerase,PCR擴增GsARHP基因[20-21]。構建由煙草花葉病毒CaMV35S強啟動子調控,Bar基因作為篩選標記基因的高水平組成型植物表達載體。利用凍融法將植物表達載體導入農桿菌EHA105,用于紫花苜蓿的遺傳轉化。
采用農桿菌侵染子葉節(jié)的方法進行紫花苜蓿的遺傳轉化[22]。種子經(jīng)滅菌萌發(fā)后,將培養(yǎng)8 d的無菌苗從子葉節(jié)下部約1 mm膨大處剪取子葉節(jié),經(jīng)農桿菌侵染后,接種于含有100 μmol/L乙酰丁香酮的MS培養(yǎng)基上共培養(yǎng)3~5 d,除菌后,將外植體接種到添加草甘膦(0.5 mg/L)的固體篩選培養(yǎng)基上篩選培養(yǎng),當抗性芽約2 cm長以后,進行生根處理并將其轉入生根培養(yǎng)基中誘導生根,2周左右生根,馴化2~3 d后移栽。獲得抗性再生植株。
1.5再生植株的分子生物學檢測
再生植株的分子生物學檢測分為基因水平的PCR檢測,Southern Blot檢測和轉錄水平的RT-PCR檢測。提取抗性植株的總DNA,利用篩選標記基因Bar基因的特異引物進行PCR檢測,陽性對照為含有目的基因的重組質粒DNA,陰性對照為未轉基因植株的總DNA,初步確定目的基因已整合入再生植株的基因組中。對PCR陽性的再生植株進行Southern Blot檢測,制備基因特異性探針,確定目的基因的整合及基因拷貝數(shù)。為檢測已整合的目的基因在再生植株中轉錄水平的表達情況,對Southern Blot陽性植株進行RT-PCR半定量檢測,選取Southern Blot陽性轉基因植株,紫花苜蓿GAPDH基因作為內參基因(GeneBank登錄號為MTR_4G131180),進行轉錄水平分析。
1.6堿脅迫下轉基因植株生理指標檢測
實驗于2016年8—10月在東北農業(yè)大學園藝站溫室內進行,設置3次重復。
由于紫花苜蓿異花授粉和生長周期長等特點,利用有性生殖進行擴繁存在耗時及不穩(wěn)定等問題。因此,本研究采用扦插擴繁的方式來獲得扦插苗,選取轉基因植株和未轉基因植株木質化程度較高且均勻一致的莖段進行扦插擴繁,剪取帶有2~3個生長節(jié)點的莖段,采用生根粉浸泡2 h處理,待莖段生根后,移栽到含有蛭石∶珍珠巖=1∶1的小缽(直徑5 cm,高6 cm,每缽1株)中,1000 lx光照,16 h/8 h的光照/黑暗周期,26 ℃/18 ℃晝夜溫度的條件下培養(yǎng)4周后,挑選生長狀態(tài)一致的轉基因和未轉基因的扦插苗,分別用含有0,100和150 mmol/L NaHCO3的1/8 Hoagland營養(yǎng)液處理,營養(yǎng)液每2 d更換一次,期間觀察記錄表型,14 d后取出植株,洗凈珍珠巖,利用刻度尺測量植株根長與株高。
采用80%丙酮研磨提取葉綠素,比色法[23]檢測葉綠素含量,采用電導法[24-25]檢測相對質膜透性。利用硫代巴比妥酸(TBA)比色法[23]測定丙二醛(malondialdehyde,MDA)含量,采用過氧化氫法[26]檢測過氧化氫酶(catalase,CAT)含量。
2 結果與分析
2.1GsARHP基因的篩選與克隆
2.1.1基于轉錄組數(shù)據(jù)的GsARHP篩選 根據(jù)實驗室對東北野生大豆Gs07256轉錄組測序數(shù)據(jù),從中選取在NaHCO3脅迫處理下根中表達量顯著上調的基因GsARHP,結果見圖1A。從圖中可以看出,GsARHP在根中脅迫處理6 h時表達量達到最高值。采用Real-time PCR方法分析堿脅迫處理下不同時間點GsARHP基因在野生大豆中轉錄水平表達量的變化(圖1B),以驗證轉錄組測序數(shù)據(jù)。實時熒光定量PCR分析結果表明,在50 mmol/L NaHCO3脅迫處理下,GsARHP基因根中的表達量在12 h達到峰值。
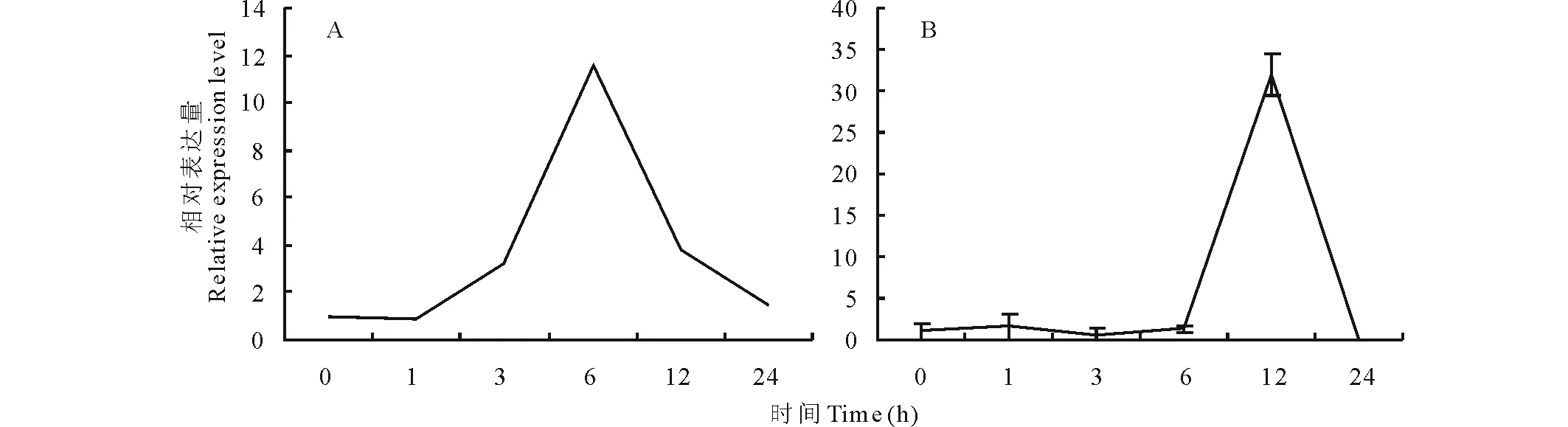
圖1 堿脅迫下GsARHP基因表達特性分析Fig.1 GsARHP gene expression characteristics analysis under alkali stress A: GsARHP基因轉錄組測序結果RNA-seq result of GsARHP; B:GsARHP 基因Real-time PCR結果Real-time PCR result of GsARHP.
與轉錄組數(shù)據(jù)結果比較來看,雖然GsARHP基因
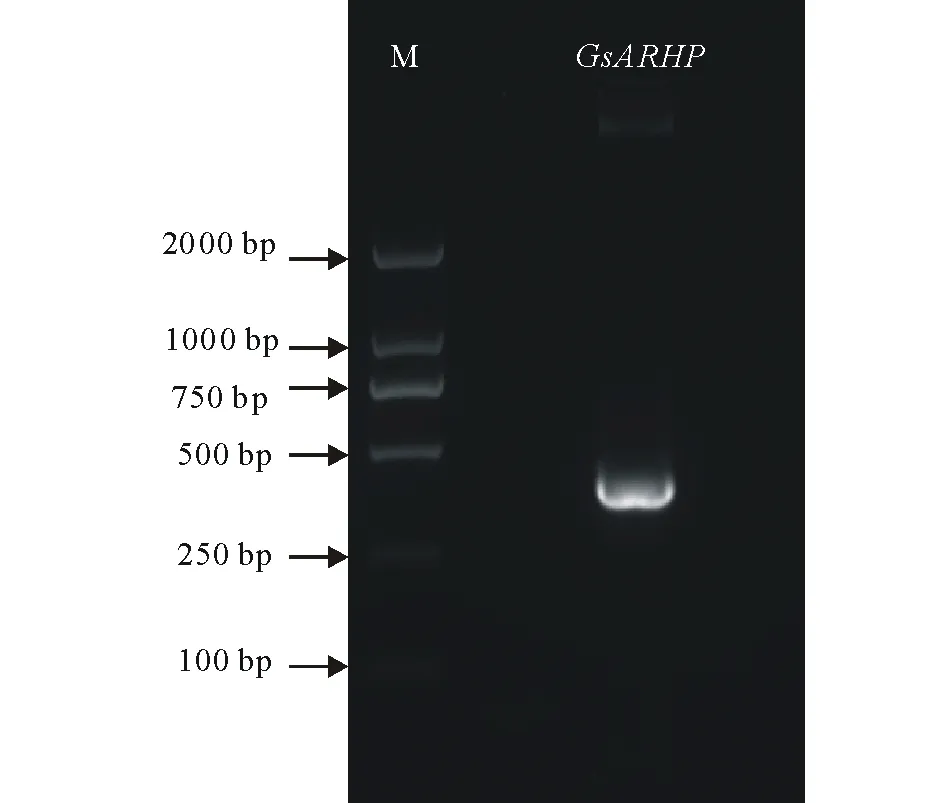
圖2 GsARHP基因的PCR擴增Fig.2 PCR amplification of GsARHP gene
對脅迫響應的時間點有所推后,但變化趨勢仍然基本一致。確定該基因為堿脅迫應答候選基因。
2.1.2GsARHP基因的克隆 提取野生大豆總RNA,反轉錄得到cDNA模板,利用目的基因特異性引物,進行PCR擴增。如圖2所示,克隆得到長約390 bp的DNA條帶(圖2)。將回收得到的PCR產物連接到載體pCAMBIA330035Su上,轉化大腸桿菌,采用PCR技術鑒定陽性轉化子,將陽性克隆送交測序,測序結果表明序列正確,成功的克隆得到GsARHP基因。
2.2GsARHP基因生物信息學分析
2.2.1GsARHP基因序列分析 對GsARHP基因全長序列進行序列分析,根據(jù)Phytozome(https://phytozome.jgi.doe.gov/pz/portal.html)上提供全序列分析GsARHP基因全長cDNA序列及推導的氨基酸序列,如圖3所示,該基因全長為846 bp,包含127 bp 5′端非編碼區(qū)序列(5′-UTR)與326 bp 3′端非編碼區(qū)序列(3′-UTR),將測序所得到的序列在NCBI“ORF finder”預測開放閱讀框(ORF),預測最長ORF為393 bp,編碼130個氨基酸,與預期結果一致。因此,根據(jù)以上結果,認為此克隆序列已包含目的基因GsARHP的完整ORF。可以用于下一步實驗。

圖3 假定蛋白基因GsARHP全長cDNA序列及推導的氨基酸序列Fig.3 Full-length cDNA sequence and deduced amino acid sequence of GsARHP
2.2.2GsARHP蛋白結構預測 采用ProtParam軟件預測蛋白質一級結構。假定蛋白基因共編碼130個氨基酸,其中,甘氨酸的含量最高(29.2%),其次為絲氨酸(23.1%)、丙氨酸(14.6%)和亮氨酸(6.2%)。分子質量11.428 kD,等電點7.91,不穩(wěn)定指數(shù)32.13,表明GsARHP為一個穩(wěn)定蛋白。通過Protscale軟件預測氨基酸的親水性和疏水性,利用Hphob./Kyte&Doolittle算法得到如圖4所示結果:該蛋白親水性氨基酸均勻分布在整個肽鏈中且多于疏水性氨基酸。證明該基因編碼蛋白是一種親水性蛋白。
經(jīng)GOR4預測,GsARHP蛋白二級結構由如下3個部分組成:無規(guī)卷曲共89個氨基酸,占68.46%,延伸片段共23個氨基酸,占17.69%,α螺旋共18個氨基酸,占13.85%。用TMHMM 2.0預測蛋白質的跨膜結構,表明該蛋白無跨膜結構域,用SignalIP 4.1預測信號肽及可能的切割位點,表明該多肽鏈含有信號肽,多肽鏈上信號肽的切割位點可能是第19~20位氨基酸殘基。經(jīng)TargetP預測,該蛋白可能是經(jīng)分泌通路信號肽引導的胞外蛋白;用MotifScan軟件尋找蛋白質的結構域,未發(fā)現(xiàn)功能結構域。
2.3GsARHP基因對紫花苜蓿的遺傳轉化
2.3.1植物表達載體構建 植物表達載體構建如圖5,將送交測序并確定構建正確的重組質粒采用凍融法導入農桿菌EHA105中,對轉化子進行菌落PCR鑒定,與陽性重組質粒相比,均擴增出約390 bp的片段,表明攜帶該目的基因的重組質粒已成功導入根癌農桿菌中,可用于下一步的農桿菌介導侵染子葉節(jié)法轉化紫花苜蓿。
2.3.2GsARHP基因對紫花苜蓿的遺傳轉化 采用農桿菌介導的子葉節(jié)侵染方法對紫花苜蓿進行遺傳轉化(圖6)。經(jīng)過無菌苗培育、子葉節(jié)預培養(yǎng)、農桿菌侵染、共培養(yǎng)、不定芽誘導分化、伸長及草甘膦篩選培養(yǎng)(0.5 mg/L)、生根培養(yǎng)等組織培養(yǎng)階段,最終獲得抗性植株。共得到了37株抗性植株。
2.4轉基因紫花苜蓿的分子生物學檢測
2.4.1PCR檢測與Southern Blot檢測 利用篩選標記基因Bar基因引物對抗性植株進行PCR檢測,部分PCR鑒定結果如圖7所示,轉基因植株擴增出約450 bp片段,與陽性對照一致,篩選得到14株PCR陽性植株,初步證明目的基因已整合到紫花苜蓿基因組中。對14株PCR陽性植株進行Southern Blot鑒定(圖8),結果顯示共獲得3株Southern Blot陽性植株,其中#2為3個拷貝,#12為1個拷貝,#21為2個拷貝(圖8)。證明目的基因已成功整合到紫花苜蓿基因組中。
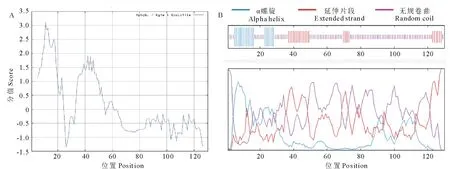
圖4 GsARHP蛋白結構預測Fig.4 Prediction of GsARHP protein structure A:GsARHP蛋白疏水性、親水性分析Hydrophilicity, hydrophobicity analyze of GsARHP;B:GsARHP蛋白二級結構預測 Secondary structure of prediction of GsARHP.
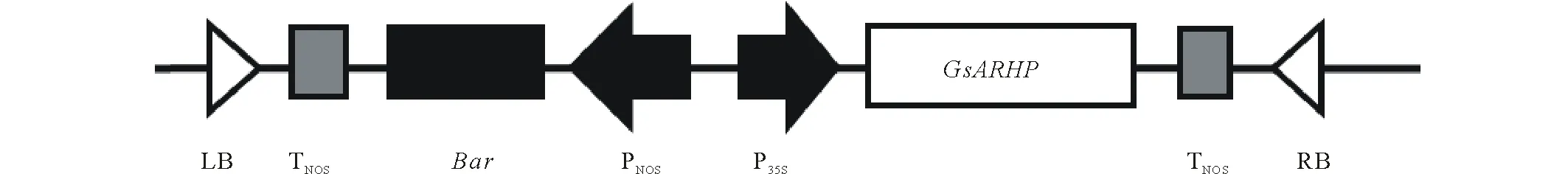
圖5 GsARHP植物超量表達載體的構建Fig.5 Construction of GsARHP plant over expression vector LB:左界 Left border;TNOS:T-DNA復制原點 Ori of T-DNA;Bar:篩選標記基因 Selectable marker gene;PNOS:啟動子復制原點Ori of promoter;P35S:35S強啟動子35S promoter;RB:右邊界 Right border.

圖6 紫花苜蓿遺傳轉化及植株再生Fig.6 Genetic transformation and plant regeneration of alfalfa A:8日齡無菌苗Germination 8 days of aseptic seedling;B:農桿菌侵染子葉節(jié)Infection;C:共培養(yǎng)Co-cultivation;D:不定芽誘導Adventitious bud induction;E:抗性芽伸長Resistant shoot elongation;F:抗性苗生根馴化Root plantlets and domestication.
2.4.2RT-PCR檢測 為確定轉基因植株在轉錄水平的表達情況,對篩選得到的3株Southern Blot陽性植株進行轉錄水平分析。半定量RT-PCR分析結果顯示(圖9),3株Southern Blot陽性植株在轉錄水平均可正常表達。
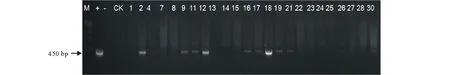
圖7 轉GsARHP基因抗性植株PCR檢測 Fig.7 The PCR identification of resistant plants with GsARHP M:DL 15000;+:陽性對照Positive control;-:水對照Water control;CK:非轉基因對照Control check;1~30:轉GsARHP基因抗性植株PCR擴增產物 PCR amplification products of transgenic plants with GsARHP gene.

圖8 轉基因植株的Southern Blot鑒定Fig.8 Southern Blot identification of the transgenic alfalfa
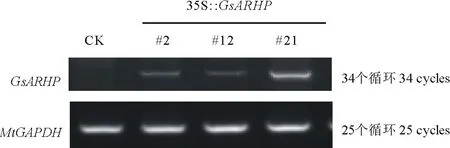
圖9 轉基因植株的半定量RT-PCR鑒定Fig.9 Semi-RT PCR of transgenic resistant plants with GsARHP
2.5轉基因紫花苜蓿堿脅迫生物學分析

圖10 轉GsARHP基因紫花苜蓿堿脅迫表型分析Fig.10 Alkali stress phenotype analysis of GsARHP transgenic alfalfa
2.5.1堿脅迫下轉基因植株的表型分析 堿脅迫會導致植物產生一系列生理響應,抑制其各器官及組織的生長,從而抑制植物的生長發(fā)育,對植物造成傷害。為研究堿脅迫對轉基因紫花苜蓿生長發(fā)育的影響,本研究選取Southern Blot檢測呈陽性的2個轉基因植株#2和#21及未轉基因(CK)紫花苜蓿進行扦插擴繁,獲得扦插苗后,以100和150 mmol/L NaHCO3作為脅迫濃度,模擬堿脅迫條件,對轉基因與未轉基因株系進行耐堿性分析。結果顯示在正常未處理條件下,轉GsARHP基因紫花苜蓿與非轉基因紫花苜蓿的長勢良好,無明顯差異(圖10)。在經(jīng)150 mmol/L NaHCO3處理14 d后,與明顯發(fā)生萎蔫、黃化的非轉基因對照株系相比,轉基因株系#2和#21生長良好且能維持正常的生物學形態(tài)(圖10)。對轉基因與未轉基因株系的生長發(fā)育情況進行分析得知,隨著堿脅迫處理濃度的增加,所有株系的株高與根長均呈現(xiàn)不同程度的下降趨勢;經(jīng)統(tǒng)計,在150 mmol/L NaHCO3處理條件下,2個轉基因株系的株高和根長均顯著高于非轉基因株系(P<0.01)(圖11)。由此可以說明與非轉基因株系相比,轉GsARHP基因紫花苜蓿在堿脅迫下能更好地維持生長發(fā)育,抵御堿脅迫造成的危害。
2.5.2堿脅迫下轉基因植株的生理指標檢測 通過檢測轉基因與對照非轉基因株系的葉綠素含量,如圖12A所示,發(fā)現(xiàn)隨著NaHCO3脅迫處理濃度的增加,轉GsARHP基因紫花苜蓿株系和對照株系的葉綠素含量均呈現(xiàn)出不同程度的降低趨勢,但在相同濃度的NaHCO3脅迫處理條件下,轉基因株系的葉綠素含量高于對照株系,尤其在150 mmol/L NaHCO3脅迫處理條件下,與對照株系相比,轉基因株系#21的葉綠素含量顯著升高(P<0.01)(圖12A),顯然轉GsARHP基因紫花苜蓿株系在堿脅迫條件下能更好維持葉綠體的穩(wěn)定性,從而維持植株正常的生長發(fā)育。
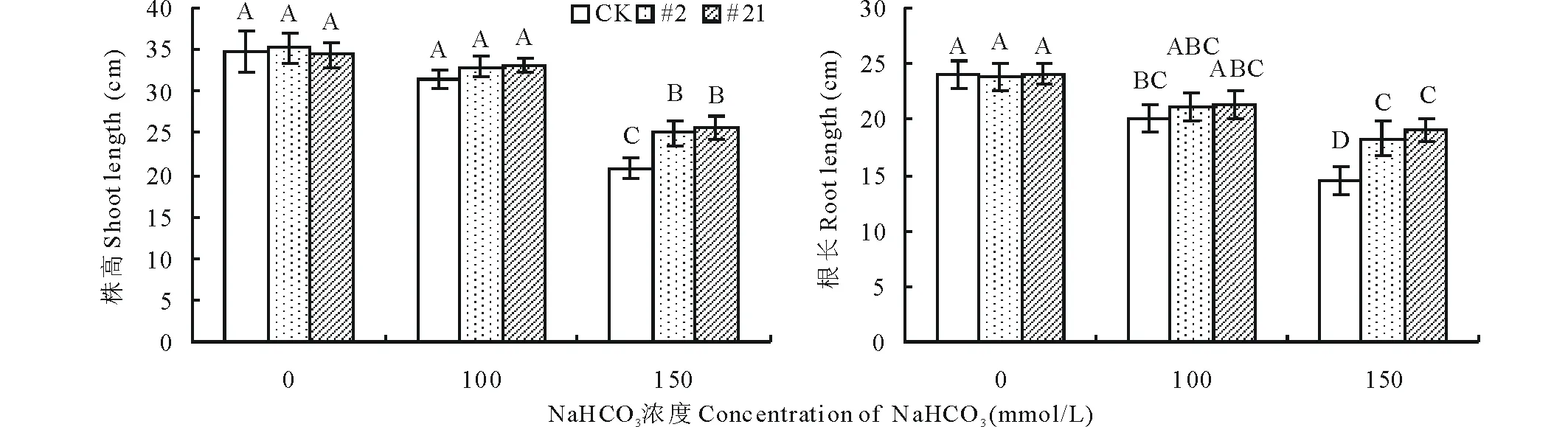
圖11 堿脅迫對紫花苜蓿株高和根長的分析Fig.11 Shoot and root length analysis of transgenic alfalfa with GsARHP under alkali stress 圖柱上方不同大寫字母表示在 P<0.01水平上差異顯著。下同。Bars with different capital letters are significant differences at P<0.01.The same below.
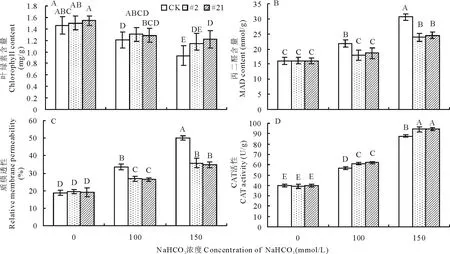
圖12 堿脅迫下轉GsARHP基因紫花苜蓿生理指標檢測Fig.12 Physiological indices analysis of transgenic alfalfa with GsARHP under alkali stress
通過檢測轉基因與未轉基因株系MDA含量(圖12B)發(fā)現(xiàn),隨NaHCO3脅迫處理濃度的增加,2個轉GsARHP基因紫花苜蓿株系的MDA含量略有上升,但由數(shù)據(jù)分析可知,非轉基因株系MDA含量顯著高于轉基因株系(P<0.01),從而說明超量表達GsARHP基因能降低NaHCO3脅迫對細胞膜造成的脂質過氧化傷害,保持細胞膜正常生理功能。
檢測轉基因與對照非轉基因株系的相對質膜透性,由圖12C所示,在NaHCO3脅迫處理下,相對質膜透性在轉GsARHP基因植株和對照植株中均有升高,但2個轉基因株系相對質膜透性的增幅均顯著低于對照株系(P<0.01),說明在NaHCO3脅迫處理條件下,超量表達GsARHP基因可降低堿脅迫對細胞膜的損傷,維持細胞膜完整性從而提升耐堿能力。
CAT活性的測定如圖12D所示,在NaHCO3脅迫處理下,轉基因和非轉基因植株的CAT活性均提高,而在2個轉基因植株中CAT活性顯著高于非轉基因植株(P<0.01),由此可見,GsARHP基因超量表達增強了轉基因植株對自由基清除能力,從而降低了堿脅迫下自由基的積累,減少了自由基對植株核酸、蛋白質以及細胞膜的傷害。
3 討論
鹽堿脅迫嚴重制約著作物的生長發(fā)育,影響其產量及質量,Webb[27]首次由農桿菌介導的紫花苜蓿轉化獲得成功之后,在以后的十多年時間里,紫花苜蓿轉基因取得了很大的進展[28],Winicov等[29]將ALfinl基因轉入苜蓿中提高了鹽誘導基因MsPRP2的表達,提高了轉基因植株的耐鹽性,Liu等[30]將ScNHX1基因和ScVP基因(液泡無機焦磷酸酶)轉入苜蓿,得到了具有很強耐鹽堿性的轉基因苜蓿。Wang等[31]將GsGST14在紫花苜蓿中超量表達,提升了轉基因植株中GST的酶活力,增強了轉基因植株對堿的抗性。盛慧等[32]將抗?jié)B透脅迫信號傳導過程中的關鍵基因DREB2A通過農桿菌介導法對紫花苜蓿進行遺傳轉化,獲得了大量轉基因植株。目前,利用轉基因技術向苜蓿中導入具有優(yōu)良性狀的目的基因來提升轉基因苜蓿的耐鹽堿性狀,已成為改良農業(yè)和畜牧業(yè)生產的重要途徑[33]。本研究選用從野生大豆中篩選出的堿脅迫應答候選基因GsARHP,轉化肇東紫花苜蓿,期望提高轉基因紫花苜蓿的耐堿能力。
野生大豆生長在極其惡劣的生態(tài)環(huán)境中,具有耐鹽堿,抗寒,抗病等優(yōu)良特性,含有豐富的耐逆基因,是我國珍貴的種質資源,本研究從野生大豆堿脅迫轉錄組數(shù)據(jù)中篩選得到一個堿脅迫下上調表達的假定蛋白基因GsARHP,假定蛋白是經(jīng)測序翻譯后得到的功能未知的蛋白,推測可能與野生大豆抗鹽堿的生理活動有關,因此對該蛋白進行了生物信息學分析,發(fā)現(xiàn)該多肽鏈不具備跨膜結構域,但含有信號肽,可能是經(jīng)分泌通路信號肽引導的胞外親水蛋白,為穩(wěn)定蛋白;但是并未發(fā)現(xiàn)該蛋白的功能結構域。為該基因的分子機制研究奠定了重要的理論基礎。進一步在肇東紫花苜蓿中超量表達GsARHP,驗證了該基因在植物堿脅迫應答反應中的功能。在37株再生植株中經(jīng)檢測得到了3株GsARHP基因在轉錄水平超量表達的植株。
在對轉基因植株進行檢測方面,PCR檢測法是現(xiàn)在使用最普遍也是最簡便的實驗檢測方法[34],研究表明,利用常規(guī)PCR法檢測重組載體上標記基因如GUS基因[35],35S啟動子[36]等部分片段,最終證明整合了GUS基因,35S啟動子的轉基因植株中可能不含有目的基因片段[37-38],這可能與外源基因的整合機制相關,如染色體的重組、異位等現(xiàn)象的發(fā)生致使目的基因片段的丟失[39-40],本實驗結果也證實了這一說法;本研究采取Southern Blot方法設計可與目的基因特異性結合的特異性探針,保證了轉基因陽性植株的正確篩選,同時對整合目的基因的陽性植株進行轉錄水平的檢測,確定已整合的目的基因在轉錄水平上成功表達可用于進一步基因功能驗證。
堿脅迫條件下,植物會在細胞內產生并積累大量的活性氧,破壞了植物體內活性氧代謝平衡,從而對核酸、蛋白質等生物大分子產生不利影響;導致光合作用相關元件損傷,影響植物光合作用,從而導致植物失綠甚至死亡;致使膜系統(tǒng)發(fā)生過氧化現(xiàn)象,改變質膜透性,產生丙二醛(MDA),但植物本身存在的活性氧清除保護機制可在一定程度上清除活性氧自由基,維持細胞內活性氧代謝平衡。以上生理指標均可用來指示植物在堿脅迫下受到的損傷情況[41-42]。本研究結果表明GsARHP基因超量表達的紫花苜蓿,在堿脅迫條件下,能夠保持葉綠素含量,維持光合作用積累有機物來保證植株正常的生長發(fā)育;維持細胞膜的選擇透過性等生理活性,減少丙二醛等有害物質的產生,增強了轉基因紫花苜蓿對活性氧自由基的清除能力,保護細胞避免因H2O2累積而產生傷害,從而維持了堿脅迫下轉基因植株的氧化還原平衡。說明GsARHP基因的超量表達可以提高紫花苜蓿的耐堿能力,具體分子機制還需進一步實驗驗證。本研究為深入研究GsARHP基因的功能和培養(yǎng)紫花苜蓿耐鹽堿新品種奠定了基礎。
References:
[1] Qi Z Q, Yu Y X, Hu Y G,etal. Current status and future tasks of theMedicagosativaindustry in China. Acta Prataculturae Sinica, 2008, 17(1): 107-113. 戚志強, 玉永雄, 胡躍高, 等. 當前我國苜蓿產業(yè)發(fā)展的形勢與任務. 草業(yè)學報, 2008, 17(1): 107-113.
[2] Hua Y, Cai H, Bai X,etal. Research progress on plant salt stress tolerance genetic engineering. Journal of Northeast Agricultural University, 2010, 41(10): 150-156. 化燁, 才華, 柏錫, 等. 植物耐鹽基因工程研究進展. 東北農業(yè)大學學報, 2010, 41(10): 150-156.
[3] Peng J Q, Liu Y Q, Yang Y F,etal. Importance and technology progress in containing the soil salinization and desertification. Tianjin Agricultural Sciences, 2008, 14(4): 26-29. 彭津琴, 劉永強, 楊玉芳, 等. 遏制土壤鹽堿化、荒漠化的必要性及技術進展. 天津農業(yè)科學, 2008, 14(4): 26-29.
[4] Tian C X, Zhang Y M, Wang K,etal. The anatomical structure responses in alfalfa to salinity-alkalinity stress of NaHCO3. Acta Prataculturae Sinica, 2014, 23(5): 133-142. 田晨霞, 張詠梅, 王凱, 等. 紫花苜蓿組織解剖結構對NaHCO3鹽堿脅迫的響應. 草業(yè)學報, 2014, 23(5): 133-142.
[5] Hasegawa P M, Bressan R A, Zhu J K,etal. Plant cellular and molecular responses to high salinity. Plant Biology, 2000, 51(51): 463-499.
[6] Yang X Y, Yang J S, Liu G M,etal. Changes in soil fertilities and crop growth after transferring paddy soil to upland soil. Chinese Journal of Soil Science, 2006, 37(4): 675-679. 楊曉英, 楊勁松, 劉廣明, 等. 鹽堿地稻田旱作后土壤肥力變化及其對作物生長的影響. 土壤通報, 2006, 37(4): 675-679.
[7] Li H W, Ma D M, Xu X,etal. Advance and prospects on salt-tolerant transgenic alfalfa. Northern Horticulture, 2012, (19): 184-188. 李會文, 麻冬梅, 許興, 等. 苜蓿耐鹽堿轉基因研究進展與展望. 北方園藝, 2012, (19): 184-188.
[8] Das-Chatterjee A, Goswami L, Maitra S,etal. Introgression of a novel salt-tolerant L-myo-inositol 1-phosphate synthase fromPorteresiacoarctata(Roxb.) Tateoka (PcINO1) confers salt tolerance to evolutionary diverse organisms. FEBS Letters, 2006, 580(16): 3980-3988.
[9] Jing Y X, Yuan Q H. Effects of salt stress on seedling growth of alfalfa (Medicagosativa) and ion distribution in different alfalfa organs. Acta Prataculturae Sinica, 2011, 20(2): 134-139. 景艷霞, 袁慶華. NaCl脅迫對苜蓿幼苗生長及不同器官中鹽離子分布的影響. 草業(yè)學報, 2011, 20(2): 134-139.
[10] Jin T, Chang Q, Li W,etal. Stress-inducible expression of GmDREB1 conferred salt tolerance in transgenic alfalfa. Plant Cell, Tissue and Organ Culture (PCTOC), 2010, 100(2): 219-227.
[11] Liu J, Cai H, Liu Y,etal. A study on physiological characteristics and comparison of salt tolerance of twoMedicagosativaat the seedling stage. Acta Prataculturae Sinica, 2013, 22(2): 250-256. 劉晶, 才華, 劉瑩, 等. 兩種紫花苜蓿苗期耐鹽生理特性的初步研究及其耐鹽性比較. 草業(yè)學報, 2013, 22(2): 250-256.
[12] Zhang L Q, Zhang F Y, Hasi Agula. Research progress on alfalfa salt tolerance. Acta Prataculturae Sinica, 2012, 21(6): 296-305. 張立全, 張鳳英, 哈斯阿古拉. 紫花苜蓿耐鹽性研究進展. 草業(yè)學報, 2012, 21(6): 296-305.
[13] Jiang J, Yang B L, Xia T,etal. Genetic diversity analysis of salt tolerant germplasm resources of alfalfa. Acta Prataculturae Sinica, 2011, 20(5): 119-125. 姜健, 楊寶靈, 夏彤, 等. 紫花苜蓿耐鹽種質資源的遺傳多樣性分析. 草業(yè)學報, 2011, 20(5): 119-125.
[14] Wang J F, Li Y Q, Guo Y Q. Effects of saline alkali soil on saline alkali soil. Shangdong Journal of Animal Science and Veterinary Medicine, 1999, (5): 20-21. 王金芬, 李玉芹, 郭玉泉. 耐鹽堿牧草改良鹽堿土的效果. 山東畜牧獸醫(yī), 1999, (5): 20-21.
[15] Wang X P, Li W Q. A report on the quality inspection and analysis of several different alfalfa varieties. Contemporary Animal Husbandry, 2004, (5): 39. 王學鵬, 李文全. 幾個不同品種紫花苜蓿質量檢驗分析報告. 當代畜牧, 2004, (5): 39.
[16] Tian F P, Wang S M, Guo Z G,etal. Relationship between proline content and water content, single plant dry matter, and drought resistance of alfalfa. Pratacultural Science, 2004, 21(1): 3-6. 田福平, 王鎖民, 郭正剛, 等. 苜蓿脯氨酸含量和含水量、單株干質量與抗旱性的相關性研究. 草業(yè)科學, 2004, 21(1): 3-6.
[17] Zhang H N, Li X J, Li C D,etal. Effects of overexpression of wheat superoxide dismutase (SOD) genes on salt tolerant capability in Tobacco. Acta Agronomica Sinica, 2008, 34(8): 1403-1408. 張海娜, 李小娟, 李存東, 等. 過量表達小麥超氧化物歧化酶(SOD)基因對煙草耐鹽能力的影響. 作物學報, 2008, 34(8):1403-1408.
[18] Duanmu H, Wang Y, Bai X,etal. Wild soybean roots depend on specific transcription factors and oxidation reduction related genes in response to alkaline stress. Functional & Integrative Genomics, 2015, 15(6): 651-660.
[19] Wu P, Liu T, Qin G X,etal. Full-length cDNA cloning and characterization of a hypothetic protein gene responsive to the infection of bombyxmoricytoplasmic polyhedrosis virus. Science of Sericulture, 2010, 36(6): 937-943. 吳萍, 劉挺, 覃光星, 等. 家蠶質型多角體病毒感染應答的假定蛋白基因全長cDNA克隆與表達特征分析. 蠶業(yè)科學, 2010, 36(6): 937-943.
[20] Bitinaite J. USERTMfriendly DNA engineering and cloning method by uracil excision. Nucleic Acids Research, 2007, 35(6): 1992-2002.
[21] Geuflores F, Noureldin H H, Nielsen M T,etal. USER fusion: a rapid and efficient method for simultaneous fusion and cloning of multiple PCR products. Nucleic Acids Research, 2007, 35(7): e55.
[22] Jones H D, Wilkinson M, Doherty A,etal. High throughputAgrobacteriumtransformation of wheat: a tool for functional genomics[C]//Wheat Production in Stressed Environments. Proceedings of the 7th International Wheat Conference, 2007: 693-699.
[23] Cortazar B, Koydemir H C, Tseng D,etal. Field quantification of plant chlorophyll content using Google Glass[C]//SPIE BiOS. International Society for Optics and Photonics, 2015.
[24] Liu T Z, Zhao X P. Study of apricot leaves plasma membrane permeability by electric conductivity method. Journal of Hebei Agricultural Sciences, 2008, 12(1): 33-34. 劉鐵錚, 趙習平. 電導法測定杏葉片細胞質膜相對透性的研究. 河北農業(yè)科學, 2008, 12(1): 33-34.
[25] Zhang T X, Lin Z J, Cao M H,etal. Study on determination of pepper leaf cell membrane permeability of the electrical conductivity method. Fujian Science & Technology of Tropical Crops, 2013, (1): 19-21. 張?zhí)煜? 林宗鏗, 曹明華, 等. 電導率法測定甜椒葉片細胞質膜相對透性的研究. 福建熱作科技, 2013, (1): 19-21.
[26] Alt D. The cat-method for the chemical analysis of horticultural substrates (refereed). Acta Horticulturae, 1997, 450(450): 87-96.
[27] Webb B L. Response of seedling alfalfa (Medicagosativa) to four postemergence herbicides. Weed Technology, 1991, 5(4): 736-738.
[28] Zhang Y, Liu J, Zhou Y,etal. Enhanced phytoremediation of mixed heavy metal (mercury)-organic pollutants (trichloroethylene) with transgenic alfalfa co-expressing glutathione S-transferase and human. Journal of Hazardous Materials, 2013, 260(6): 1100-1107.
[29] Winicov I, Bastola D R. Transgenic overexpression of the transcription factor alfin1 enhances expression of the endogenousMsPRP2 gene in alfalfa and improves salinity tolerance of the plants. Plant Physiology, 1999, 120(2): 473-480.
[30] Liu L, Fan X D, Wang F W,etal. Coexpression ofScNHX1 andScVPin transgenic hybrids improves salt and saline-alkali tolerance in alfalfa (MedicagosativaL.). Journal of Plant Growth Regulation, 2013, 32(1): 1-8.
[31] Wang Z Y, Song F B, Cai H,etal. Over-expressing GsGST14 fromGlycinesojaenhances alkaline tolerance of transgenicMedicagosativa. Biologia Plantarum, 2012, 56(3): 1-5.
[32] Sheng H, Zhu Y M, Li J,etal. Genetic transformation ofDREB2Agene into alfalfa. Pratacultural Science, 2007, 24(3): 40-45. 盛慧, 朱延明, 李杰, 等.DREB2A基因對紫花苜蓿遺傳轉化的研究. 草業(yè)科學, 2007, 24(3): 40-45.
[33] Yang Z, Zhu Y M, Bai X,etal. Over-expressing GsCBRLK/SCMRP enhances alkaline tolerance and methionine content in transgenicMedicagosativa. Acta Agronomica Sinica, 2014, 40(3): 431.
[34] Yue Y F, Wu G, Wu Y H,etal. Development of qualitative PCR method targeting marker genes in transgenic plants. Chinese Journal of Oil Crop Sciences, 2011, 33(3): 280-289. 岳運鋒, 吳剛, 武玉花, 等. 轉基因植物中標記基因定性PCR檢測方法研究. 中國油料作物學報, 2011, 33(3): 280-289.
[35] Wang M, Zhang Q, Liu F C,etal. Family-wide expression characterization ofArabidopsisbeta-carbonic anhydrase genes using qRT-PCR and Promoter::GUS fusions. Biochimie, 2014, 97(1): 219-227.
[36] Shang Z M, Gao H W, Wang X L,etal. Extraction of bean DNA and detection of transgenic CaMV35S by PCR method. Journal of Heze University, 2006, 28(2): 73-75. 尚智美, 高宏偉, 王學亮, 等. 大豆樣品中DNA的提取與外源基因CaMV35S的PCR檢測. 菏澤學院學報, 2006, 28(2): 73-75.
[37] García-Pérez R D, Houdt H V, Depicker A. Spreading of post-transcriptional gene silencing along the target gene promotes systemic silencing. Plant Journal, 2004, 38(4): 594-602.
[38] Wang H H, Wu S J, Li F F,etal. Transgene silencing caused by 35S promoter methylation in upland cotton (Gossypiumhirsutum). Cotton Science, 2008, 20(4): 274-280. 王海海, 吳慎杰, 李飛飛, 等. 35S啟動子甲基化引起棉花轉基因沉默. 棉花學報, 2008, 20(4): 274-280.
[39] Peng H Y, Li-Jie Y U. Integration pattern and character of exogenous genes in transgenic plants. Heilongjiang Agricultural Sciences, 2011, 95(2): 509-513.
[40] Atsuo K, Yu H, Satoshi O,etal. Site-specific integration of exogenous genes using genome editing technologies in zebrafish. International Journal of Molecular Sciences, 2016, 17(5): 727.
[41] Tang L, Cai H, Ji W,etal. Overexpression of GsZFP1 enhances salt and drought tolerance in transgenic alfalfa (MedicagosativaL.). Plant Physiology & Biochemistry, 2013, 71(71C): 22-30.
[42] Sun M, Sun X, Zhao Y,etal. Ectopic expression of GsPPCK3 and SCMRP inMedicagosativaenhances plant alkaline stress tolerance and methionine content. Plos One, 2013, 9(2): e89578.
IsolationofGsARHPfromGlycinesojaanditsfunctionalanalysisintransgenicalfalfaunderalkalinestress
CHEN Ran-Ran**, ZHU Ping-Hui**, JIA Bo-Wei, SONG Xue-Wei, WANG Zi-Jun, LI Ji-Na, LI Qiang, DING Xiao-Dong, ZHU Yan-Ming*
KeyLaboratoryofAgriculturalBiologicalFunctionalGenes,NortheastAgriculturalUniversity,Harbin150030,China
GsARHP, which encodes hypothetical protein up-regulated by alkaline stress, was identified from RNA-seq data of wild soybean (Glycinesoja) at the early stage of the salt stress response. Real-time PCR analyses showed thatGsARHPwas induced by alkali stress. A bioinformatics analysis showed that the gene encodes a hydrophilic protein consisting of 130 amino acids, with a signal peptide but no transmembrane domain. A plant overexpression vector was constructed and transformed into alfalfa byAgrobacteriumtumefaciens-mediated cotyledonary node infection. Three transgenic lines were identified by PCR, Southern blotting, and RT-PCR analyses. The non-transgenic lines became wilted and yellow or even died under 0, 100, and 150 mmol/L NaHCO3treatment for 14 days, while the transgenic lines grew well under the same conditions. Further analyses showed that the transgenic lines had significantly lower relative plasma membrane permeability and malondialdehyde (MDA) content than did non-transgenic lines (P<0.01), and significantly higher chlorophyll content and CAT activity (P<0.01). These results indicated that overexpression ofGsARHPcould enhance the alkali resistance of alfalfa.
Glycinesoja;GsARHPgene; alkali stress; alfalfa; genetic transformation
10.11686/cyxb2016464
http://cyxb.lzu.edu.cn
陳冉冉, 朱娉慧, 賈博為, 宋雪薇, 王子君, 李佶娜, 李強, 丁曉東, 朱延明. 堿脅迫應答基因GsARHP的克隆及轉基因紫花苜蓿的耐堿性分析. 草業(yè)學報, 2017, 26(9): 92-103.
CHEN Ran-Ran, ZHU Ping-Hui, JIA Bo-Wei, SONG Xue-Wei, WANG Zi-Jun, LI Ji-Na, LI Qiang, DING Xiao-Dong, ZHU Yan-Ming. Isolation ofGsARHPfromGlycinesojaand its functional analysis in transgenic alfalfa under alkaline stress. Acta Prataculturae Sinica, 2017, 26(9): 92-103.
2016-12-08;改回日期:2017-02-11
國家自然科學
基金項目(31171578),黑龍江省高校科技創(chuàng)新團隊建設計劃項目(2011TD005)和東北農業(yè)大學學科團隊建設項目—團隊1資助。
陳冉冉(1991-),女,河北邯鄲人,在讀碩士。E-mail:crr0620@126.com。朱娉慧(1990-),女,黑龍江齊齊哈爾人,在讀碩士。E-mail:zhupinghui@outlook.com。**共同第一作者These authors contributed equally to this work.*通信作者Corresponding author. E-mail: ymzhu2001@neau.edu.cn

