絲氨酸吸收系統多基因敲除對大腸桿菌產L-絲氨酸的影響
,,,,, ,*
(1.石河子大學生命科學學院,新疆石河子 832000;2.中國科學院上海高等研究院,上海 201210)
絲氨酸吸收系統多基因敲除對大腸桿菌產L-絲氨酸的影響
石斌超1,2,崔云風1,王晨陽2,趙志軍2,史吉平2,張霞1,*
(1.石河子大學生命科學學院,新疆石河子 832000;2.中國科學院上海高等研究院,上海 201210)
sstT、cycA、sdaC和tdcC是大腸桿菌L-絲氨酸的四個吸收基因,本文在前期吸收基因單基因敲除菌的基礎上,系統研究了四個吸收基因不同組合敲除對菌株生長及L-絲氨酸生產的影響。搖瓶發酵結果表明,在11個多基因敲除突變菌中,sstT·sdaC雙基因敲除菌,sstT·sdaC·tdcC和sstT·cycA·sdaC三基因敲除菌的L-絲氨酸產量與對照相比有明顯提升,分別達到271.11、312.58和322.57 mg/L;sstT·cycA·sdaC·tdcC四基因敲除菌的L-絲氨酸產量最高,達到了450.58 mg/L,是對照菌的6倍。在菌株生長方面,雙基因敲除菌和三基因敲除菌的生長量優于對照菌或者與對照菌相近,而四基因敲除菌的生長量與對照菌相比則下降了28%。
L-絲氨酸,吸收基因,菌株生長,產絲氨酸能力
L-絲氨酸是一種重要的非必需氨基酸,參與了多個關鍵的生物代謝進程,尤其是在細胞增殖、生長過程中發揮著重要的作用[1],此外,絲氨酸以其獨特的生物學特性,在醫藥、食品、化妝品等領域得到了廣泛應用。目前,L-絲氨酸的工業生產方法主要有蛋白水解法[2]、化學合成法[3]和酶轉化法[4]等,而微生物直接發酵法具有環境友好、生產成本低、生產效率高等優點,其菌株育種研究受到研究者的廣泛關注。谷氨酸棒桿菌和大腸桿菌是L-絲氨酸主要生產菌株。其中谷氨酸棒桿菌產量最高可達42.62 g/L[5]。而大腸桿菌產L-絲氨酸的研究起步較晚,工程改造主要集中在L-絲氨酸合成途徑及降解途徑。Mundhada等人在大腸桿菌MG1655基礎上敲除三個L-絲氨酸脫氨酶編碼基因sdaA、sdaB、tdcG以及絲氨酸羥甲基轉移酶編碼基因glyA,并過表達L-絲氨酸合成基因serAmut(突變serA,解除反饋抑制)、serB、serC,使L-絲氨酸產量達到8.3 g/L,在提高菌株對L-絲氨酸耐受性后,產量可達11.7 g/L[6]。本實驗室前期在W3110基礎上敲除基因sdaA并突變基因glyA得到菌株SWCH-05,在此基礎上敲除L-絲氨酸吸收基因sdaC并過表達基因serAfbr(抗反饋抑制突體)、serB、serC和pgk后進行流加補料發酵,L-絲氨酸產量達到16.3 g/L[7]。
氨基酸轉運系統,分為吸收系統和分泌系統兩部分,對微生物生理代謝具有重要的調控作用[7-9]。氨基酸轉運系統工程可以通過加速氨基酸的分泌或者減弱氨基酸的吸收從而達到高效積累目標氨基酸的目的。目前氨基酸轉運系統改造已在多種氨基酸[10-13]的育種研究中取得成功。文獻報道sstT、cycA、sdaC和tdcC是大腸桿菌中四個參與了L-絲氨酸吸收調控的基因。轉運蛋白SstT是一種Na+偶聯的L-絲氨酸和蘇氨酸協同轉運載體[14-15]。轉運蛋白CycA最初發現是丙氨酸的主要轉運子,但隨后發現其也參與細胞對絲氨酸和甘氨酸的吸收[16-18]。轉運蛋白SdaC和TdcC同屬H+協同轉運子家族:其中,SdaC是一種具有高度特異性的L-絲氨酸轉運子,TdcC則也是一種蘇氨酸-絲氨酸協同轉運子[19-22]。
實驗室前期構建了L-絲氨酸四個吸收基因sstT、cycA、sdaC和tdcC的單基因敲除菌,本研究在此基礎上,進一步利用Red重組系統構建了四個L-絲氨酸吸收基因的組合突變菌,共計11個多基因敲除菌;將實驗室前期構建的質粒pSC-05導入至敲除菌中,考察L-絲氨酸吸收基因不同組合敲除情況下,菌株的生長及發酵產L-絲氨酸的情況。
1 材料與方法
1.1材料與儀器
E.coliSWCH-05、E.coliW3110的sdaA敲除和glyA突變衍生菌 實驗室保藏;菌株E.coliSWCH-51、E.coliSWCH-52、E.coliSWCH-53和E.coliSWCH-54 實驗室前期以E.coliSWCH-05為出發菌株構建的sstT、cycA、sdaC和tdcC四個基因的單基因敲除菌;E.colipSC-05 實驗室前期構建的攜帶絲氨酸合成關鍵基因serAfbr(抗反饋抑制突體)、serB、serC以及pgk的低拷貝質粒,以上菌株和質粒的具體特性見表1;蛋白胨、酵母粉及瓊脂粉 購自Thermo Scientific;Primer STAR HS DNA Polymerase、Taq DNA Polymerase(Mix) 購自寶生物工程(大連)有限公司;DNA ladder Mix 購自Fementas;Kan抗生素 購自上海捷倍思基因技術有限公司;細菌基因組DNA小量制備試劑盒、質粒DNA小量制備試劑盒和清潔試劑盒 購自AxyPrep;工具質粒pKD13、pKD46和pCP20 購自美國耶魯大學大腸桿菌菌株庫(E.coliGenetic Stock Center,New Haven,USA);L-絲氨酸標準樣品,L-甘氨酸標準樣品及異硫氰酸苯酯(PITC) 購自Sigma;其他化學試劑 購自上海國藥;常規試劑 采用分析純;液相用乙酸鈉 采用優級純;甲醇及乙腈 采用色譜純;LB培養基(1 L) 酵母粉5 g,蛋白胨10 g,NaCl 10 g;搖瓶培養基(1 L) 低聚麥芽糊精8 g,酵母粉4 g,蛋白胨2 g,尿素2 g,K2HPO415.07 g,(NH4)SO43 g,KH2PO41.82 g,MgSO4·7H2O 1.5 g,Na-Citrate·2H2O 0.6 g,NaCl 0.5 g,FeSO4·7H2O 0.035 g,CaCl2·2H2O 0.0085 g,1000×微量元素液0.75 mL;1000×微量元素液(1 L) H3BO325 g,MnCl2·4H2O 16 g,CoCl2·6H2O 7 g,ZnSO4·7H2O 3 g,CuSO4·5H2O 2.5 g,Na2MoO4·2H2O 1.5 g。
核酸電泳儀、凝膠成像系統、PCR儀以及電轉儀 美國BIO-RAD公司;紫外分光光度計 德國Beckman公司;冷凍離心機和移液槍 德國Eppendorf公司;高效液相色譜儀 日本島津公司。
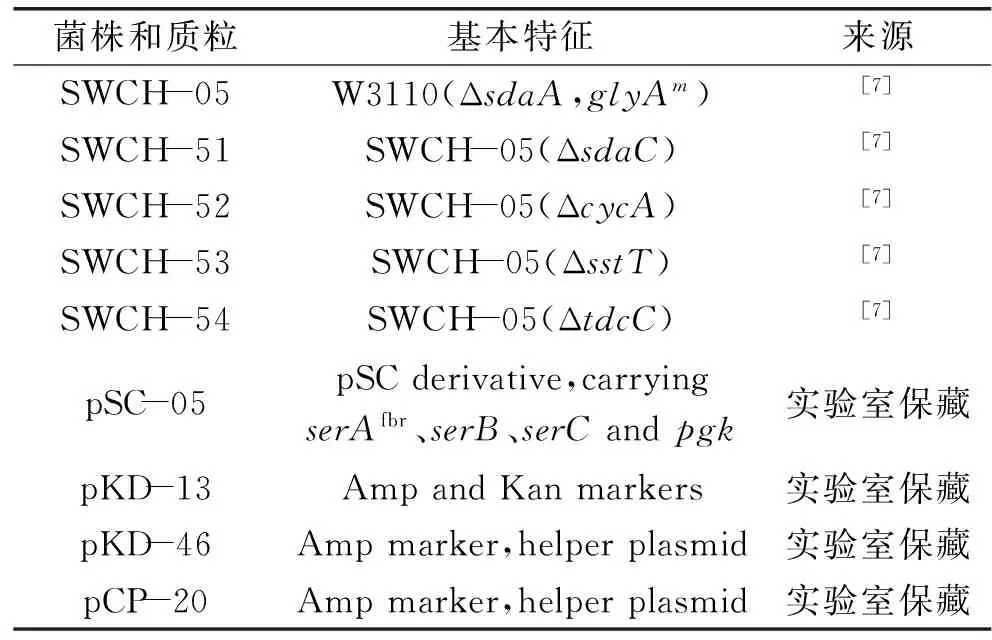
表1 實驗菌株和質粒Table 1 Strains and plasmid in the experiment
1.2實驗方法
1.2.1 引物設計 根據大腸桿菌W3110基因組序列設計四對敲除引物:sstT-p1 & p2,cycA-p1 & p2,sdaC-p1 & p2和tdcC-p1 & p2以及四對驗證引物:sstT-v1 & v2,cycA-v1 & v2,sdaC-v1 & v2和tdcC-v1 & v2,K1 & K2為Kan基因內部序列,具體操作方法參照文獻[7];引物合成由英濰捷基(上海)貿易有限公司合成;測序工作由蘇州金唯智完成。
1.2.2 敲除菌的構建 本研究采用Red重組系統在sstT、cycA、sdaC和tdcC四個單基因敲除菌基礎上進一步構建了11株組合敲除突變菌。具體操作方法參照文獻[12]。
1.2.3 搖瓶發酵條件 從平板挑取敲除菌的單菌落接種至50 mL含有Kan抗生素的LB培養基中,35 ℃,200 r/min,培養12 h;按8%接種量(v/v)取4 mL LB培養液轉接至50 mL含有Kan抗生素的搖瓶培養基中,35 ℃,200 r/min,預培養6 h;預培養結束后,將培養條件調整至38 ℃,200 r/min;搖瓶發酵實驗開始后,每6 h取樣一次,測定OD值及pH。
1.2.4 檢測方法
1.2.4.1 菌體密度測定 采用紫外分光光度計檢測,用600 nm處的吸光度OD600表示。
1.2.4.2 L-絲氨酸產量測定 采用高效液相色譜(HPLC)檢測,樣品預處理采用異硫氰酸苯酯柱前衍生法,具體方法參照文獻[23]。

表2 實驗引物Table 2 Primers used in the experiment
注:下劃線表示用于同源重組的同源臂。
高效液相色譜分析條件:色譜柱為Agilent Extend C18(250 nm×4.6 nm,5 μm)。流動相為A 0.05 mol/L乙酸鈉(pH:6.50±0.5)和B甲醇∶乙腈∶水(20∶60∶20)。流速為0.8 mL/min。進樣體積10 μL,柱溫箱溫度為45 ℃。
L-絲氨酸標準曲線的繪制:準確稱取L-絲氨酸標品5.25 g溶于1 L容量瓶中,加蒸餾水定容,得到濃度為0.05 mol/L的L-絲氨酸標準母液。利用該母液加蒸餾水稀釋,得到濃度分別為0.001、0.002、0.004、0.008、0.02、0.03和0.04 mol/L的L-絲氨酸標準溶液。采用異硫氰酸苯酯柱前衍生法處理后進行HPLC檢測,以標準溶液濃度為橫坐標,峰面積為縱坐標,繪制標準曲線。最終標準曲線為y=2128648382.27x-14834.45,R2=0.99。
1.3數據處理
實驗中每個處理重復三次,采用SPSS 17.0軟件進行數據的顯著性分析,應用Origin 7.0軟件作圖。
2 結果與分析
2.1雙基因敲除菌的構建
sstT·cycA雙基因敲除菌SWCH-61和sstT·sdaC雙基因敲除菌SWCH-62是在sstT單基因敲除菌SWCH-53的基礎上分別敲除基因cycA和sdaC得到的,sstT·tdcC雙基因敲除菌SWCH-63和cycA·tdcC雙基因敲除菌SWCH-65是在tdcC單基因敲除菌SWCH-54的基礎上分別敲除基因sstT和cycA得到的,cycA·sdaC雙基因敲除菌SWCH-64和sdaC·tdcC雙基因敲除菌SWCH-66則是在sdaC單基因敲除菌SWCH-51的基礎上分別敲除基因cycA和tdcC得到,構建流程如圖1所示,DNA瓊脂糖凝膠電泳驗證圖譜如圖2所示。測序驗證正確后,則成功構建了sstT·cycA雙基因敲除菌SWCH-61、sstT·sdaC雙基因敲除菌SWCH-62、sstT·tdcC雙基因敲除菌SWCH-63、cycA·sdaC雙基因敲除菌SWCH-64、cycA·tdcC雙基因敲除菌SWCH-65和sdaC·tdcC雙基因敲除菌SWCH-66,菌株特征如表3所示。
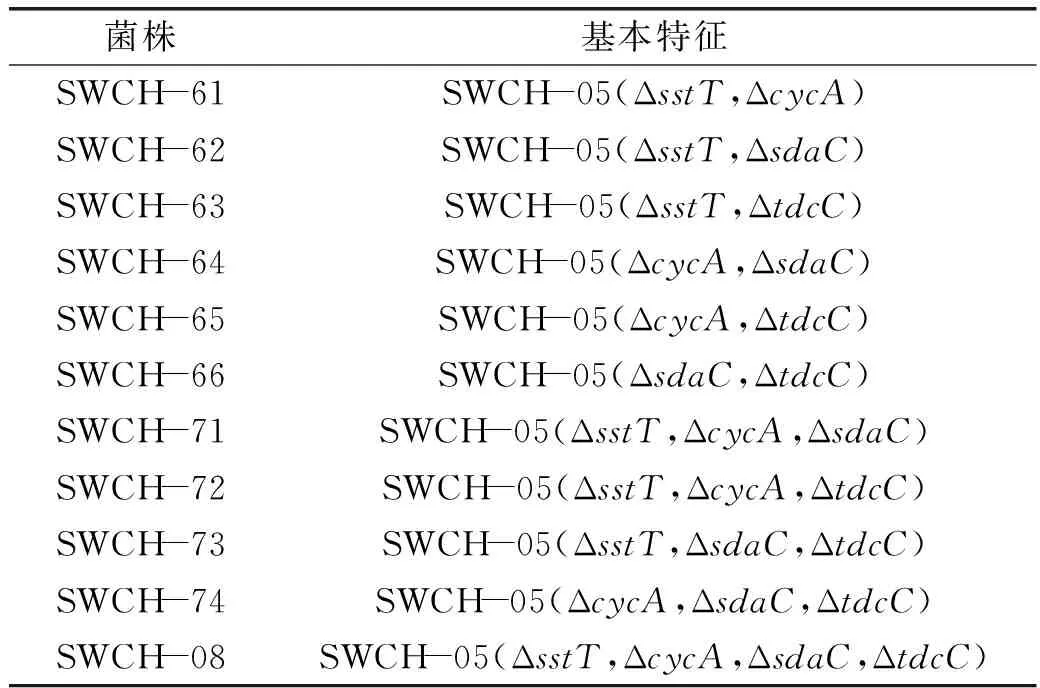
表3 實驗構建菌株Table 3 Strains constructed in the experiment
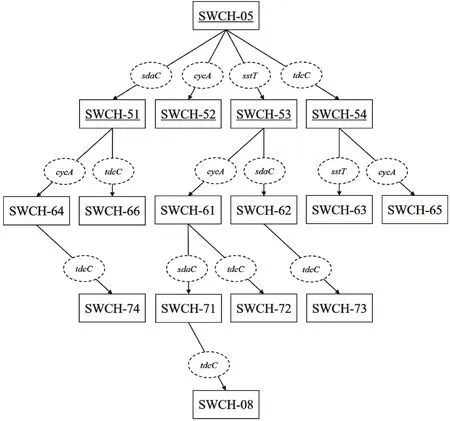
圖1 多基因敲除菌的構建流程Fig.1 Construction process of multi-gene deletion mutants注:實線矩形代表實驗菌株,其中帶有下劃線的菌株為實驗室前期構建所得,未帶有下劃線的菌株為本實驗構建所得;虛線橢圓代表被敲除的L-絲氨酸吸收基因。
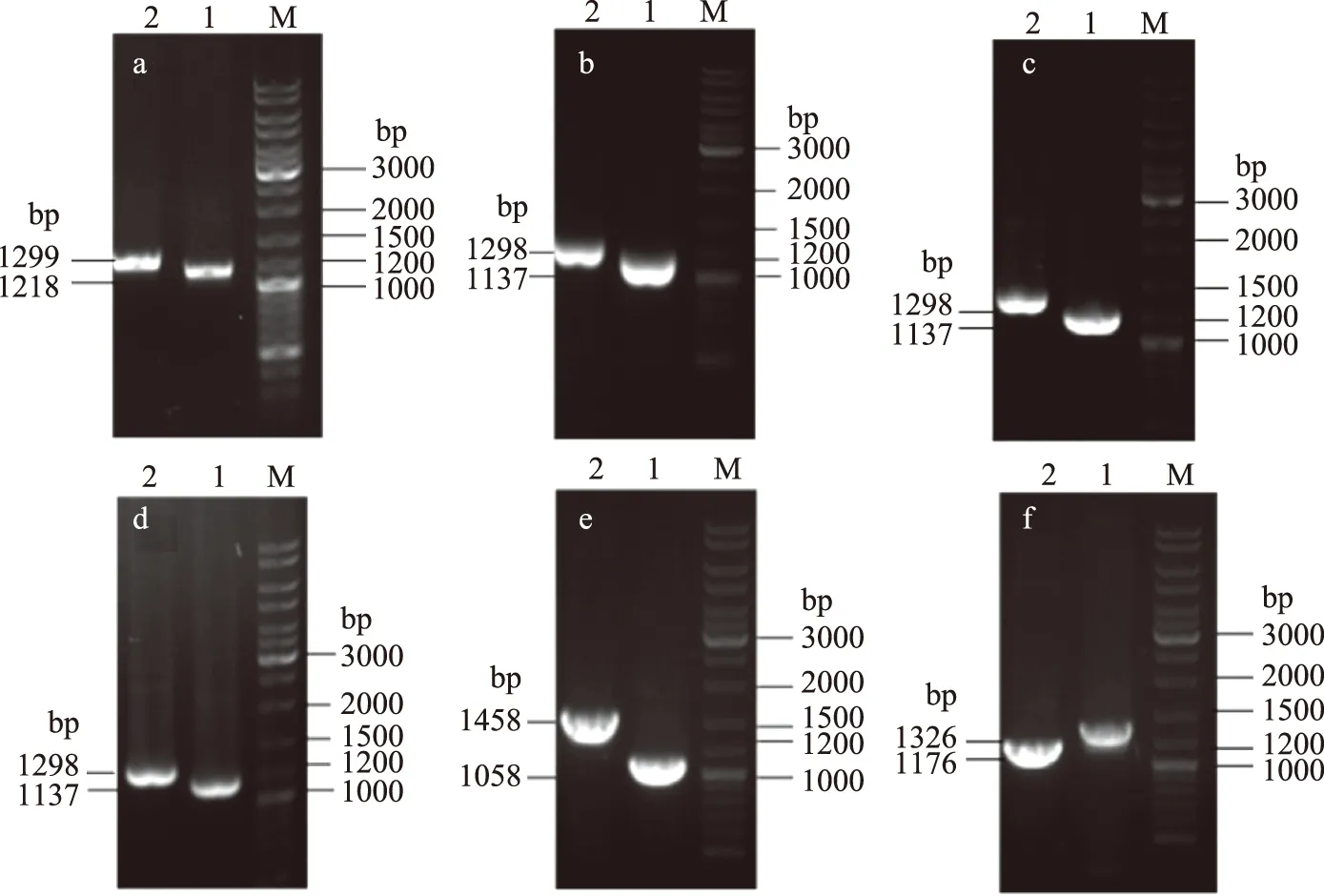
圖2 吸收基因sstT、cycA、sdaC和tdcC同源重組的PCR驗證Fig.2 PCR test of homologous recombination about uptake genes sstT,cycA,sdaC and tdcC注:a為SWCH-62,其中1:sdaC-v1 & K1,2:sdaC-v2 & K2;b為SWCH-64,其中1:cycA-v1 & K1,2:cycA-v2 & K2;c為 SWCH-61,其中1:cycA-v1 & K1,2:cycA-v2 & K2;d為SWCH-65,其中1:cycA-v1 & K1,2:cycA-v2 & K2;e為SWCH-63,其中1:sstT-v1 & K1,2:sstT-v2 & K2;f為SWCH-66,其中1:tdcC-v1 & K2,2:tdcC-v2 & K1。
2.2三基因及四基因敲除菌的構建
sstT·cycA·sdaC三基因敲除菌SWCH-71是在sstT·cycA雙基因敲除菌SWCH-61基礎上敲除吸收基因sdaC獲得;sstT·cycA·tdcC三基因敲除菌SWCH-72、sstT·sdaC·tdcC三基因敲除菌SWCH-73和cycA·sdaC·tdcC三基因敲除菌SWCH-74是分別在sstT·cycA雙基因敲除菌SWCH-61、sstT·sdaC雙基因敲除菌SWCH-62和cycA·sdaC雙基因敲除菌SWCH-64基礎上敲除吸收基因tdcC獲得;sstT·cycA·sdaC·tdcC四基因敲除菌則是在sstT·cycA·sdaC三基因敲除菌SWCH-71基礎上敲除吸收基因tdcC得到,構建流程如圖1所示,DNA瓊脂糖凝膠電泳驗證圖譜如圖3所示。測序驗證正確后,就分別成功構成了sstT·cycA·sdaC三基因敲除菌SWCH-71、sstT·cycA·tdcC三基因敲除菌SWCH-72、sstT·sdaC·tdcC三基因敲除菌SWCH-73、cycA·sdaC·tdcC三基因敲除菌SWCH-74及sstT·cycA·sdaC·tdcC四基因敲除菌SWCH-08,菌株特征如表3所示。
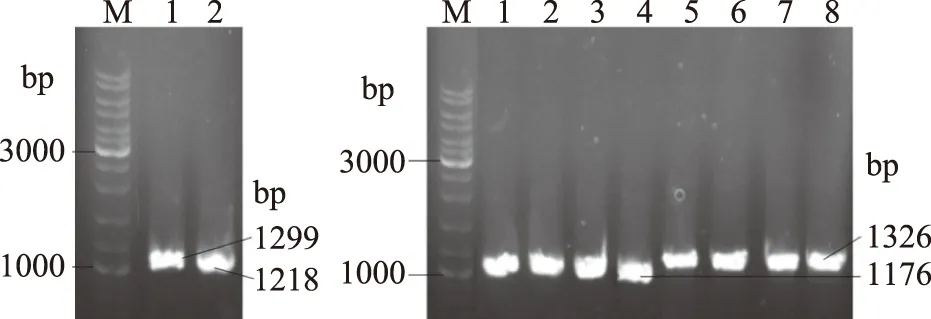
圖3 吸收基因sdaC和tdcC同源重組的PCR驗證Fig.3 PCR test of homologous recombination about uptake genes sdaC and tdcC注:A為SWCH-71,其中1:sdaC-v2 & K2,2:sdaC-v1 & K1;B為SWCH-72(1和5),SWCH-73(2和6)、SWCH-74(3和7)和SWCH-08(4和8),1、2、3、4:tdcC-v2 & K1,5、6、7、8:tdcC-v1 & K2。
2.3雙基因敲除菌的搖瓶發酵
實驗室前期以SWCH-05為出發菌株構建了L-絲氨酸吸收基因sstT、cycA、sdaC和tdcC的單基因敲除菌,研究發現sdaC基因敲除菌在發酵罐分批補料實驗中L-絲氨酸產量最高,達到16.3 g/L[7];與發酵罐發酵結果類似,在單基因敲除菌的搖瓶發酵實驗中,sdaC單基因敲除菌的L-絲氨酸產量為105.07 mg/L,同樣是四個單基因敲除菌中L-絲氨酸產量最高的。
在單基因敲除菌基礎上進一步構建雙基因敲除菌,并將質粒pSC-05導入到雙基因敲除菌中。在雙基因敲除菌搖瓶發酵實驗中發現:sstT·sdaC雙基因敲除菌株SWCH-62/pSC-05的L-絲氨酸產量達到271.11 mg/L,是對照菌SWCH-05/pSC-05(74.98 mg/L)的3.6倍,而其他5株雙基因敲除菌的L-絲氨酸產量很低,僅為10 mg/L左右。菌株SWCH-62的現象說明基因sstT和sdaC的敲除組合在菌株L-絲氨酸產量提升方面作用明顯;但同樣作為敲除基因sdaC的菌株SWCH-64/pSC-05和SWCH-66/pSC-05其產量卻僅為6.64和7.68 mg/L,說明基因sdaC的L-絲氨酸吸收作用受其它三個吸收基因的影響不同(如圖4)。在菌株生長方面,除sstT·sdaC雙基因敲除菌SWCH-62/pSC-05(OD600=5.73)的生長與對照菌(OD600=6.28)相近外,其他雙基因敲除菌的生長都明顯優于對照菌(如圖5)。
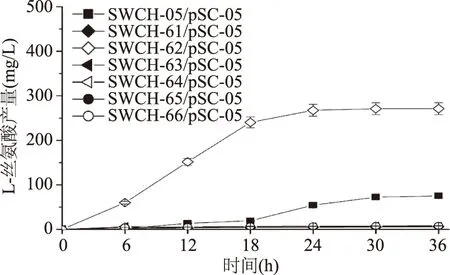
圖4 L-絲氨酸雙基因敲除菌產L-絲氨酸情況Fig.4 The L-serine yield of double-gene deletion mutants
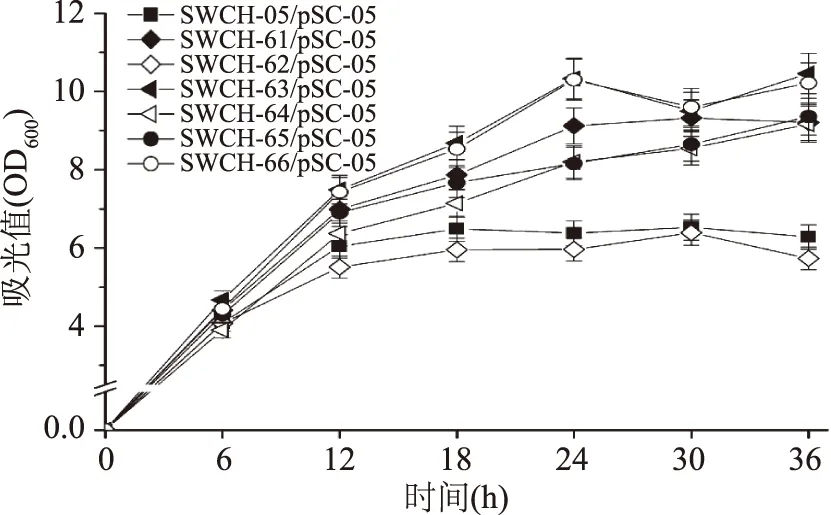
圖5 L-絲氨酸雙基因敲除菌生長情況Fig.5 The cell growth of double-gene deletion mutants
2.4三基因敲除菌的搖瓶發酵
在三基因敲除菌中導入表達質粒pSC-05后,進行搖瓶發酵實驗。從三基因敲除菌產L-絲氨酸的情況可以發現:sstT·cycA·sdaC三基因敲除菌SWCH-71/pSC-05和sstT·sdaC·tdcC三基因敲除菌SWCH-73/pSC-05的L-絲氨酸產量分別達到322.57 mg/L和312.58 mg/L,是對照菌SWCH-05/pSC-05的4.3和4.2倍,而其他2株三基因敲除菌的L-絲氨酸產量均不超過5 mg/L。這種現象說明基因sstT和sdaC的敲除組合確實有利于菌株L-絲氨酸產量提高(如圖6)。從菌株生長方面看,三基因敲除菌的生長狀態普遍與對照菌相似,但菌體OD總體略低(如圖7)。
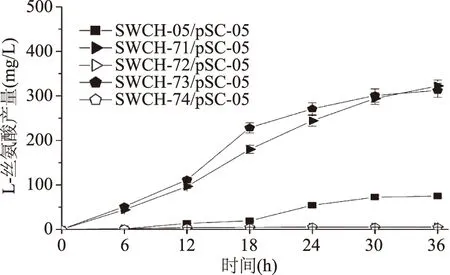
圖6 L-絲氨酸三基因敲除菌產L-絲氨酸情況Fig.6 The L-serine yield of triple-gene deletion mutants
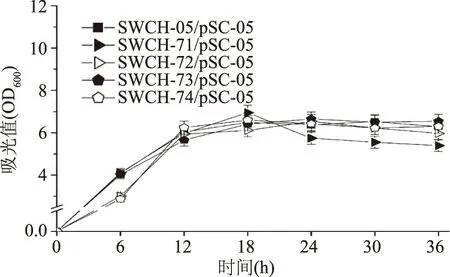
圖7 L-絲氨酸三基因敲除菌生長情況Fig.7 The cell growth of triple-gene deletion mutants
2.5四基因敲除菌的搖瓶發酵
sstT·cycA·sdaC·tdcC四基因敲除菌SWCH-08/pSC-05的L-絲氨酸產量是所有敲除菌中最高的,達到450.58 mg/L,是對照菌SWCH-05/pSC-05(74.98 mg/L)的6倍(如圖8);但其菌株生長同樣是所有敲除菌中最低的,OD600僅為4.52,與對照菌(OD600=6.28)相比,下降28%(如圖9)。四基因敲除菌L-絲氨酸產量的大幅提升說明當所有L-絲氨酸吸收基因被全部敲除后,對菌株產L-絲氨酸的促進作用明顯,但同時也會對菌株生長產生不利影響。
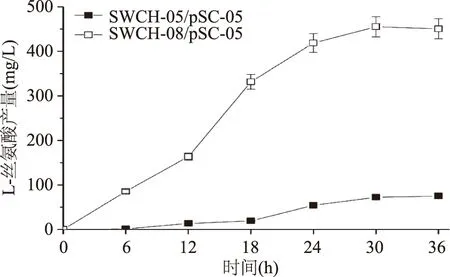
圖8 L-絲氨酸四基因敲除菌產L-絲氨酸情況Fig.8 The L-serine yield of quadruple-gene deletion mutants
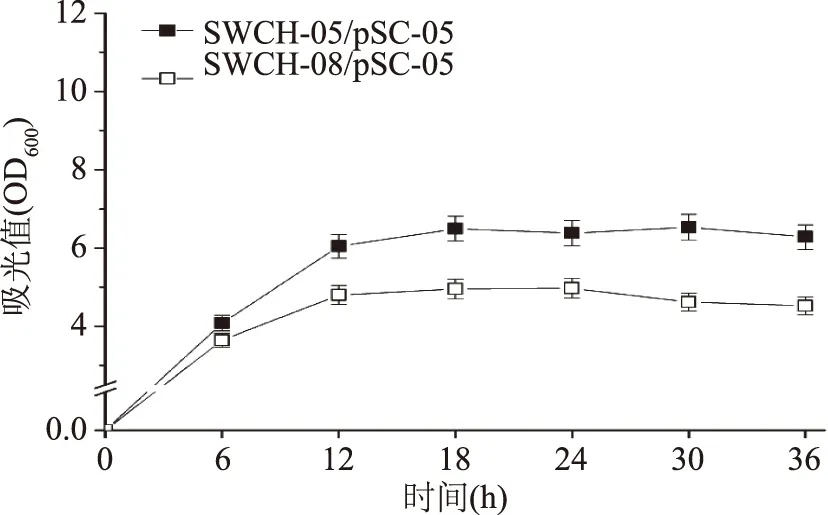
圖9 L-絲氨酸四基因敲除菌生長情況Fig.9 The cell growth of quadruple-gene deletion mutants
3 結論與討論
本文首次系統考察了不同組合敲除L-絲氨酸四個吸收基因sstT、cycA、sdaC和tdcC,對菌株產L-絲氨酸和生長的影響。在11個組合敲除突變菌中,sstT·sdaC雙基因敲除菌,sstT·cycA·sdaC和sstT·sdaC·tdcC兩個三基因敲除菌以及sstT·cycA·sdaC·tdcC四基因敲除菌的L-絲氨酸產量均明顯高于對照菌,可見敲除多個L-絲氨酸吸收基因確實可以提升菌株產L-絲氨酸的能力;其次,上述三個敲除突變菌的基因組上均具有sstT·sdaC雙基因缺失特征,可見吸收基因sdaC和sstT在細胞調控L-絲氨酸吸收方面起主要作用;但值得注意的是,一些吸收基因敲除后,菌體L-絲氨酸的產量反而出現了下降,但當四個吸收基因均被敲除后,菌體L-絲氨酸產量又是最高的,這說明四個吸收基因之間可能存在一定的相互作用。在菌株生長方面,當四個吸收基因均被敲除后,菌體的生長受到明顯抑制,這可能是由于菌體L-絲氨酸吸收基因全部被敲除后,培養液中的L-絲氨酸已經無法轉移至胞內供給菌體生長所致。
[1]M Yang,Vousden K H. Serine and one-carbon metabolism in cancer[J]. Nature Reviews Cancer,2016,16(10):650-662.
[2]G Y Zhu,Zhu X,Wan X L,et al. Hydrolysis technology and kinetics of poultry waste to produce amino acids in subcritical water[J]. Journal of Analytical and Applied Pyrolysis,2010,88(2):187-191.
[3]F Effenberger,Zoller G. Investigations on the synthesis of DL-serine fromα-haloacrylic acid derivatives(Aminoacid;13)[J]. Tetrahedron,1988,44(17):5573-5582.
[4]W Jiang,Xia B,Liu Z. A serine hydroxymethyltransferase from marine bacterium Shewanella algae:Isolation,purification,characterization and l-serine production[J]. Microbiological Research,2013,168(8):477-484.
[5]Q J Zhu,Zhang X M,Luo Y C,et al. L-Serine overproduction with minimization of by-product synthesis by engineered Corynebacterium glutamicum[J]. Applied Microbiology and Biotechnology,2015,99(4):1665-1673.
[6]H Mundhada,Schneider K,Christensen H B,et al. Engineering of High Yield Production of L-Serine inEscherichiacoli[J]. Biotechnology and Bioengineering,2016,113(4):807-816.
[7]崔云風,石斌超,李晶,等. 大腸桿菌絲氨酸轉運系統單基因敲除對絲氨酸生產的影響[J]. 食品工業科技,2016,37(14):191-195.
[8]K Marin,Kramer R. Amino acid transport systems in biotechnologically relevant bacteria[J]. Microbiol Monogr,2007,5:290-325.
[9]Y Liu,Wang H,Shi J P,et al. Research progress on metabolic engineering for microbial production of L-serine[J]. Biotechnology Bulletin,2015,31(8):44-49.
[10]K H Lee,Park J H,Kim T Y. Systems metabolic engineering ofEscherichiacolifor L-threonine production[J]. Molecular Systems Biology,2007,3(1):149.
[11]Q Liu,Cheng Y S,Xie X X,et al. Modification of tryptophan transport system and its impact on production of L-tryptophan inEscherichiacoli[J]. BIoresource Technology,2012,114:549-554.
[12]Z J Zhao,Chen S,Wu D,et al. Effect of gene knockouts of l-tryptophan uptake system on the production of l-tryptophan inEscherichiacoli[J]. Process Biochemistry,2012,47:340-344.
[13]J H Park,Lee K H,Kim T Y,et al. Metabolic engineering ofEscherichiacolifor the production of L-valine based on transcriptome analysis and in silico gene knockout simulation[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(19):7797-7802.
[14]W Ogawa,Kayahara T,Tsuda M,et al. Isolation and characterization of anEscherichiacolimutant lacking the major serine transporter and cloning of a serine transporter gene[J]. Biochemical Journal,1997,122(6):1241-1245.
[15]W Ogawa,Kim Y M,Mizushima T,et al. Cloning and Expression of the Gene for the Na+-Coupled Serine Transporter fromEscherichiacoliand Characteristics of the Transporter[J]. Journal of Bacteriology,1998,180(24):6749-6752.
[16]S D Cosloy. D-serine transport system inEscherichiacoliK-12[J]. Journal of Bacteriology,1973,114:679-684.
[17]F Schneider,Kramer R,Burkovski A. Identification and characterization of the main beta-alanine uptake system inEscherichiacoli[J]. Applied Microbiology and Biotechnology,2004,65(5):576-582.
[18]R J Wargel,Shadur C A,Neyhaus F C. Mechanism of D-cycloserine action:transport systems for D-alanine,D-cycloserine,L-alanine,and glycine[J]. Journal of Bacteriology,1970,103:778-788.
[19]H Hama,Shimamoto T,Tsuda M,et al. Properties of a Na+-coupled serine-threnine transport system inEscherichiacoli[J]. Biochim Biophys Acta,1987,905:231-239.
[20]H Hama,Shimamoto T,Tsuda M,et al. Characterization of a novel I-serine transport system inEscherichiacoli[J]. Journal of Bacteriology,1988,170(5):2236-2239.
[21]Z Q Shao,Lin R T,Newman E B. Sequencing and characterization of thesdaCgene and identification of thesdaCBoperon inEscherichiacoliK1[J]. Eur J Biochem,1994,222:901-907.
[22]V N Sumantran,Schweizer H P,Datta P. A Novel Membrane-Associated Threonine Permease Encoded by thetdcCGene ofEscherichiacoli[J]. Journal of Bacteriology,1990,172(8):4288-4294.
[23]Q Chen,Wang Q,Wei G,et al. Production inEscherichiacoliof poly(3-hydroxybutyrate-co-3-hydroxyvalerate)with differing monomer compositions from unrelated carbon sources[J]. Applied and Environmental Microbiology,2011,77(14):4886-4893.
Effectofmulti-geneknockoutofL-serineuptakesystemonL-serineproductioninEscherichiacoli
SHIBin-chao1,2,CUIYun-feng1,WANGChen-yang2,ZHAOZhi-jun2,SHIJi-ping2,ZHANGXia1,*
(1.College of Life Science,Shihezi University,Shihezi 832000,China; 2.Shanghai Advanced Research Institute of Chinese Academy of Sciences,Shanghai 201210,China)
Four genes have been reported to be involved in serine uptake inEscherichiacoli,which weresstT,cycA,sdaCandtdcC. In this study,combinatorial deletion of these genes was performed and effects on L-serine production and strain growth were investigated. The result revealed that,in all 11 multi-gene deletion mutants,sstT·sdaCdouble-gene deletion mutant,sstT·sdaC·tdcCandsstT·cycA·sdaCtriple-gene deletion mutants had higher L-serine production than the original strain and their L-serine production were 271.11,312.58 and 322.57 mg/L,respectively. Besides,thesstT·cycA·sdaC·tdcCquadruple-gene deletion mutant achieved the highest L-serine production of 450.58 mg/L,which was 6-fold when compared to that of the original strain. In addition,the cell growth of double-and triple-gene deletion mutants were similar or above to that of the original strain. But the cell growth of the quadruple-gene deletion mutant decreased remarkably,whose OD600was 28% lower than that of the original strain.
L-serine;uptake genes;strains growth;ability to produce L-serine
2017-02-27
石斌超(1991-),男,碩士研究生,研究方向:代謝工程,E-mail:shibc@sari.ac.cn。
*通訊作者:張霞(1964-),女,大學本科,教授,研究方向:植物資源與遺傳,E-mail:xiazh@shzu.edu.cn。
國家自然科學基金青年科學基金項目(31300048)。
TS201.3
:A
:1002-0306(2017)16-0106-07
10.13386/j.issn1002-0306.2017.16.021

