肥料中鋅檢測方法的研究
樊文研++陳麗娟++馮敏

摘 要:本實驗參照國標GB/T 14540—2003的消化方法和SN/T 0736.12—2009微波消解一起,同時消化一份樣品并加標,之后根據GB/T 14540—2003上火焰原子吸收,再根據NY/T 1974—010上ICP-OES,比較各測定結果及回收率。
關鍵詞:鋅;肥料;檢測方法
中圖分類號:S14 文獻標識碼:A DOI:10.11974/nyyjs.20170833002
鋅是生命體中必需的微量元素之一,對人體免疫、消化循環、神經、生殖、運動等功能起著重要作用,缺鋅影響生長發育,可使毛發色素變淡、指甲上出現白斑,以及延緩人體的生長發育,影響維生素A的代謝和正常視覺,可見鋅在人體中具有重要的作用。作物缺鋅表現為糧食、果實和根塊產量減少,農產品品質降低,缺乏對高光強、低溫和干旱的抗性、抗病蟲和抗重金屬毒害性降低。鋅在肥料產品中是以微量元素的形式引入的,這就減少了土壤缺鋅而導致作物缺鋅、人體缺鋅的危害。目前,肥料測鋅主要有分光光度法、火焰原子吸收法和電感耦合等離子發射光譜法等。分光光度法,操作煩瑣;火焰原吸收操作簡單,是實驗室的優選方法;電感耦合等離子發射光譜法測鋅,操作簡單,線性范圍更寬,比火焰原吸更具吸引力。實驗在參照國標GB/T 14540—2003和農業部標準NY/T 1974—2010,還利用SN/T 0736.12—2009微波消解消化樣品,開展化肥中鋅的檢驗研究。
1 實驗部分
1.1 儀器及試劑
電感耦合等離子體發射光譜儀(PerkinElmer Optima 8000);原子吸收分光光度計(AA-7003);微波消解儀(Anton Paar Multiwave ECO)。鋅標準溶液:1000?g/mL(GBW(E)08020-10121);鹽酸溶液(1+5):量取200mL濃鹽酸(GR)加入1000mL超純水中,攪勻;硝酸溶液(GR)(2%):取20mL濃硝酸于1000mL容量瓶中,用超純水稀釋至刻度,搖勻。
1.2 火焰原子吸收分析條件
波長:213.9 nm;燈電流:4.45mA;狹縫:0.2nm;燃燒頭高度:10mm;火焰類型:空氣-乙炔火焰;燃氣流量:1.0L/min;助燃氣流量:4.0L/min;采樣速度:200ms;平滑計數:10;標尺擴展(0.1-100):1;積分時間1.00。
1.3 電感耦合等離子體發射光譜儀分析條件
波長:206.200nm(儀器默認);功率1.3kW;軸向觀測;等離子氣15L/min,輔助氣0.2L/min,霧化氣0.5L/min;蠕動泵流速1.5L/min;光源穩定15s,讀數延長20s,重復測定2次。
1.4 標準系列的配制
鋅標準使用液:取2.0mL鋅標準溶液(1000?g/mL)于100mL容量瓶中,用2%硝酸溶液稀釋至刻度,此溶液為20?g/mL。
標準系列,系列1:分別吸取0.00、0.10、0.25、0.50、0.75、1.00mL鋅標準使用液于50mL容量瓶中,用2%硝酸溶液稀釋至刻度,此標準系列濃度為0.0、0.04、0.1、0.2、0.3、0.4?g/mL。系列2:分別吸取0.00、0.25、0.50、1.00、2.50、5.00、10.00mL鋅標準使用液于50mL容量瓶中,用2%硝酸溶液稀釋至刻度,此標準系列濃度為0.0、0.1、0.2、0.4、1.0、2.0、4.0?g/mL。
1.5 樣品前處理
1.5.1 參照GB/T 14540—2003制備試樣溶液
稱取5~8g試樣(精確至0.0001g),置于400mL高腳燒杯中,加入50mL鹽酸溶液(1+5),蓋上表面皿,在電熱板上煮沸15min,取下,冷卻至室溫后轉移到250mL容量瓶中,用水稀釋至刻度,混勻,干過濾,棄去最初幾毫升濾液后,備用。同時做空白試驗。
1.5.2 參照SN/T 0736.1—2009微波消解制備試樣溶液并做加標試驗
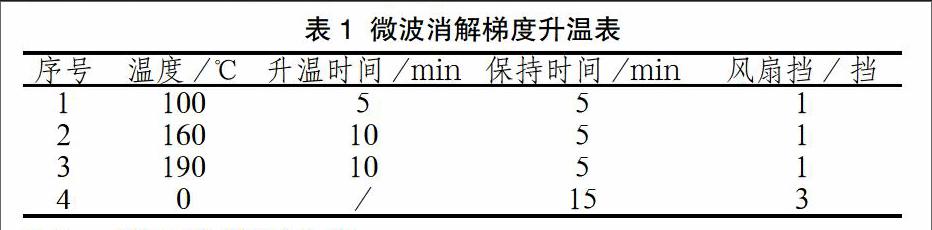
稱取0.1~0.2g試樣(精確至0.0001g)2份于消解罐中,其中一份加入0.25mL鋅標準溶液(1000?g/mL)。加入濃硝酸5.0mL,氫氟酸1.0mL,置于100℃恒溫消解儀中預消解30min,冷卻至室溫,蓋好安全閥,放入微波消解儀中,根據表1設定的步驟進行消解,消解結束后,將消化灌至于通風廚中輕輕扭開,再置于120℃恒溫消解儀中趕酸30min,待趕酸完畢后拿出,冷卻后轉移至50mL容量瓶中,定容備用。同時做空白。
1.6 測定及繪制曲線
1.6.1 火焰原子吸收測定
根據原子吸收操作規程和原子吸收分析條件,測定標準系列1、樣品空白及樣品溶液,以吸光度A(無單位)為縱坐標,濃度C(?g/mL)為橫坐標,繪制標準為Y=0.9256X+0.0085,r=0.999806。
1.6.2 ICP-OES測定
根據ICP-OES操作規程和分析條件,測定標準系列1、樣品空白及樣品溶液,以強度I(cps)為縱坐標,濃度C(?g/mL)為橫坐標,繪制標準曲線為Y=33989.8X-74.9,r=0.999756。
測定標準系列2、樣品空白及樣品溶液,以強度I(cps)為縱坐標,濃度C(?g/mL)為橫坐標,繪制標準曲線為Y=31676.3X+649.8,r=0.999771。
2 結論
2.1 結果分析
表2顯示,用AAS和ICP同時測定(1+5)酸煮的樣品,其相對誤差均在2.4%~4.4%之間,測定微波消解的樣品,其相對誤差均在1.3%~5.8%之間;而用以上2種前處理方法處理樣品,同時用AAS測定,其相對誤差均在2.7%~7.1%之間,用ICP測定,其相對誤差均在1.1%~6.4%之間。endprint
表3顯示,微波消解的樣品用AAS測定其回收率均在93.2%~98.2%之間,用ICP-系列1測定其回收率均在95.1%~104.9%之間,而用ICP-系列2測定其回收率均在96.3%~102.6%之間。
實驗表明,不管是用(1+5)酸煮的樣品還是微波消解的樣品,還是用AAS還是ICP-OES測定,測定結果的相對誤差均在1.1%~7.1%之間,小于國標GB/T 14540—2003和農業部標準NY/T 1974—2010方法中平行測定結果的相對誤差不大于10%的要求。另外,標準系列2的回收率更好一點,這可能是因為標準系列2線性范圍比較寬,所需稀釋倍數較小的緣故。ICP-OES線性范圍比較寬,同一樣品稱樣量和定容體積相同的情況下,ICP-OES的稀釋倍數相對較低,可以減少稀釋誤差,另外,微波消解可以批量消化,消化之后無須過濾,無須分取直接靜置即可上機測定,確實方便。
2.2 討論
2.2.1 預消解的溫度、時間的調節
預消解是把樣品組成中一些低分子的有機物、還原性強的有機物、具有揮發性的物質在常壓下先與酸反應,避免因反應過于劇烈或分解產生大量的氣體(如硝酸鋇分解成NO2等)而使壓力驟升。預消解可以采用2加酸后放置過夜的方法,也可以采用在微波消解前低溫消解的方法,消解的時間因樣品而異,本實驗采用100℃消解儀中消解30min。
2.2.2 趕酸的溫度、時間的調節
氫氟酸對進樣系統,特別是霧化器具有強腐蝕性,所以微波消解完畢后趕酸顯得很有必要。而硝酸分解出來的NO、NO2是有毒氣體,也需要在恒溫消解儀中一起趕走,另外,如果硝酸加多的情況下一起把硝酸趕走。本實驗采用120℃消解儀中趕酸30min。
參考文獻
[1]王令.次靈敏線原子吸收光譜法測定肥料中高含量鋅[J].化工管理,2015(9):197.
[2]李苑香.氫化物-原子熒光法測定水中鉛-鐵氰化鉀-硝酸體系[J].科技風,2012(2):42.
[3]王磊.微波消解預處理技術在食品分析與檢測中的應用[J]. 產業與科技論壇,2013,12(13):93-94.
[4]藍海英,丁冶春,范小娜,等.微波消解-原子熒光光譜法測定耳草中四種重金屬元素含量[J].廣東微量元素科學,2013,20(6):19-22.
[5]湯家華,王玉文,張家庭,等.5'-硝基水楊基熒光酮-溴化十六烷基三甲胺-檸檬酸光度法測定鋅[J].應用化工,2014(12):2307-2309.
作者簡介:樊文研,女,內蒙人,本科,高級工程師,現任玉林食品藥品檢驗所所長。endprint

