重癥急性胰腺炎并發腸道免疫功能障礙的實驗研究
周淼,兌丹華,敖宇,代靜靜
(遵義醫學院附屬醫院 普通外科,貴州 遵義 563000)
重癥急性胰腺炎并發腸道免疫功能障礙的實驗研究
周淼,兌丹華,敖宇,代靜靜
(遵義醫學院附屬醫院 普通外科,貴州 遵義 563000)
目的:探討重癥急性胰腺炎大鼠腸道免疫損傷的狀況。方法:將48只SD大鼠隨機分成假手術組(A組)和重癥急性胰腺炎(severe acute pancreatitis,SAP)組(B組),各24只。A組開腹后僅翻動腸管;B組采用胰膽管逆行注射5%硫磺膽酸鈉[0.1 ml·(100 g-1)]建立SAP模型。造模后6、12、24 h每組取8只大鼠,開腹取胰腺組織、回腸做病理學切片,光鏡觀察胰腺病理變化,光鏡及電鏡觀察腸黏膜病理變化。酶聯免疫吸附試驗(ELISA)檢測血清IL- 1、IL- 10的濃度,收集回腸Peyer’s結,流式細胞術行CD3+、CD4+、CD8+細胞凋亡檢測,RT- PCR檢測回腸HMGB1mRNA含量。結果:B組各時間點胰腺病理學評分較A組升高(均P<0.01),B組隨時間延長胰腺病理學評分逐漸升高(均P<0.05)。B組各時間點回腸HMGB1mRNA表達量均較假手術組升高(P<0.01或P<0.05),各時間點CD3+、CD4+、CD8+細胞的凋亡率較假手術組上升(P<0.01或P<0.05),回腸病理損傷較假手術組加重。結論:SAP大鼠并發腸道免疫功能障礙。
重癥急性胰腺炎; 腸道免疫屏障; 高遷移率蛋白1; 淋巴細胞; 大鼠
重癥急性胰腺炎(severe acute pancreatitis,SAP)是臨床上常見的急腹癥,具有較高的發病率和病死率[1]。臨床上大多數患者病程呈自限性,20%~30%患者病情較兇險,總體病死率為5%~10%[2]。SAP發生后炎癥因子大量釋放,隨后機體會代償產生大量抑炎因子,使機體處于免疫麻痹狀態[3],此時腸道免疫功能受到抑制,腸道內細菌、內毒素等移位導致繼發感染,甚至導致多器官功能衰竭。因此,加強腸道免疫功能的保護成為研究的關鍵。本研究采用胰膽管逆行注射5%硫磺膽酸鈉建立SAP模型,探討SAP大鼠腸道免疫屏障變化情況。
1 材料與方法
1.1 主要材料
牛磺膽酸鈉購買于美國Sigma公司,10%水合氯醛由遵義醫學院提供,SD大鼠購自重慶第三軍醫大學[證書編號為Scxk(渝)2012- 0005],引物設計與合成購自上海生工生物工程技術服務有限公司,熒光定量PCR試劑盒(提取RNA、逆轉錄、擴增)均購于寶生物工程(大連)有限公司,流式細胞儀購于美國BECKMAN COULTER,CD3+、CD4+、CD8+抗體均購于Biolegend公司,大鼠IL- 1、IL- 10 ELISA試劑盒購于康寶生物有限公司。
1.2 方法
1.2.1 動物分組及模型建立 SD大鼠48只,體質量200~250 g,鼠齡8~10周,雌雄不限。將大鼠隨機分為對照組(A組,24只)和SAP模型組(B組,24只)。術前禁食不禁水12 h,10%水合氯醛[0.33 ml·(100 g)-1]麻醉動物,A組大鼠開腹后僅翻動腸管,B組大鼠采用膽胰管逆行注射5%牛磺膽酸鈉[0.1 ml·(100 g)-1]制作SAP模型。
1.2.2 標本采集和保存 兩組于術后6、12、24 h麻醉后經原切口入腹,每個時間點取8只大鼠標本。酶聯免疫吸附試驗(ELISA)檢測血清IL- 1、IL- 10的濃度,取部分回腸生理鹽水沖洗干凈,勻漿法提取RNA,逆轉錄成cDNA后于-80 ℃冰箱保存,備HMGB1基因的檢查;取部分胰腺組織,10%中性福爾馬林溶液中固定,4 μm連續切片供HE染色。
1.2.3 胰腺組織病理學評分 在光鏡下比較各組胰腺病理學改變,按照鏡下病理學評分標準由病理科醫生進行雙盲評分。
1.2.4 RT- PCR檢測回腸組織中HMGB1mRNA的表達 參照TaKaRa公司RNAiso Reagent試劑盒說明提取組織中總RNA,并逆轉錄為cDNA。熒光定量PCR反應條件:95 ℃ 30 s;95 ℃ 5 s,57 ℃ 30 s,共40個循環;55 ℃ 10 min。HMGB1引物序列上游為5′- TGAGAAGCTGGCTGTAATGC- 3′,下游為5′- AAATGGCTTGGACAACTGGTA- 3′,擴增長度為222 bp;β- actin上游為5′- TGTCACCAACTGGGACGATA- 3′,下游為5′- GGGGTGTTGAAGGTCTCAAA- 3′,擴增長度為165 bp。
1.2.5 回腸組織的病理學檢測 取末端回腸組織固定于10%中性甲醛緩沖液中,石蠟包埋,4 μm連續切片,HE染色,由專業病理醫師觀察切片。取一段回腸,暴露黏膜面,用預冷生理鹽水徹底沖洗,切取5 mm×3 mm ×3 mm大小回腸組織,固定于4%戊二醛固定溶液,標本用逐級增高濃度的酒精(30%-50%-70%-80%-90%-100%)脫水2次,吸出乙醇,加入醋酸異戊酯與乙醇1∶1混合液,進行干燥及樣品導電處理,最后行電鏡掃描。
1.2.6 流式細胞術檢測免疫細胞 收集回腸Peyer’s結制備成單細胞懸液,立即按CD3+、CD4+、CD8+流式抗體試劑盒說明(CD3+、CD4+、CD8+分別由PE、PE- Cy7、APC標記)及凋亡檢測試劑盒說明(Annexin V- FITC/PI)行流式細胞術檢測。
1.3 統計學處理
采用SPSS 17.0統計軟件。定量資料以均數±標準差表示,組與組之間比較用t檢驗,多組間比較用單因素方差分析(one- way ANOVA)。P<0.05為差異有統計學意義。
2 結 果
2.1 胰腺的病理學評分
A組6、12、24 h 3個時間點胰腺病理學評分均為0,大鼠胰腺組織無充血、水腫及壞死(圖1A);B組3個時間點病理學評分依次為7.00±0.82、11.00±0.82、13.5±0.5,胰腺腺泡腫脹、間質水腫,大片出血及壞死灶,大量炎癥細胞浸潤(圖1B)。B組與A組相比胰腺病理學評分顯著升高(P<0.01),B組隨時間延長病理評分逐漸升高(P<0.05)。
2.2 回腸光鏡下表現
光鏡下A組回腸組織無水腫、出血及壞死,腺體結構完整(圖2A);B組鏡下見回腸組織結構紊亂、間質水腫、出血,大量中性粒細胞浸潤,局部灶性壞死(圖2B)。
電鏡下A組腸黏膜表面微絨毛清晰,數目多,直立、凸起,排列整齊(圖3A);B組微絨毛壞死、脫落、融合(圖3B)。
2.3 兩組大鼠不同時間點IL- 1、IL- 10的濃度
B組術后6、12、24 h 3個時間點血清IL- 1濃度分別為21.368 0±0.634 9、32.378 0±2.284 2、44.958 5±1.296 3,顯著高于A組的14.497±0.5019(P<0.01);IL- 10濃度分別為13.360 6±0.522 6、14.983 5±0.879 0、19.039 3±1.199 2,顯著高于A組的7.343 0±0.440 4(P<0.01)。B組IL- 1、IL- 10濃度隨時間推移逐漸升高(P<0.01)。

A.假手術組;B.SAP模型組
A.sham operation group; B.SAP model group
圖1 術后6 h兩組胰腺組織病理學檢查(HE ×100)
Fig 1 Pathological examination of pancreas in two group at 6 h after operation (HE ×100)

A.假手術組;B.SAP模型
A.sham operation group; B.SAP model group
圖2 術后6 h兩組回腸組織病理學檢查(HE ×100)
Fig 2 Ileum pathological examination in two group at 6 h after operation(HE ×100)

A.假手術組;B.SAP模型組
A.sham operation group; B.SAP model group
圖3 術后6 h兩組電鏡觀察回腸組織(×10 000)
Fig 3 Ileal tissues were observed by electron microscope in two group at postoperative 6 h(×10 000)
2.4 各時間點回腸HMGB1 mRNA表達量
A組回腸HMGB1 mRNA表達量為1.039 6±0.562 6,B組術后6、12、24 h 3個時間點回腸HMGB1mRNA表達量依次為4.170 3±1.316 6、35.848 9±3.004 8、63.704 1±2.459 7,B組各時間點HMGB1 mRNA表達量相對A組顯著增加(P<0.01),且隨時間推移顯著增高(P<0.01)。
2.5 各組大鼠CD3+、CD4+、CD8+淋巴細胞凋亡率
與A組相比,各時間點B組回腸組織CD3+、CD4+、CD8+淋巴細胞凋亡率均明顯升高,且隨時間呈上升趨勢(P<0.05或P<0.01);CD8+淋巴細胞6 h和12 h相比時,雖升高,但差異無統計學意義。見表1。
3 討 論
腸黏膜屏障一般由機械屏障、化學屏障、免疫屏障和生物屏障構成,其主要作用是阻止腸道內有害物質(如腸內的細菌及內毒素)進入體循環[4]。SAP時,大量炎癥介質和細胞因子釋放,使腸道出現微循環障礙,大量免疫細胞凋亡,導致腸道局部或全身免疫力下降,從而導致腸道發生免疫功能損傷。可見,發生SAP時,加強對腸道黏膜免疫屏障的保護,對腸黏膜屏障乃至對全身免疫功能都有積極作用。目前關于SAP時發生腸免疫屏障機制尚不清楚。
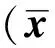


組 別淋巴細胞凋亡率/%CD3+CD4+CD8+A組1.1400±0.29661.1200±0.22801.1600±0.1342B組 6h10.1000±0.5431a9.8200±0.2280ab10.3400±0.6580a 12h16.9400±2.4600ac14.2000±2.8443a14.9800±3.1499a 24h26.6000±0.9407a25.0200±1.4255ac27.1000±1.5758ac
與A組比較,aP<0.01;B組同組相鄰時間點比較,bP<0.05,cP<0.01
HMGB1作為一種晚期炎癥因子[5],可介導腸黏膜屏障損傷而導致腸道通透性增加[6]。Wolfson等[7- 8]研究發現,用HMGB1處理腸上皮細胞和內皮細胞后可引起單層細胞屏障功能喪失。Luan等[9]的研究表明,AP大鼠腸黏膜中HMGB1含量明顯升高。Yang等[10]的研究顯示,含HMGB1的膽汁可破壞腸黏膜屏障。上述研究均證實,HMGB1介導了SAP時IBFD的發病過程,但其發病機制尚不十分明確。喬世峰等[11]研究SAP大鼠腸道免疫功能的變化發現,SAP發生后各期CD3+、CD4+、CD4+/CD8+細胞明顯下降,說明大鼠早期即發現腸黏膜免疫功能明顯下降。王興鵬等[12]研究發現,ANP大鼠回腸Peyer集合淋巴結中存在大量凋亡淋巴細胞,亦證明了SAP大鼠存在腸道免疫屏障受損。本實驗通過成功建立SAP大鼠模型發現,各時間點回腸組織CD3+、CD4+、CD8+細胞的凋亡率較假手術組明顯提高(P<0.01或P<0.05),與文獻報道相符,SAP大鼠腸黏膜免疫功能下降,且SAP模型組大鼠各時間點回腸HMGB1mRNA表達量均較假手術組上升(P<0.01或P<0.05),說明HMGB1與腸道黏膜免疫損傷存在一定關系。
HMGB1是眾所周知的危險相關分子模式或警報素,能夠激活先天性免疫反應。HMGB1可激活樹突細胞并誘導樹突細胞成熟[13- 14],成熟樹突細胞通過淋巴管遷移到淋巴結,將其在外周組織獲得的外源性抗原提呈給未致敏T細胞,從而啟動免疫反應。其次,HMGB1及其功能域B盒具有免疫刺激信號活性分泌炎癥因子TNF- α、IL- 1、IL- 6、IL- 8和IL- 12的功能[15],這些炎癥介質的釋放對SAP的發生發展至關重要。SAP時存在HMGB1的改變及細胞免疫功能的障礙[16]。前期實驗[17]顯示,SAP大鼠血清HMGB1隨時間逐漸上升;本實驗顯示SAP大鼠血清IL- 1、IL- 10的濃度隨著病程進展越來越高,與此同時SAP模型組大鼠各時間點回腸HMGB1 mRNA表達量也越來越多。
綜上所述,SAP模型組胰腺病理評分與假手術組相比明顯升高,模型復制成功;隨著病程時間的延長,胰腺病理損傷越來越重;各時間點回腸HMGB1 mRNA表達量均上升,CD3+、CD4+、CD8+細胞凋亡率提高,IL- 1、IL- 10濃度越來越高,回腸病理損傷顯著加重。HMGB1可能通過對腸道T淋巴細胞的調節,從細胞免疫途徑介導了腸黏膜免疫功能障礙,加重SAP病情。
[1] 張恒斌.三種評分系統對急性胰腺炎病情及預后的評估價值[J].現代醫學,2016,44(1):32- 36.
[2] 王興鵬,李兆申,袁耀宗,等.中國急性胰腺炎診治指南(2013,上海)[J].中國實用內科雜志,2013,13(2):73- 78.
[3] RAHMAN S H,AMMORI B J,HOLMFIELD J,et al.Intestinal hypoperfusion contributes to gut barrier failure in severe acute pancreatitis[J].J Gastrointest Surg,2003,7(1):26- 36.
[4] 汪冬,周其全.高原缺氧環境下腸道菌群紊亂與急性重癥高原病[J].胃腸病學和肝病學雜志,2017,26(2):222- 226.
[5] SHEN X,LI W Q.High- mobility group box 1 protein and its role in severe acute pancreatitis[J].World J Gastroenterol,2015,21(5):1424- 1435.
[6] WANG H,YANG H,TRACEY K J.Extracellular role of HMGB1 in inflammation and sepsis- Wang- 2004- Journal of Internal Medicine- Wiley Online Library[J].J Intern Med,2004,255(3):320- 331.
[7] WOLFSON R K,CHIANG E T,GARCIA J G N.HMGB1 induces human lung endothelial cell cytoskeletal rearrangement and barrier disruption[J].Microvasc Res,2011,81(2):189- 197.
[8] DAI S,SODHI C,CETIN S,et al.Extracellular high mobility group box- 1 (HMGB1) inhibits enterocyte migration via activation of Toll- like receptor- 4 and increased cell- matrix adhesiveness[J].J Biol Chem,2010,285(7):4995- 5002.
[9] LUAN Z G,ZHANG H,MA X C,et al.Role of high- mobility group box 1 protein in the pathogenesis of intestinal barrier injury in rats with severe acute pancreatitis[J].Pancreas,2010,39(2):216- 223.
[10] YANG R,MIKI K,OKSALA N,et al.Bile high- mobility group box 1 contributes to gut barrier dysfunction in experimental endotoxemia[J].Am J Physiol Regul Integr Comp Physiol,2009,297(2):R362- 369.
[11] 喬世峰,孫家邦,李非,等.重癥胰腺炎大鼠腸道免疫功能改變及精氨酸的調節作用[J].中國免疫學雜志,2006,22(8):761- 763.
[12] 王興鵬,王冰嫻,吳愷,等.細胞凋亡在急性壞死型胰腺炎早期腸黏膜上皮細胞死亡中的作用[J].中華消化雜志,2001,21(5):267- 270.
[13] AMMORI B J,CAIRNS A,DIXON M F,et al.Altered intestinal morphology and immunity in patients with acute necrotizing pancreatitis[J].J Hepatobiliary Pancreat Surg,2002,9(4):490- 496.
[14] MESSMER D,YANG H,TELUSMA G,et al.High mobility group box protein 1:an endogenous signal for dendritic cell maturation and Th1 polarization[J].J Immunol,2004,173(1):307- 313.
[15] ROVEREQUERINI P,CAPOBIANCO A,SCAFFIDI P,et al.HMGB1 is an endogenous immune adjuvant released by necrotic cells[J].Embo Reports,2004,5(8):825- 830.
[16] 姜良富,石承先,段澤艷.急性胰腺炎時T淋巴細胞亞群的改變與細菌移位的關系[J].海南醫學院學報,2005,11(4):254- 257.
[17] 趙建鋒,兌丹華,代靜靜,等.清胰Ⅱ號對重癥急性胰腺炎大鼠胰腺損傷的保護作用及機制探討[J].山東醫藥,2016,56(10):25- 26.
Experimental study of intestinal immune dysfunction in severe acute pancreatitis
ZHOU Miao,DUI Dan- hua,AO Yu,DAI Jing- jing
(DepartmentofGeneralSurgery,AffiliatedHospitalofZunyiMedicalCollege,Zunyi563000,China)
Objective: Objective:To investigate the status of intestinal immune damage in rats with severe acute pancreatitis. Methods: 48 SD rats were randomly divided into sham operation group (A), SAP group (B), 24 rats in each. group A
laparotomy only without injection; group B retrograde pancreatic duct injection of 5% sodium taurocholate [0.1 ml·(100 g)-1] to establish SAP model. After modeling, 6 h, 12 h, 24 h, pancreas tissue and ileum were taken for pathological section, then the pathological changes were observed under light and electron microscopy to observe the pathological changes of pancreas and intestinal mucosa. Enzyme linked immunosorbent assay (ELISA) was performed to detect the concentration of serum IL- 1, IL- 10, the ileum s’ Peyer nodes were collected, flow cytometry was performed for CD3+, CD4+, CD8+cells apoptosis detection, and finally RT- PCR was carried out to detect the HMGB1mRNA content of ileum. Results: The pancreatic pathological score in group B was higher than that in group A (P<0.01), and the pancreatic pathological score was higher in group 6- 24 h than in group B (P<0.05). HMGB1mRNA expression in ileum mucosa in group B at each time point was higher than that in the sham operation group (P<0.01 orP<0.05), the apoptosis rate of CD3+, CD4+and CD8+cells at each time point increased compared with the sham operation group (P<0.01 orP<0.05), ileum pathological injury increased compared with the sham operation group. Conclusion: Rats with severe acute pancreatitis have disturbance of intestinal immune function.
severe acute pancreatitis; intestinal immune barrier; HMGB1; lymphocyte; rats
2016- 11- 24
2017- 05- 07
貴州省優秀科技教育人才省長專項資金項目[黔省專合字(2008)106號];遵義市紅花崗區科學技術項目
周淼(1989-),男,湖南衡陽人,在讀碩士研究生。E- mail:zhoumiao113@qq.com
兌丹華 E- mail:2361169015@qq.com
周淼,兌丹華,敖宇,等.重癥急性胰腺炎并發腸道免疫功能障礙的實驗研究[J].東南大學學報:醫學版,2017,36(4):559- 563.
R576
A
1671- 6264(2017)04- 0559- 05
10.3969/j.issn.1671- 6264.2017.04.012

