假單胞菌基因敲除方法研究進展
熊 烈,錢淑嵐,朱成云,李 駿,鐘衛鴻
(浙江工業大學生物工程學院,浙江 杭州 310032)
假單胞菌基因敲除方法研究進展
熊 烈,錢淑嵐,朱成云,李 駿,鐘衛鴻*
(浙江工業大學生物工程學院,浙江 杭州 310032)
基因敲除是近年來十分熱門的基因工程技術,假單胞菌(Pseudomonas)作為一種常見細菌,應用十分廣泛,因此,對假單胞菌進行基因敲除改造有著十分重要的意義。總結了假單胞菌基因敲除技術成功案例,并對2種基因敲除系統進行了比較,包括同源重組關鍵步驟的轉化方式、基因敲除方法的選擇、同源臂長度的選擇等。
假單胞菌;基因敲除;同源重組
基因敲除又稱基因打靶,是指外源打靶基因與基因組目標基因通過基因工程手段,在轉染細胞中發生DNA同源重組,使外源基因定點整合到基因組目標基因中[1]。基于該技術,可實現諸如插入突變、缺失突變等多種形式的突變。
假單胞菌(Pseudomonas)是一類重要的微生物,分布十分廣泛,在土壤、水體以及生物體中都可見。假單胞菌為革蘭氏陰性菌;細胞呈單個,多為直或彎的桿菌,大小為(0.5~1.0)μm×(1.4~4.0)μm,單鞭毛或多鞭毛;大多數假單胞菌的最適生長溫度在30 ℃左右,生長pH值在7.0~8.5之間[2]。由于假單胞菌在環境修復、生物防治、生物轉化等領域都有著廣泛的應用[3],因此對假單胞菌進行基因工程改造,尤其是基因敲除意義重大。為此,作者總結了假單胞菌基因敲除技術成功案例,并對2種基因敲除系統進行了比較,包括同源重組關鍵步驟的轉化方式、基因敲除方法的選擇、同源臂長度的選擇等,以期為假單胞菌基因敲除的深入研究提供參考。
1 非自身同源重組的基因敲除系統
Red同源重組又稱ET重組,最初應用于大腸桿菌中,可實現對細菌染色體基因的定點敲除。Murphy[4]在1998年首次利用λ噬菌體Red同源重組系統對大腸桿菌進行了基因修飾。
在細菌內,自然發生的同源重組效率極低,大約在10-6左右,而一般的轉染技術的轉化效率大概在104~105·(μgDNA)-1左右[5]。Red同源重組不依賴于宿主菌本身的重組系統,而是將λ噬菌體中編碼Exo、Beta、Gam3種蛋白質的基因克隆至載體中,再將攜帶同源臂與篩選標記的打靶片段導入宿主菌,利用載體在宿主菌中表達相應蛋白,實現同源重組。其中,exo基因編碼的Exo蛋白具有λ核酸外切酶活性,與雙鏈DNA末端相結合,從5′端向3′端降解DNA單鏈,產生3′突出末端[6];bet基因編碼的Beta蛋白與在Exo蛋白作用下產生突出末端的DNA分子結合,保護其不被降解且介導互補鏈的退火,同時兼有重組酶活性催化同源重組[7-8];gam基因編碼的Gam蛋白的分子量在16 000Da左右,可以與宿主RecBCD核酸外切酶結合,并抑制其活性,以防止外源DNA進入細菌后被宿主降解[9-10]。因此,Red同源重組可大大提高細菌同源重組效率。
1.1 依賴打靶片段的Red同源重組系統
依賴打靶片段的Red同源重組系統:將來源于λ噬菌體中的exo、bet、gam基因克隆至載體質粒上,并使其受誘導性啟動子調控,常用的啟動子有阿拉伯糖啟動子與間甲基苯甲酸啟動子等;再通過PCR得到攜帶有一定長度靶基因的上下游同源臂的標記基因片段;將標記基因片段轉化入經誘導的宿主菌中;最后通過相應的篩選可得到突變菌株。如圖1所示。
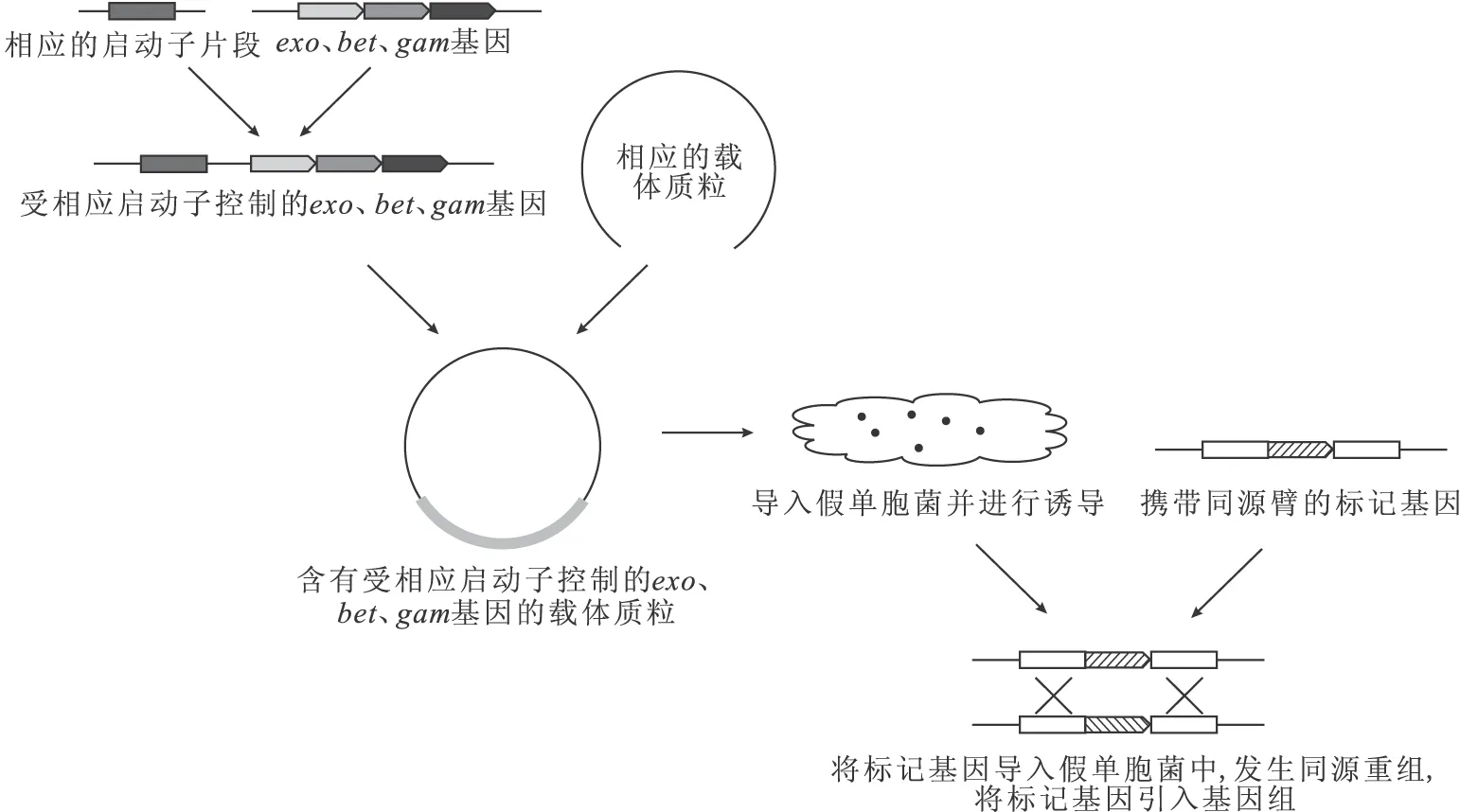
圖1 依賴打靶片段的Red同源重組系統示意圖
該方法的重組效率與同源臂長度密切相關,在E.coli中使用該方法只需幾十bp的同源臂即可完成敲除,而對于假單胞菌要用數百bp至1 000 bp的同源臂來提高同源重組的效率,但也有使用較短同源臂成功敲除的案例。余華等[11]將exo、bet、gam基因與阿拉伯糖啟動子相連,并克隆至質粒pUCP中,分別利用含有80 bp和400 bp同源臂的打靶片段在Pseudomonasaeruginosa中成功實現了基因敲除,使用較短同源臂時重組子正確概率在80%左右,而使用較長同源臂時正確概率幾乎達到100%。楊運文等[12]將exo、bet、gam基因與間甲基苯甲酸啟動子連接,并克隆至質粒pJB866中,利用含有500 bp同源臂的打靶片段在Pseudomonasputida中成功實現了基因敲除,重組效率達到5×10-5,重組子正確概率達到60%以上。
1.2 依賴雙質粒的Red同源重組系統
在基因敲除過程中,標記基因往往選擇的是抗生素抗性基因,使得在實際應用過程中會遇到許多問題,如水平轉移至其它細菌中會造成耐藥性、對環境存在一定威脅等。因此,需要將標記基因從基因組中敲除。
依賴雙質粒的Red同源重組系統:在依賴外源打靶片段的Red同源重組的基礎上,將loxP位點插入標記基因與同源臂之間,然后由exo、bet、gam基因的表達蛋白共同介導第一次同源重組,重組后的菌株再導入可誘導表達Cre酶的質粒,經誘導后可由Cre介導第二次同源重組,敲除標記基因與1個loxP位點。如圖2所示。
由于該方法操作較依賴打靶片段的Red同源重組系統復雜,故使用該方法的報道案例較少。Luo等[13]構建了含有間甲基苯甲酸啟動子誘導的exo、bet、gam基因的質粒pLS2352以及含有鼠李糖誘導的cre重組酶基因的質粒pLS1678;用500 bp左右的同源臂對PseudomonasputidaKT2440的多個基因完成了敲除,并且實現了標記基因的敲除,重組子正確概率幾乎達到100%。但是該方法會在基因組中留下1個loxP位點,若想在突變株的基礎上繼續進行基因敲除,則可能會受到一定影響。

圖2 Cre介導的第二次同源重組示意圖
2 依賴自身同源重組的基因敲除系統
依賴自身同源重組的基因敲除系統,通常使用在假單胞菌中不可復制的質粒攜帶靶基因上下游同源臂序列或靶基因內的一段序列進行同源重組,利用其在假單胞菌中自殺的特性,只有當質粒整合到基因組中時才能獲得質粒上的篩選標記,從而得到重組子[14-15]。
2.1 一輪同源重組的插入突變
一輪同源重組基因敲除的原理:在假單胞菌的自殺載體中攜帶有一段截短的目標基因序列,導入目標菌株后,由于該載體在目標菌株中自殺的特性,若未發生同源重組將質粒整合入基因組,其篩選標記無法表達,整合入基因組后篩選標記得以表達,從而實現插入突變。如圖3所示。

圖3 一輪同源重組基因敲除原理
雖然該方法只需發生一輪同源重組就可實現基因的插入突變,成功率較高,操作也較簡單;但是該方法無法實現無縫敲除,相比于Red同源重組系統所引入的外源片段也較長,可能以破壞靶基因上下游基因閱讀框結構的方式導致不必要的突變。因而,該方法通常用于以基因功能驗證為目的的基因敲除[16]。
一輪同源重組常用的自殺質粒有pK18mob、pCVD442、pEX18Tc等。其中,pK18mob是利用在假單胞菌中無法識別的復制子來實現自殺的;pCVD442實現自殺的原理是其復制子依賴于π蛋白,而一般的菌株中不表達π蛋白。Tang等[17]將361 bp的序列酶切連接至自殺質粒pK18mob中,利用一輪同源重組對PseudomonasputidaS16成功實現了hpo基因的敲除。張加勤等[18]利用自殺質粒pEX18Tc,將缺失部分序列的靶基因及上下游同源臂連接入載體質粒,對PseudomonasaeruginosaPAO1的clpP基因進行了敲除。
2.2 兩輪同源重組的無縫敲除
兩輪同源重組與一輪同源重組類似,也是利用自身同源重組系統實現基因敲除,其原理是:將目標基因上下游片段連接后克隆至自殺載體中,導入目標菌株后分別通過正篩選標記和反篩選標記得到發生2次同源重組且基因敲除的菌株。如圖4所示。
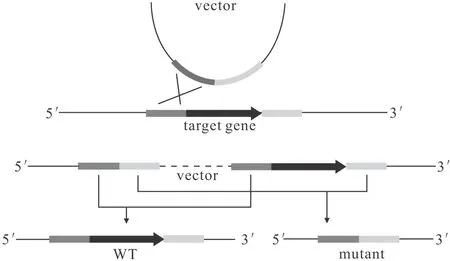
圖4 兩輪同源重組基因敲除原理
兩輪同源重組常用載體質粒有pK18mobsacB、pEX18Tc等。相較于一輪同源重組,兩輪同源重組需要發生2次同源重組且有一定恢復成野生型的概率,操作繁瑣,成功率較低;但是可以實現無縫敲除,不會對目標基因上下游基因造成影響[15]。Wang等[19]利用自殺質粒pEX18Tc攜帶700 bp左右的上下游同源臂對PseudomonasmendocinaNK-01成功進行了基因敲除。Liu等[20]利用質粒pK18mobsacB攜帶800 bp左右的上下游同源臂對PseudomonaschlororaphisGP72的lon基因成功進行了敲除。
3 2種基因敲除系統的比較(表1)
表1 2種基因敲除系統的比較

Tab.1 Comparison of two gene knockout systems
從表1可看出,操作最簡單的是一輪同源重組系統,但是該方法會將大量片段整合入基因組;操作最復雜的是依賴雙質粒的Red同源重組系統,但是該方法會將loxP位點遺留在基因組中。
3.1 同源重組關鍵步驟的轉化方式
在利用同源重組系統進行假單胞菌基因敲除的過程中,由于假單胞菌的特殊性,大多數假單胞菌可分泌胞外多糖從而保護細胞免受外界有害物質的作用[21],而這種多糖可能會阻礙Ca2+與細胞膜的作用,導致熱激效率下降。有學者針對多種假單胞菌的Ca2+感受態與熱激進行過優化,在最優條件下轉化效率也只能達到105·(μg DNA)-1左右[5],這對于常規質粒的轉化是足夠了的,但對于依賴同源重組而實現的基因敲除是遠遠不夠的。
依賴exo、bet、gam基因的同源重組效率在10-5左右,而依賴細菌自身的同源重組效率只有10-6左右,這對轉化效率提出了更高的要求,故一般在進行同源重組這一關鍵步驟時,研究者們大多使用電轉化(electroporation)方式或是接合轉移(conjugation)方式來實現轉化。近兩年來,國內外數十篇關于假單胞菌基因敲除的報道中,在同源重組這一關鍵步驟中使用的轉化方法如圖5所示。
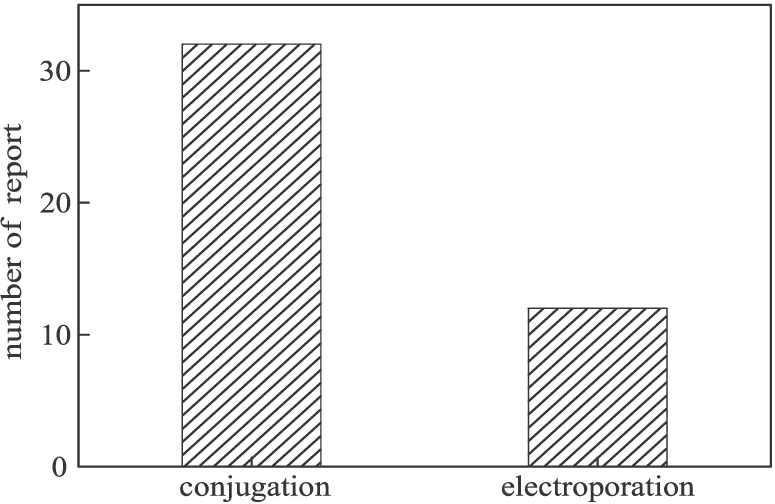
圖5 同源重組關鍵步驟轉化方式的報道數量
從圖5可以看出,在同源重組關鍵步驟中,接合轉移方式被更多的研究者所采用,供體菌大多使用E.coliS17-1λ-pir與E.coliWM3064,占所有供體菌的40%左右,且這2株菌都可以表達π蛋白,相比于E.coliS17-1λ-pir,E.coliWM3064是一株2,6-二氨基庚二酸(2,6-DAP)營養缺陷型菌株,在篩選時更為有利。相比于電轉化,接合轉移不需要制備特定的感受態,也不需要特殊的儀器,更容易擴大菌體量,這也許是更多研究者采用接合轉移方式的原因所在。
3.2 基因敲除方法的選擇
若將假單胞菌基因敲除方法分為非自身同源重組的基因敲除和依賴自身同源重組的基因敲除,那么,對國內外數十篇關于假單胞菌基因敲除方法的分類如圖6所示。
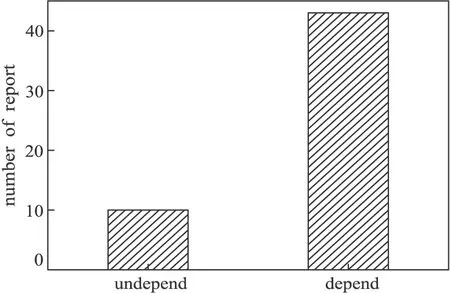
圖6 基因敲除方法的報道數量
從圖6可以看出,常規的非自身同源重組基因敲除方法遠遠少于依賴自身同源重組基因敲除方法。雖然從理論上看,非自身同源重組基因敲除的重組效率與重組子正確概率都較高,但使用該方法的研究者并不多,這可能是由于非自身同源重組基因敲除需要制作至少2次感受態細胞,對載體質粒的構建也更復雜,實驗流程更長;更重要的可能是,由于假單胞菌與E.coli菌種之間的特異性和假單胞菌屬內不同種之間的特異性,使得exo、bet、gam基因的表達及蛋白功能等都會受到一定的影響,從而進一步降低同源重組的效率。
3.3 同源臂長度的選擇
在基因敲除過程中,同源重組效率不僅取決于轉化效率,其同源臂長度也起著十分關鍵的作用。在國內外數十篇關于假單胞菌基因敲除的報道中,其同源臂長度的分類如圖7所示。
從圖7可以看出,研究者更多地選擇較長同源臂,這也從另一個側面證實了同源臂長度在基因敲除過程中起到了十分關鍵的作用。在所有統計的論文中,同源臂最長的達到約4 000 bp[22],最短的僅160 bp[11]。
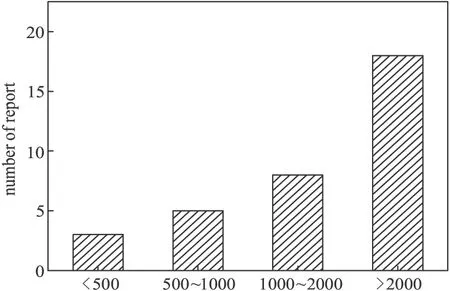
圖7 同源臂長度的報道數量
4 結語
在生物技術日益發展的今天,基因敲除技術也逐漸變得簡單易行,而假單胞菌作為一種分布廣泛的細菌,在環境修復、生物防治、生物轉化等領域有著十分重要的作用[3]。通過大量的假單胞菌基因敲除技術成功案例的比較,建議使用依賴自身同源重組基因敲除方法,根據實驗目的選擇一輪同源重組或兩輪同源重組進行基因敲除,同源臂長度選擇1 000~2 000 bp為宜,并采用接合轉移方式進行轉化。
[1] 吳乃虎.基因工程原理[M].北京:科學出版社,1998:314.
[2] 布坎南R E,吉本斯N E.伯杰細菌鑒定手冊[M].北京:科學出版社,1984:287.
[3] 楊復光,魏云林.假單胞菌研究現狀及應用前景[J].生物技術通報,2011(1):37-39.
[4] MURPHY K C.Use of bacteriophage lambda recombination functions to promote gene replacement inEscherichiacoli[J].Journal of Bacteriology,1998,180(8):2063-2071.
[5] 趙峰,張穎,李慧,等.3種假單胞菌CaCl2法感受態細胞制備及轉化條件[J].應用生態學報,2013,24(3):788-794.
[6] POTEETE A R.What makes the bacteriophage lambda Red system useful for genetic engineering:molecular mechanism and biological function[J].FEMS Microbiology Letters,2001,201(1):9-14.
[7] TAKAHASHI N,KOBAYASHI I.Evidence for the double-strand break repair model of bacteriophage lambda recombination[J].Proceedings of the National Academy of Sciences,1990,87(7):2790-2794.
[8] ELLIS H M,YU D G,DITIZIO T,et al.High efficiency mutagenesis,repair,and engineering of chromosomal DNA using single-stranded oligonucleotides[J].Proceedings of the National Academy of Sciences,2001,98(12):6742-6746.
[9] MURPHY K C.Lambda gam protein inhibits the helicase and chi-stimulated recombination activities ofEscherichiacoliRecBCD enzyme[J].Journal of Bacteriology,1991,173(18):5808-5821.
[10] WARMING S,COSTANTINO N,COURT D L,et al.Simple and highly efficient BAC recombineering using gaIK selection[J].Nucleic Acids Research,2005,33(4):e36.
[11] 余華,熊浚智,何曉梅,等.采用Red重組系統敲除銅綠假單胞菌彈性蛋白酶基因[J].中國人獸共患病學報,2013,29(2):129-132.
[12] 楊運文,蔣伏歡,宋杰,等.重組工程法敲除惡臭假單胞菌KT2440的染色體基因[J].南京師大學報(自然科學版),2011,34(4):96-101.
[13] LUO X,YANG Y W,LING W,et al.PseudomonasputidaKT2440 markerless gene deletion using a combination ofλRed recombineering and Cre/loxPsite-specific recombination[J].FEMS Microbiology Letters,2016,363(4):fnw014.
[14] WINDGASSEN M,URBAN A,JAEGER K E.Rapid gene inactivation inPseudomonasaeruginosa[J].FEMS Microbiology Letters,2000,193(2):201-205.
[15] MERLIN C,MCATEER S,MASTERS M.Tools for characterization ofEscherichiacoligenes of unknown function[J].Journal of Bacteriology,2002,184(16):4573-4581.
[16] 韓海紅,汪俊卿,王騰飛,等.一種基于單交換原理的地衣芽孢桿菌基因敲除方法及應用[J].中國生物工程雜志,2016,36(11):63-69.
[17] TANG H Z,YAO Y X,WANG L J.Genomic analysis ofPseudomonasputida:genes in a genome island are crucial for nicotine degradation[J].Scientific Reports,2012,2:377.
[18] 張加勤,饒慧華,徐巧麗,等.銅綠假單胞菌clpP基因缺陷株的構建[J].中國人獸共患病學報,2015,31(7):627-630.
[19] WANG Y,ZHANG C,GONG T,et al.An upp-based markerless gene replacement method for genome reduction and metabolic pathway engineering inPseudomonasmendocinaNK-01 andPseudomonasputidaKT2440[J].Journal of Microbiology Methods,2015,113:27-33.
[20] LIU K Q,HU H B,WANG W,et al.Genetic engineering ofPseudomonaschlororaphisGP72 for the enhanced production of 2-hydroxyphenazine[J].Microbiology Cell Factories,2016,15:131.
[21] CUTHBERTSON L,MAINPRIZE I L,NAISMITH J H,et al.Pivotal roles of the outer membrane polysaccharide export and polysaccharide copolymerase protein families in export of extracellular polysaccharides in gram-negative bacteria[J].Microbiology and Molecular Biology Reviews,2009,73(1):155-177.
[22] ZHAO J R,YU X,ZHU M,et al.Structural and molecular mechanism of CdpR involved in quorum-sensing and bacterial virulence inPseudomonasaeruginosa[J].PLoS Biology,2016,14(4):e1002449.
Research Progress of Gene Knockout inPseudomonas
XIONG Lie,QIAN Shu-lan,ZHU Cheng-yun,LI Jun,ZHONG Wei-hong*
(CollegeofBiologicalEngineering,ZhejiangUniversityofTechnology,Hangzhou310032,China)
Geneknockoutisaverypopulargeneticengineeringtechnologyinrecentyears.Pseudomonasisacommonbacterium,whichisappliedverywidely.Therefore,geneknockoutinPseudomonasisverysignificant.WereviewthesuccessfulcaseofgeneknockoutinPseudomonas,andcomparetwokindsofgeneknockoutsystemsinthefollowingaspects:transformationmethodofkeystepinhomologousrecombination,choiceofgeneknockoutmethod,andchoiceofthelengthofhomologousarm,etc.
Pseudomonas;geneknockout;homologousrecombination
國家自然科學基金項目(31670115)
2017-03-23
熊烈(1992-),男,浙江桐鄉人,碩士研究生,研究方向:生物化學與分子生物學,E-mail:357534323@qq.com;通訊作者:鐘衛鴻,教授,博士生導師,E-mail:whzhong@zjut.edu.cn。
10.3969/j.issn.1672-5425.2017.08.002
Q819
A
1672-5425(2017)08-0005-05
熊烈,錢淑嵐,朱成云,等.假單胞菌基因敲除方法研究進展[J].化學與生物工程,2017,34(8):5-9.

