超表達蘋果細胞分裂素響應基因MdCRF6影響花青苷積累和鹽脅迫抗性
安建平,宋來慶,趙玲玲,由春香,王小非,郝玉金
?
超表達蘋果細胞分裂素響應基因影響花青苷積累和鹽脅迫抗性
安建平1,宋來慶2,趙玲玲2,由春香1,王小非1,郝玉金1
(1山東農業大學園藝科學與工程學院/作物生物學國家重點實驗室,山東泰安 271018;2煙臺市農業科學研究院,山東煙臺 265599)
【目的】克隆蘋果細胞分裂素響應因子基因(cytokinin response factor 6),鑒定其在調節花青苷積累和鹽脅迫抗性中的作用,揭示的功能,為研究細胞分裂素信號途徑和果樹生長發育調控提供理論依據。【方法】以‘嘎啦’蘋果(‘Gala’)為研究材料,利用同源序列比對和PCR技術,分離細胞分裂素響應基因。使用MEGA 5.0軟件構建蘋果MdCRF6與擬南芥CRFs間系統進化樹;通過SMART軟件和DNAMAN軟件分析MdCRF6蛋白的保守結構域。利用實時熒光定量PCR方法檢測該基因對細胞分裂素和鹽脅迫的響應。通過電泳遷移率試驗(EMSA),驗證MdCRF6原核表達蛋白對DRE作用元件的綁定。構建植物超表達載體,并通過農桿菌介導的遺傳轉化獲得轉蘋果愈傷組織。比較野生型和轉基因蘋果愈傷組織在花青苷積累和鹽抗性方面的差異,結合基因表達分析,初步鑒定在調節花青苷積累和鹽脅迫方面的生物學功能。【結果】分離得到了蘋果細胞分裂素響應因子基因(基因序列號:MDP0000783818),該基因開放閱讀框(ORF)為1 047 bp,編碼含有348個氨基酸的蛋白。進化樹分析和氨基酸序列比對結果表明,蘋果MdCRF6蛋白在N端包含保守的CRF結構域,在C端包含保守的AP2/ERF結構域,并且與擬南芥AtCRF6同源性最高。基因表達分析顯示該基因具有細胞分裂素和鹽脅迫響應,分別在10 μmol·L-1BA和100 mmol·L-1NaCl處理3 h和6 h時表達量最高。EMSA試驗結果驗證MdCRF6原核表達蛋白能夠綁定DRE序列。在蘋果愈傷組織中超表達,發現轉基因蘋果愈傷組織花青苷積累受到抑制,同時蘋果愈傷組織的抗鹽性降低。基因表達分析顯示,顯著抑制花青苷合成基因和鹽響應相關基因的表達。【結論】蘋果MdCRF6與擬南芥AtCRF6具有高度的同源性,其參與植物對細胞分裂素和鹽脅迫的響應。在蘋果愈傷組織中超量表達抑制其花青苷積累,降低植物抗鹽性。推測蘋果可能通過結合花青苷合成基因以及抗鹽相關基因的啟動子,抑制基因的表達,從而負調節花青苷積累和抗鹽性。
蘋果;;花青苷;鹽脅迫
0 引言
【研究意義】蘋果()作為一種世界性的水果,具有營養豐富,口感佳以及產量高等特點[1]。蘋果的栽培和生長受到多種植物激素的調控。其中,細胞分裂素在調節植物生長發育過程中發揮重要作用[2-3]。CRFs(cytokinin response factors)屬于細胞分裂素響應因子,它們在響應細胞分裂素信號,調節葉片發育以及抗逆過程中都發揮著關鍵作用[4-5]。因此,明確細胞分裂素響應因子的功能對于研究細胞分裂素信號途徑和調節果樹生長發育具有重要意義。【前人研究進展】細胞分裂素(cytokinin)是植物生長發育所必需的激素之一,在促進植物細胞分裂過程中發揮重要作用[6]。未完全純化的細胞分裂物質最早由Miller在1961年從玉米中分離。隨后,Letham在1963年從未成熟玉米種子中分離并純化出天然的細胞分裂素-玉米素(ZR)。如今,30多種具有活性的天然細胞分裂素在不同植物中被陸續發現[7]。細胞分裂素在植物中存在著廣泛的生物學效應,如誘導芽的分化[8],促進果實和種子發育[9],延緩植物衰老[10],調控非生物脅迫[11],影響花青苷積累[12-13]等。在蘋果生產中應用外源植物細胞分裂素可以影響植株成花、坐果和果實發育[14]。此外,在果實膨大期對葉片噴施細胞分裂素可以提高葉片和果實的抗氧化活性,改善果品品質[15-16]。目前,對細胞分裂素的信號響應和轉導機制已有了較清晰的認識。研究發現,組氨酸激酶AHKs作為膜受體,能夠感受細胞分裂素信號;而組氨酸轉移磷酸化蛋白AHPs,通過磷酸化反應,可以將信號傳導至細胞核中,進而激活核內的信號響應因子[17-18]。CRFs被證實是一類重要的細胞分裂素響應因子[19-20]。通過對近百種植物的CRFs氨基酸序列進行比對分析,發現CRFs蛋白的N端都含有保守的CRF結構域,在C端都含有保守的AP2/ERF結構域[20]。作為典型的AP2/ERF轉錄因子,CRFs蛋白能夠結合到下游靶基因的GCC(AGCCGCC)或者DRE(〔A/G〕CCGAC)序列,進而調節基因的表達[21]。研究發現擬南芥CRF家族基因參與多種脅迫過程。受冷脅迫誘導并且參與抵抗冷脅迫[22]。在擬南芥中超表達顯著提高植株抗病性[23]。響應多種非生物脅迫,并且抑制葉片衰老[24]。受到低磷誘導[25]。此外,Shi等[26]對番茄CRF家族進行了分析,發現核定位的在番茄植物中組成型表達,并且受到多種激素和鹽脅迫響應。楊昌[27]也對甘藍型油菜CRF家族基因進行了初步分析,發現在調節甘藍型油菜體內磷穩態方面發揮關鍵作用。【本研究切入點】雖然目前關于細胞分裂素響應基因已有較多研究,但是主要集中在擬南芥、番茄等模式植物。在蘋果等多年生木本植物中未見報道。【擬解決的關鍵問題】在蘋果中克隆細胞分裂素響應因子基因,對比分析其與擬南芥AtCRF6的同源性。檢測其對細胞分裂素和鹽的響應以及作為轉錄因子對啟動子DRE序列的綁定,進而明確其與擬南芥AtCRF6的功能保守性。通過轉基因分析初步揭示在調節花青苷積累和鹽脅迫過程中的重要作用。
1 材料與方法
試驗于2016—2017年在山東農業大學園藝科學與工程學院果樹分子生物技術實驗室進行。
1.1 試驗材料
試驗所用到的植物材料有‘嘎啦’(‘Gala’)蘋果幼苗、‘王林’(‘Orin’)蘋果愈傷組織。對‘嘎啦’蘋果幼苗分別用10 μmol?L-1細胞分裂素(N6-benzyladenine,BA)或100 mmol?L-1NaCl溶液澆灌處理,間隔時間段取樣,液氮速凍后保存備用。
‘王林’蘋果愈傷組織用來進行遺傳轉化。蘋果愈傷組織放置在繼代培養基(MS培養基+1.5 mg·L-12,4-D+0.5 mg·L-16-BA)室溫(24℃)、暗處培養。并且每隔15 d更新繼代一次。
1.2 基因克隆與同源性分析
根據在蘋果基因組數據庫中檢索到的序列設計引物(表1),以‘嘎啦’幼苗的cDNA為模板進行PCR擴增。PCR反應程序為:94℃預變性5 min;94℃變性30 s,56℃退火30 s,72℃延伸1 min,32個循環;72℃后延伸5 min。PCR產物用1%瓊脂糖凝膠電泳并回收目的條帶,連接到克隆載體pMD18-T進行測序。
從擬南芥數據庫(http://www.arabidopsis.org/)中檢索并下載擬南芥細胞分裂素響應基因(—)的核酸和蛋白序列。通過MEGA 5.0軟件構建系統進化樹。使用DNAMAN軟件進行序列比對。使用SMART軟件預測MdCRF6的蛋白結構。
1.3 RNA的提取與實時熒光定量PCR分析
使用天根生化科技有限公司的Plus植物總RNA提取試劑盒(DP437)提取蘋果幼苗及愈傷組織的RNA。以提取的RNA為模板,按照Clontech SMARTTMLibrary試劑盒說明書進行反轉錄,合成cDNA第一鏈。
以(GenBank accession number:CN938024)為內參基因,使用Ultra SYBR Mixture試劑盒(康為世紀)進行實時熒光定量PCR分析。熒光定量PCR使用的儀器為BIO-RAD IQ5,所有PCR都設3個循環。PCR反應體系:2×UltraSYBR Mixture 10.0 μL,cDNA 1.0 μL,加去離子水至20 μl。PCR反應程序:94℃預變性10 min,94℃變性15 s,56℃退火15 s,65℃延伸15 s,40個循環,每次循環第2步進行熒光采集。最后采用2-△△CT法進行定量數據分析。所用的定量引物見表1。

表1 本研究中所用引物
1.4 原核表達及電泳遷移率試驗(EMSA)
構建原核表達載體pGEX-MdCRF6,將連接產物轉化大腸桿菌BL21中。加入0.5 mmol·L-1IPTG 6 h后收集菌體,超聲波破碎后進行SDS-PAGE檢測。誘導獲得的活性蛋白GST和GST-MdCRF6用來進行后續試驗。
生物素標記的結合探針-GCAAGATTTAACCGA CCCAAACCGAT-和突變探針-GCAAGATTTACCGG AGCCAAACCGAT-由生工生物工程有限公司(上海)合成。使用Lightshift Chemiliminescent EMSA 試劑盒(Thermo,USA)進行電泳遷移率試驗。EMSA反應體系:1×binding buffer(2.5%甘油,50 mmol?L-1KCl,5 mmol?L-1MgCl3,10 mmol?L-1EDTA)2 μL,GST蛋白或GST-MdCRF6融合蛋白10 μL,探針1 μL,室溫孵育25 min。未標記的探針作為競爭探針。具體方法參照An等[28]。
1.5 超表達載體構建及蘋果愈傷組織轉化和鑒定
利用引物中引入的H I和I酶切位點,將從pMD18-T載體切除回收。并對pCAMBIA1300進行同樣酶切,將兩者在16℃連接,轉化大腸桿菌,鑒定陽性單菌落。成功構建-pCAMBIA-1300超表達載體。
將-pCAMBIA-1300轉化農桿菌LBA4404。取10 d左右生長狀態良好的蘋果愈傷組織與轉化的農桿菌室溫孵育20 min。將愈傷組織紗網過濾并吸干表面的菌液,置于繼代培養基上培養1—2 d。隨后,將蘋果愈傷組織轉移至篩選培養基(繼代培養基+100 mg·L-1潮霉素+500 mg·L-1頭孢霉素)。PCR檢測得到的陽性轉基因愈傷組織,在篩選培養基上繼代三代以上,進行后續試驗。
1.6 蘋果愈傷組織著色試驗
選擇生長狀態一致的野生型(WT)和轉基因(-L1和-L2)蘋果愈傷組織進行著色試驗。將愈傷組織放置到強光(光子通量密度約為100 μmol·s-1·m-2)、低溫(13℃)培養箱內進行培養,觀察愈傷著色情況。
使用乙醇-HCl法提取蘋果愈傷組織的花青苷。使用花青苷提取液(95%無水乙醇+1.5 mol?L-1HCl)提取蘋果愈傷組織內的花青苷。提取過程在暗處進行。使用分光光度計檢測吸光度并計算花青苷含量。計算公式:OD=(A530-A620)-0.1×(A650-A620)。
1.7 蘋果愈傷組織鹽脅迫試驗
選擇生長狀態一致的野生型(WT)和轉基因(-L1和-L2)蘋果愈傷組織進行鹽脅迫試驗。將大小一致的愈傷放置到含有不同NaCl濃度的繼代培養基上。常溫、暗處培養15 d,觀察并稱量愈傷組織的質量。
1.8 統計學分析
使用R(3.0.2)軟件進行統計學分析。所有結果都是基于3個平行試驗的平均值。
2 結果
2.1 蘋果的克隆及同源性分析
以‘嘎啦’幼苗的cDNA為模板,MdCRF6-F/R為引物進行PCR擴增,獲得一條大約1 000 bp的條帶(圖1)。對克隆得到的片段測序分析,結果表明,該基因片段的開放閱讀框(ORF)長度為1 047 bp,編碼含有348個氨基酸的蛋白質,命名為(MDP0000783818)。

圖1 蘋果MdCRF6的RT-PCR擴增產物電泳
將蘋果MdCRF6氨基酸序列與擬南芥中12個細胞分裂素響應因子基因(—)的氨基酸序列進行比對并構建進化樹(圖2)。進化樹分析結果表明,蘋果MdCRF6與擬南芥AtCRF6親緣關系最近,同源性最高。
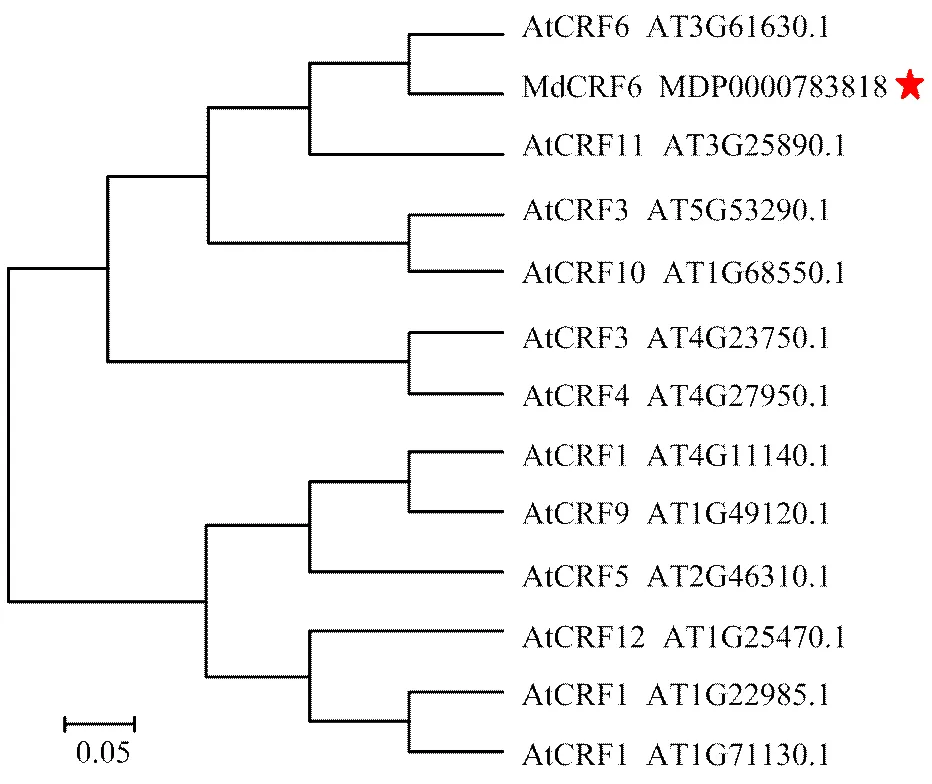
At:擬南芥Arabidopsis thaliana;Md:蘋果Malus domestica
對蘋果MdCRF6的氨基酸序列進行分析(圖3)。結果顯示,僅包含一個外顯子,無內含子。MdCRF6蛋白在N端包含一個保守的CRF結構域,在C端包含一個保守的AP2/ERF結構域。
2.2 蘋果的表達分析
對‘嘎啦’蘋果幼苗分別用10 μmol?L-1細胞分裂素(N6-benzyladenine,BA)或100 mmol?L-1NaCl溶液澆灌處理,間隔時間段取樣(整株)。實時熒光定量PCR分析對細胞分裂素和NaCl的響應。結果表明,在細胞分裂(10 μmol?L-1BA)和NaCl(100 mmol?L-1)處理下,表達量明顯上調(圖4)。

圖3 蘋果MdCRF6蛋白功能域分析
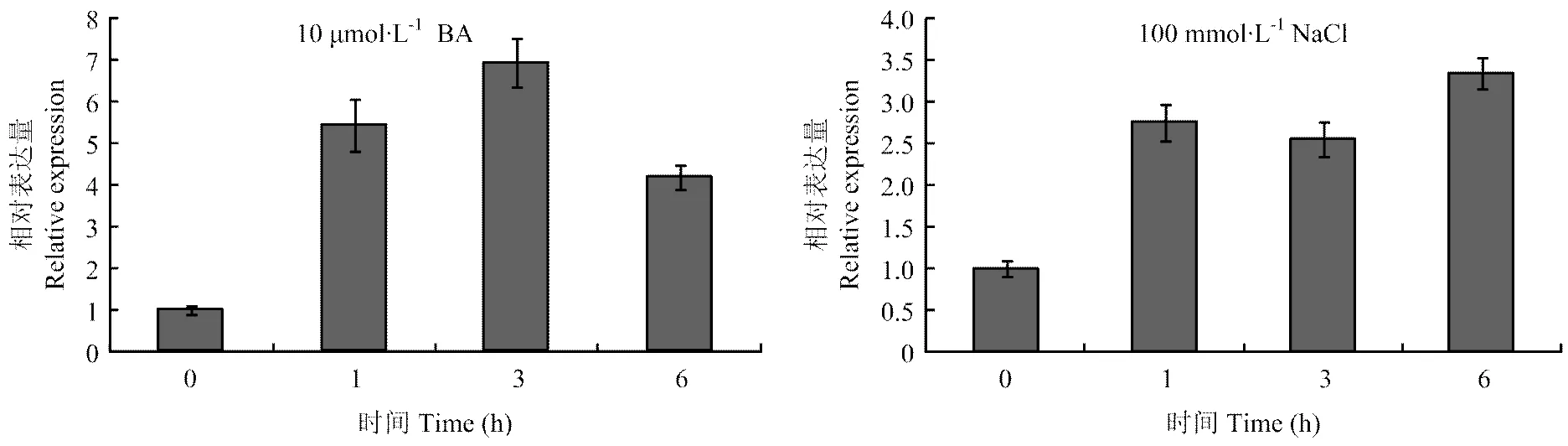
圖4 MdCRF6在細胞分裂素和鹽脅迫響應中的表達分析
2.3 MdCRF6蛋白綁定DRE序列
通過體外誘導的方式獲得GST-MdCRF6的融合蛋白。生物素標記擬南芥ARR6啟動子區域含有DRE(ACCGAC)序列的核苷酸序列。EMSA試驗結果顯示,GST-MdCRF6融合蛋白能夠結合到DRE序列。增加未標記的競爭探針,結合條帶變弱。將DRE(ACC GAC)序列突變為-CCGGAG-,結合條帶消失(圖5)。
2.4 載體構建與轉基因蘋果愈傷組織鑒定
構建超表達載體-pCAMBIA1300(圖6),轉化農桿菌LBA4404,通過農桿菌介導的遺傳轉化侵染蘋果愈傷組織。實時熒光定量PCR檢測轉基因株系表達量(圖7)。獲得L1和L2兩個轉基因株系。
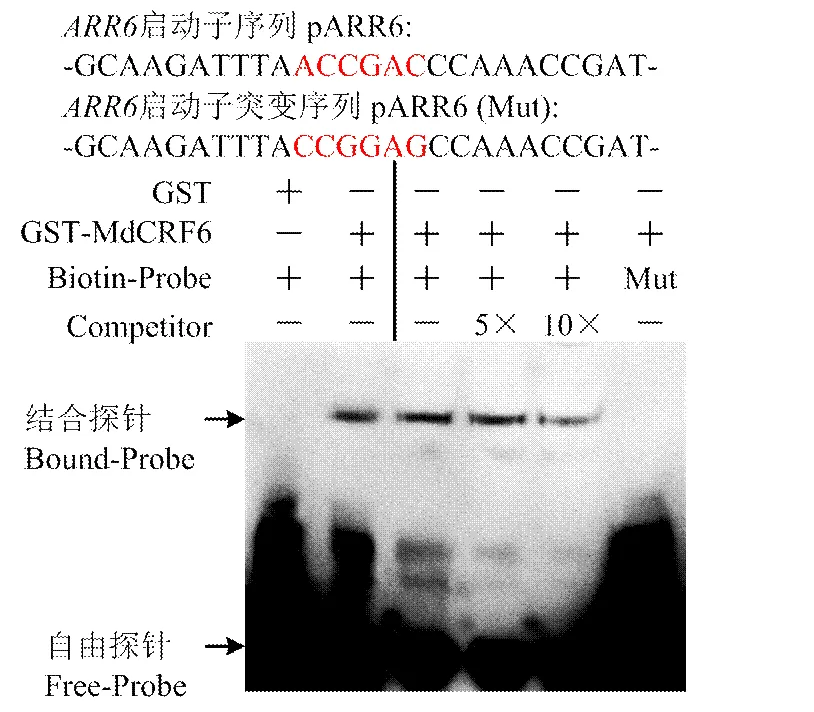
圖5 MdCRF6綁定DRE序列
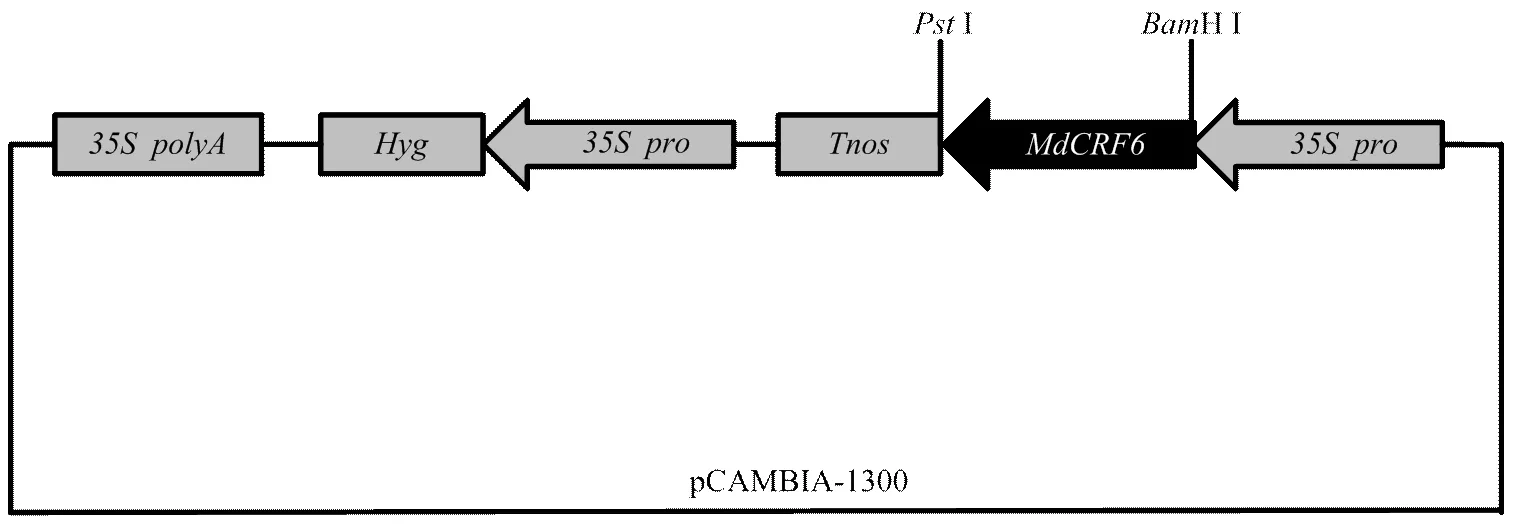
圖6 MdCRF6-pCAMBIA-1300結構示意圖
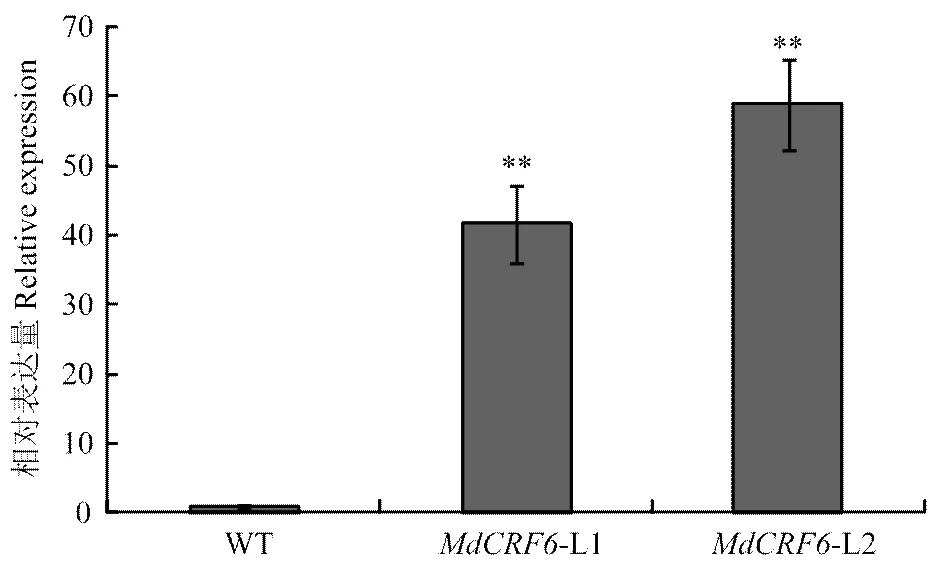
圖7 定量PCR分析MdCRF6在轉基因蘋果愈傷組織L1和L2中的表達水平
2.5 超表達抑制花青苷積累
對獲得的轉基因蘋果愈傷組織進行強光、低溫處理,10 d后,野生型蘋果愈傷組織(WT)積累較多花青苷,而轉基因蘋果愈傷組織(- L1和-L2)積累的花青苷含量很少(圖8-a、b)。
實時熒光定量PCR檢測花青苷合成基因的表達。結果顯示,超表達明顯抑制花青苷合成基因的表達(圖8-c)。
2.6 超表達降低蘋果愈傷的抗鹽性
對獲得的轉基因蘋果愈傷組織進行不同鹽濃度鹽處理,15 d 后,相比于野生型對照,轉基因蘋果愈傷組織表現出對鹽脅迫更敏感的表型。鹽處理后,轉基因蘋果愈傷組織的鮮重明顯低于野生型(圖9-a、b)。
實時熒光定量PCR檢測鹽脅迫響應相關基因的表達。結果顯示,超表達明顯抑制,和基因的表達(圖9-c)。

a:野生型(WT)和轉基因(MdCRF6-L1和MdCRF6-L2)蘋果愈傷組織花青苷積累分析 Phenotypes of wild-type (WT) and transgenic (MdCRF6-L1 and MdCRF6-L2) apple calli on the anthocyanins accumulation;b:檢測花青苷含量 Detection of the anthocyanins contents;c:定量PCR檢測花青苷合成基因的表達 qRT-PCR analysis of the expression level of anthocyanins biosynthetic genes

a:野生型(WT)和轉基因(MdCRF6-L1和MdCRF6-L2)蘋果愈傷組織鹽脅迫情況分析 Phenotypes of wild-type (WT) and transgenic (MdCRF6-L1 and MdCRF6-L2) apple calli on the salt stress tolerance;b:檢測愈傷鮮重 Detection of the fresh weight;c:定量PCR檢測鹽脅迫響應相關基因的表達 qRT-PCR analysis of the expression level of salt stress related genes
3 討論
細胞分裂素在植物生長發育過程中發揮重要作用。在果樹生產中,研究細胞分裂素對花青苷積累和抗鹽性調控的機理對于改善果實品質和提高蘋果產量意義重大。前期研究表明,一定濃度的細胞分裂素可以促進花青苷的積累[12-13]。此外,在葉片噴施細胞分裂素可以顯著提高植株的抗鹽能力[7]。到目前為止,雖然對細胞分裂素調控的生長發育過程研究較多,但是其內在的調控機制仍然不清楚。
細胞分裂素響應因子CRFs作為細胞分裂素信號傳導途徑中的關鍵調控因子,在調節植物衰老、響應非生物脅迫以及抗病性等方面具有重要作用。其中,擬南芥作為轉錄抑制因子在響應細胞分裂素和外界脅迫,抑制葉片衰老過程中發揮關鍵作用[24]。最近研究表明,擬南芥在氧化脅迫條件下扮演負調控者的角色,它能夠通過直接結合的啟動子,抑制細胞分裂素相關基因的表達[22]。此外,番茄被初步鑒定在響應鹽脅迫和多種植物激素過程中發揮重要作用[26]。據此,通過同源序列比對和RT-PCR技術得到蘋果細胞分裂素響應因子基因,蘋果MdCRF6與擬南芥AtCRF6同源性最高,并且包含保守的CRF結構域和AP2/ERF結構域,在擬南芥AtCRF6[20]和番茄SlCRF6[26]的研究過程中也發現了相類似的結構域。基因表達分析發現,響應細胞分裂素和鹽脅迫,由此推測或許在鹽脅迫響應過程中具有重要作用。作為典型的轉錄因子,本研究結果也驗證MdCRF6能夠結合到DRE序列。以上結果表明,蘋果MdCRF6和擬南芥AtCRF6在結構和功能上都具有相似性。這是在蘋果中首次克隆得到細胞分裂素響應因子。
為了進一步鑒定蘋果MdCRF6的生物學功能,獲得了轉基因蘋果愈傷組織。前人研究表明,細胞分裂素在調節花青苷積累方面發揮重要作用[29]。本研究結果表明在蘋果愈傷組織中超表達顯著抑制花青苷的積累。推測響應細胞分裂素信號,作為轉錄抑制因子負調控花青苷合成基因的表達,進而抑制花青苷積累。同時,發現能夠負調節植物的抗鹽性,但具體的作用機制還有待深入研究。后期將進一步通過基因編輯(CRISPR/ Cas9)等技術,進一步驗證該基因的生物學功能,為深入研究細胞分裂素信號途徑和調節果樹生長發育提供理論基礎。
4 結論
通過基因克隆獲得蘋果,該基因編碼348個氨基酸。氨基酸序列分析表明蘋果MdCRF6包含保守的CRF結構域和AP2/ERF結構域。定量表達分析結果顯示受細胞分裂素和鹽脅迫誘導。EMSA結果證實MdCRF6原核表達蛋白能夠結合DRE作用元件。轉基因蘋果愈傷組織表現出抑制花青苷積累和對鹽脅迫敏感的表型,表明在調節花青苷積累和響應植物鹽脅迫過程中可能發揮著重要的調控作用。
References
[1] 翟衡, 趙政陽, 王志強, 束懷瑞. 世界蘋果產業發展趨勢分析. 果樹學報, 2005, 22(1): 44-50.
Zhai H, Zhao Z Y, Wang Z Q, Shu H R. Analysis of the development trend of the world apple industry., 2005, 22(1): 44-50. (in Chinese)
[2] 閆國華, 甘立軍, 孫瑞紅, 張利華, 周燮. 赤霉素和細胞分裂素調控蘋果果實早期生長發育機理的研究. 園藝學報, 2000, 27(1): 11-16.
Yan G H, Gan L J, Sun R H, Zhang L H, Zhou X. The study of mechanism about gibberellin and cytokinin regulation apple fruit early growth., 2000, 27(1): 11-16. (in Chinese)
[3] 鄒養軍, 王永熙. 內源激素對蘋果果實生長發育的調控作用研究進展. 陜西農業科學, 2002(10): 13-15.
ZOU Y J, WANG Y X. The readjustment of endogenous hormones on apple fruit growth and development., 2002(10): 13-15. (in Chinese)
[4] MOK W, MOK M C. Cytokinin metabolism and action., 2001, 52(1): 89-118.
[5] WERNER T, SCHMULLING T. Cytokinin action in plant development., 2009, 12(5), 527-538.
[6] HEYL A, WULFETANGE K, PILS B, NIELSEN N, ROMANOV G A, SCHMULLING T. Evolutionary proteomics identifies amino acids essential for ligand-binding of the cytokinin receptor CHASE domain., 2007, 7(1): 62.
[7] 王三根. 細胞分裂素在植物抗逆和延衰中的作用. 植物學通報, 2000, 17(2): 121-126.
WANG S G. Roles of cytokinin on stress-resistance and delaying senescence in plants., 2000, 17(2): 121-126. (in Chinese)
[8] Werner T, Motyka V, Strnad M, Schmülling T. Regulation of plant growth by cytokinin., 2001, 98(18): 10487-10492.
[9] 周蕾, 魏琦超, 高峰. 細胞分裂素在果實及種子發育中的作用. 植物生理學通訊, 2006, 42(3): 549-553.
ZHOU L, WEI Q C, GAO F. The effect of cytokinins on fruit and seed development., 2006, 42(3): 549-553. (in Chinese)
[10] 楊曉紅, 陳曉陽, 劉克鋒. 細胞分裂素對植物衰老的延緩作用. 熱帶亞熱帶植物學報, 2006, 14(3): 256-262.
YANG X H, CHEN X Y, LIU K F. The role of cytokinins in retarding of senescence in plants., 2006, 14(3): 256-262. (in Chinese)
[11] ZWACK P J, RASHOTTE A M. Interactions between cytokinin signalling and abiotic stress responses., 2015, 66(16): 4863-4871.
[12] JI X H, WANG Y T, ZHANG R, WU S J, AN M M, LI M, CHEN X S. Effect of auxin, cytokinin and nitrogen on anthocyanin biosynthesis in callus cultures of red-fleshed apple ()., 2015, 120: 325-337.
[13] SHI M Z, XIE D Y. Engineering of red cells ofand comparative genome-wide gene expression analysis of red cells versus wild-type cells., 2011, 233: 787-805.
[14] 藺經, 盛寶龍, 常有宏. 赤霉素和細胞分裂素類植物生長調節劑在蘋果生產中的應用. 北方果樹, 2000(1): 1-3.
LIN J, SHENG B L, CHANG Y H. The application of gibberellin and cell division plant growth regulator in apple production., 2000(1): 1-3. (in Chinese)
[15] 辛艷偉, 丁春剛. 不同濃度植物細胞分裂素對蘋果葉片衰老的影響. 山西農業科學, 2016, 44(4): 467-469, 490.
XIN Y W, DING C G. Effects of different concentrations plant cytokinin on senescence of apple leaves., 2016, 44(4): 467-469, 490. (in Chinese)
[16] 辛艷偉, 牛顏冰, 李曉瑞. 不同植物細胞分裂素對‘紅富士’蘋果果實抗氧化活性及品質的影響. 中國農學通報, 2016, 32(4): 83-86.
XIN Y W, NIU Y B, LI X R. Effects of different plant cytokinin on antioxidant activity and quality of ‘Fuji’ apple fruit., 2016, 32(4): 83-86. (in Chinese)
[17] FERREIRA F J, KIEBER J J. Cytokinin signaling., 2005, 8(5): 518-525.
[18] KANG J, LEE Y, SAKAKIBARA H, MARTINOIA E. Cytokinin transporters: GO and STOP in signaling., 2017, 6(22): 455-461.
[19] RASHOTTE A M, MASON M G, HUTCHISON C E, FERREIRA F J, SCHALLER G E, KIEBER J J. A subset ofAP2 transcription factors mediates cytokinin responses in concert with a two-component pathway., 2006, 103(29): 11081-11085.
[20] RASHOTTE A M, GOERTZEN L R. The CRF domain defines cytokinin response factor proteins in plants., 2010, 10(1): 74.
[21] WEIRAUCH M T, YANG A, ALBU M, COTE A G, MONTENEGRO- MONTERO A, DREWE P, NAJAFABADI H S, LAMBERT S A, MANN I, COOK K. Determination and inference of eukaryotic transcription factor sequence speci?city.,2014, 158: 1431-1443.
[22] ZWACK P J, DE CLERCQ I, HOWTON T C, HALLMARK H T, HURNY A, KESHISHIAN E A, RASHOTTE A M. Cytokinin response factor 6 represses cytokinin-associated genes during oxidative stress., 2016, 172(2): 1249-1258.
[23] LIANG Y S, ERMAWATI N, CHA J Y, JUNG M H, SUUDI M, KIM M G, SON D. Overexpression of an AP2/ERF-type transcription factor CRF5 confers pathogen resistance toplants., 2010, 53(2): 142-148.
[24] ZWACK P J, ROBINSON B R, RISLEY M G, RASHOTTE A M. Cytokinin response factor 6 negatively regulates leaf senescence and is induced in response to cytokinin and numerous abiotic stresses., 2013, 54(6): 971-981.
[25] RAMAIAH M, JAIN A, RAGHOTHAMA K G. Ethylene Response Factor070 regulates root development and phosphate starvation- mediated responses., 2014, 164(3): 1484-1498.
[26] SHI X, GUPTA S, RASHOTTE A M. Solanum lycopersicum cytokinin response factor (SlCRF) genes: Characterization of CRF domain-containing ERF genes in tomato., 2012, 63(2): 973-982.
[27] 楊昌. 甘藍型油菜CRF家族的特征分析及BnaCRF8s的克隆和功能初步研究[D]. 武漢: 華中農業大學, 2016.
Yang C. Analysis of CRF family genes, cloning and preliminary function research of BnaCRF8s in[D]. Wuhan: Huazhong Agricultural University, 2016. (in Chinese)
[28] AN J P, Li H H, Song L Q, Su L, Liu X, You C X, Hao Y J. The molecular cloning and functional characterization of MdMYC2, a bHLH transcription factor in apple., 2016, 108: 24-31.
[29] DEIKMAN J, HAMMER P E. Induction of anthocyanin accumulation by cytokinins in., 1995, 108(1): 47-57.
(責任編輯 趙伶俐)
Effects of Overexpression of Apple Cytokinin Response Factor Geneon Anthocyanins Accumulation and Salt Stress Tolerance
AN JianPing1, SONG LaiQing2, ZHAO LingLing2, YOU ChunXiang1, WANG XiaoFei1, HAO YuJin1
(1College of Horticulture Science and Engineering, Shandong Agricultural University/State Key Laboratory of Crop Biology, Tai’an 271018, Shandong;2)
【Objective】The objective of this study is to clone apple cytokinin response factor gene, to analyze its homology with, its expression of exposing to cytokinin and salt stress as well as its binding to DRE motif (ACCGAC), to identify its role in regulating anthocyanins accumulation and salt stress, and to provide a theoretical basis for studying cytokinin signaling pathway and regulating fruit tree growth and development. 【Method】gene was cloned by homology sequence alignment and PCR technique. The phylogenetic tree of MdCRF6 andCRFs was constructed using MEGA5.0. The conserved domains of MdCRF6 were analyzed using SMART software and DNAMAN software. Real-time fluorescent quantitative PCR (qRT-PCR) was performed to detect the gene expression ofexposing to cytokinin and salt stress. The electrophoretic mobility shift assay (EMSA) was conducted to verify whether MdCRF6 could bind to the DRE motif. A plant over-expression vector ofwas constructed and used to transform apple calli by-mediated method. The phenotypes of wild-type and transgenic apple calli on anthocyanins accumulation and salt stress tolerance were characterized to investigate the function of【Result】 A cytokinin response factor gene named(MDP0000783818) was cloned from‘Gala’Sequence analysis showed that its open reading frame (ORF) was 1 047 bp, which encoded 348 amino acids. The results of phylogenetic tree and amino acid sequence alignment indicated that MdCRF6 contained a CRF domain in its N-terminal side and an AP2/ERF domain in its C-terminal side. qRT-PCR analysis indicated thatwas responsive to cytokinin and salt stress, and the expression levels peaked at 3 h and 6 h exposing to 10 μmol?L-1BA and 100 mmol?L-1NaCl, respectively. EMSA assay showed that MdCRF6 could bind to the DRE motif. The-overexpressing apple calli exhibited reduced anthocyanins content and decreased salt stress tolerance. The gene expression analysis showed that overexpression ofsignificantly repressed the expression levels of anthocyanins biosynthetic genes and salt response related genes. 【Conclusion】The apple MdCRF6 exhibited high similarity to AtCRF6, and it was involved in the response to cytokinin and salt stress. Overexpression ofdown-regulated anthocyanins accumulation and salt stress tolerance by repressing the expression of anthocyanins biosynthetic genes and salt response related genes.
apple;; anthocyanins accumulation; salt stress
2017-04-10;接受日期:2017-06-15
國家自然科學基金(31601742)、教育部創新團隊支持計劃(IRT15R42)、山東省現代農業產業技術體系(SDAIT-06-03)
安建平,E-mail:1393427413@qq.com。通信作者王小非,E-mail:xfwang2004@163.com。通信作者郝玉金,E-mail:haoyujin@sdau.edu.cn

