微生物幾丁質酶的研究進展及應用現狀
龔福明,何彩梅,唐小艷,柳陳堅*
(1.德宏職業學院臨床醫學系,云南芒市678400;2.賀州學院化學與生物工程學院,廣西賀州542899;3.昆明理工大學生命科學與技術學院,云南昆明650500)
微生物幾丁質酶的研究進展及應用現狀
龔福明1,何彩梅2,唐小艷1,柳陳堅3*
(1.德宏職業學院臨床醫學系,云南芒市678400;2.賀州學院化學與生物工程學院,廣西賀州542899;3.昆明理工大學生命科學與技術學院,云南昆明650500)
幾丁質酶(chitinase)是一類可催化幾丁質水解為N-乙酰氨基葡萄糖寡聚體或單體的糖苷水解酶,廣泛存在于微生物(真菌、細菌、放線菌與病毒)及動植物中,因其特殊的生理功能而被廣泛應用于生物防治、醫學應用、廢棄物處理及環境保護等領域。文章綜述了微生物幾丁質酶的來源與分類、發酵條件、酶學性質及應用領域,以期為幾丁質酶的進一步開發應用提供理論指導。
幾丁質;微生物幾丁質酶;發酵條件;酶學性質;應用
幾丁質(chitin)也稱為甲殼質,是一種由N-乙酰-D-氨基葡萄糖以β-1,4-糖苷鍵連接而成的直鏈高分子生物多聚體,是含量僅次于纖維素的第二大天然多聚物[1]。相關報道表明,幾丁質是甲殼類動物、昆蟲、真菌及線蟲等病原生物體壁結構上的重要組成[2],對機體具有支持與保護作用。幾丁質在甲殼類動物外殼中的含量極高(可高達85%),當其與鈣鹽及蛋白質結合后會變成堅硬的外殼,用酸堿處理甲殼類動物外殼脫去鈣鹽和蛋白質后,加熱即可制備可溶性殼聚糖,因而也被俗稱為甲殼素。
幾丁質酶(chitinase)EC3.2.1.1 4是BENECKE U[3]在1905年研究幾丁質芽孢扦菌(Bacillus chitinovrous)分解幾丁質的過程中,首次分離發現的一類可催化幾丁質水解并將之徹底水解為N-乙酰氨基葡萄糖寡聚體或單體的糖苷水解酶,分屬于18和19兩個家族,而微生物幾丁質酶大多歸屬于18家族[4]。隨著研究深入與繼續,發現幾丁質酶除廣布于真菌、細菌及放線菌等微生物中外,還大量存在于昆蟲、甲殼動物、高等植物甚至病毒中[5]。相關研究表明,幾丁質酶是生物體內降解或利用幾丁質的關鍵,一方面幾丁質酶能通過水解病原真菌細胞壁,破壞害蟲體壁及殺蟲增效等機制發揮生物防治作用,另一方面幾丁質酶還能通過催化幾丁質水解,促進其自然界循環的作用,維持生態系統平衡[4-5]。又因幾丁質酶催化幾丁質水解后的N-乙酰氨基葡萄糖寡聚體或單體等產物的抗菌,調節機體免疫,抑制腫瘤細胞生長等特性,使幾丁質酶被大量用于環境保護、醫藥、農業、食品加工等領域并表現出巨大的市場潛力[6-7]。
正是基于巨大的市場潛力和應用價值,幾丁質酶制備及其研發并日益受人們重視。與其他幾丁質酶來源相比,微生物幾丁質酶具備生長周期短、易培養、可通過發酵法制備,操作性強,經濟效益良好等優勢[8],加之近年來微生物幾丁質酶的結構特性、產酶條件及基因克隆與表達等研究與日俱增,微生物幾丁質酶逐漸成為研究新熱點。本文對微生物幾丁質酶的來源與分類、發酵條件、酶學性質及應用領域等內容進行綜述,以期為微生物幾丁質酶的開發應用提供論指導與參考。
1 微生物幾丁質酶的來源
繼BENECKE U于1905年首次從幾丁質芽孢桿菌(Bacillus chitinovrous)中發現并分離微生物幾丁質酶后,各國學者陸續發現細菌、放線菌、真菌,甚至病毒等分屬46個屬近70個種的微生物均能分泌幾丁質酶(見表1)[4,9]。此外,海洋微生物也蘊藏著巨大的潛力,諸如珊瑚、嗜冷菌(Moritellamarina)、海洋鏈霉菌(Streptomycesolivaceus)FXJ7.023、白孢鏈霉菌(Streptomycesalbosporeus)及蜂房芽孢桿菌(Bacilluspluton)等海洋微生物都表現出極強的幾丁質酶分泌能力[10-12]。而芽孢桿菌屬(Bacillus sp.)中的蘇云金芽孢桿菌(Bacillus thuringiensis)、環狀芽孢桿菌(Bacilluscirculans)及枯草芽孢桿菌(Bacillussubtilis)等更是目前研究運用比較多的幾丁質酶來源微生物;堅信隨著研究深入,大量的微生物幾丁質酶將被運用到環境保護、醫藥、農業及食品加工等領域。

表1 常見幾丁質酶來源微生物Table 1 Microorganism s of sources of common chitinase
2 微生物幾丁質酶的發酵條件
幾丁質酶來源微生物類群很多,涵蓋了46個屬近70個種,菌種及菌株差異會導致發酵制備幾丁質酶的條件各不相同,但大多微生物幾丁質酶都是誘導酶,只在幾丁質或幾丁質衍生物等底物誘導下才合成可分泌到胞外的幾丁質酶[13]。此外,微生物發酵分泌幾丁質酶時易受碳氮源種類,溫度、pH值、金屬離子及有機溶劑等因素影響。相關研究證實,微生物法制備幾丁質酶的最適溫度一般在28~30℃,最適pH值介于5.0~9.0之間,底物濃度一般為1.5%~2.0%,單糖葡萄糖及N-乙酰氨基葡萄糖(N-acetyl-D-glucosamine,NAG)與阿洛氨菌素(allosam idin)等化合物對產酶有阻遏作用,金屬離子對幾丁質酶活性也有較大影響,但上述影響因素在作用時存在明顯菌株差異[13-14]。
國內外相關研究報道證實,不同菌株在發酵條件及抑制因素等方面也存在較大差異。郝之奎等[15]在慢生根瘤菌科芽生桿菌屬(Bradyrhizobiaceaeblastobacter)菌株SYBC-H2發酵分泌幾丁質酶的研究中證實,幾丁質是誘導幾丁質酶合成并分泌的關鍵,玉米漿與幾丁質的產酶交互作用較好,能有效提高酶活性(5.70 U/m L),而葡萄糖與幾丁質的交互作用不明顯,在一定程度上起抑制作用。RISHAD K S等[16]在短小芽孢桿菌(Bacilluspum ilus)MCB-7產幾丁質酶條件優化過程中證實,碳氮源種類、溫度、pH值、金屬離子及有機溶劑等因素均能影響該菌株的酶產量與活性,而幾丁質、蛋白胨及發酵液pH值是決定酶產量及活性的關鍵,經Box-Behnken試驗優化后,菌株B.pum ilus MCB-7的酶活達23.19 U/m L,比未優化前(3.36 U/m L)提高近7倍。另外,誘變育種也是提高幾丁質酶產量及活性的有效途徑,胡基華等[17]通過NaNO2、紫外和復合誘變等方法對粘質沙雷氏菌(Serratiamarcescens)S68進行誘變育種并分離到高活性突變株CM 5,與原始菌株相比其幾丁質酶活性提高了4.3倍。相關研究表明[18,26],Na+、K+、Mg2+、Ca2+、Mn2+等金屬離子對幾丁質酶活性有促進作用,而Hg2+、Ag2+、Cu2+、Fe2+、Zn2+、Co2+及Pb2+等金屬離子對酶活卻起到抑制作用,但存在菌株差異。Mg2+和Ca2+能有效提升芽孢桿菌屬(Bacillus sp.)菌株R2由來幾丁質酶活性,而能有效提高氣單胞菌屬(Aeromonas sp.)由來幾丁質酶活性的金屬離子則是Mn2+和Mg2+,重金屬離子Hg2+、Ag2+及Pb2+等對上述菌株由來幾丁質酶活性的抑制作用極強。此外,相關報道表明菌種及菌株差異也會影響幾丁質酶活性,SUZUKIS等[19]在用幾丁質酶18家族抑制劑阿洛氨菌素對6株鏈霉菌屬(Streptomyces sp.)細菌的產酶抑制研究中發現,大多18家族的微生物幾丁質酶會被阿洛氨菌素抑制,但鏈霉菌屬的實驗菌株因含chi65基因而未被抑制。
3 微生物幾丁質酶的分離純化
為開發微生物幾丁質酶潛在的市場價值,實現標準化及規模化生產,探索快速而有效的制備與分離純化體系就成了微生物幾丁質酶開發運用的關鍵。目前,微生物幾丁質酶常用的分離純化方法有超濾、離心、鹽析、層析凝膠過濾及電泳等方法,為盡量降低酶活損失,提高純度及回收率,在分離純化時往往會綜合考慮運用上述分離純化方法。即首先用鹽析等方法對粗酶液進行濃縮,然后再用DEAE纖維素層析及葡聚糖凝膠(Sephadex G-100柱)層析等方法純化粗酶,最后經十二烷基硫酸鈉(sodium dodecylsulfate,SDS)-聚丙烯酰胺凝膠電泳(polyacrylamidegelelectrophoresis,PAGE)分離即可得到純度高且活性較強的幾丁質酶。KARTHIK N等[20]首先用60%(NH4)2SO4沉淀法濃縮幾丁質酶粗酶液,接著依次用DEAE陰離子交換層析及高分子凝膠滲透層析法純化粗酶,用SDS-PAGE分離初步純化的幾丁質酶,然后再用上述兩種層析法進一步純化,并最終通過幾丁質酶譜法與等電點測定相結合的體系,分離到鏈霉菌(Streptomyces sp.)由來且具有抗真菌活性的酸性幾丁質酶。后續研究表明,該酶分子質量為40 ku,在溫度為50℃時,該酶在pH值2~10范圍內均表現出活性,pH值2~6的酸性環境中酶活最高(61.3U/mg)且能在室溫下長時間維持活性并表現出極強的抗真菌活性[20]。
4 微生物幾丁質酶的酶學性質
4.1 微生物幾丁質酶的分類
微生物幾丁質酶來源廣泛,加之粘質沙雷氏菌(Serratia marcescens)QMB1466等產酶菌株能同時產生多種分子質量不同的幾丁質酶(21 ku、36 ku、48 ku、52 ku及57 ku)[21],因而微生物幾丁質酶種類繁多,但仍能根據其結構特點,作用位點,最適pH值等特性將之分類。(1)根據微生物幾丁質酶氨基酸序列的同源性差異,可將微生物來源幾丁質酶分為糖苷水解酶18和19家族,而微生物幾丁質酶大多屬于18家族[22]。(2)按微生物幾丁質酶對底物寡糖鏈酶切方式及終產物差異可分為外切幾丁質酶和內切幾丁質酶[23];外切幾丁質酶能與底物非還原端結合,然后依次切開糖苷鍵得到單糖;內切幾丁質酶則與底物隨機結合并切開相應糖苷鍵,得到幾丁寡糖和幾丁二糖。(3)根據微生物幾丁質酶催化反應最適pH值不同,可將其分為酸性、中性和堿性幾丁質酶,但大多微生物幾丁質酶是酸性酶[24]。(4)根據微生物幾丁質酶分泌性質不同,可將之分為胞外酶與胞內酶,大部分微生物都能產生胞外酶,又因胞外酶較容易提取制備,所以目前研究和應用較多的微生物幾丁質酶均屬于胞外酶。
4.2 微生物幾丁質酶的理化性質
微生物幾丁質酶是一大類復雜多樣的糖苷水解酶,分子質量介于10~100 ku之間,具有活性且較穩定的pH值介于3~10之間,最適pH值大多介于4~7之間,等電點(isoelectric point,p I)介于3.6~8.6之間,在4~60℃范圍內均有活性,而40~50℃是酶活最高的溫度區間(見表2),低溫較穩定,-20℃凍存兩年以上仍能保持較高活性[25-26]。此外,微生物幾丁質酶活性還易受金屬離子、化學試劑、有機溶劑及培養時間等因素影響。CHEBA BA等[27]發現,芽孢桿菌屬(Bacillus sp.)R2來源幾丁質酶的分子質量為41.68 ku,最適溫度為40℃,pH值7.5,Mg2+、Ca2+及1%SDS等因素能有效提升其活性,而Cu2+、Fe2+、Zn2+、Ag+、Hg2+及化學試劑乙二胺四乙酸(ethylene diamine tetraacetie acid,EDTA),N-乙酰葡萄糖胺和有機溶劑乙醇及丙酮等則能抑制其活性。

表2 部分微生物幾丁質酶的酶學性質Table 2 Enzymatic properties of some m icrobial chitinase
4.3 微生物幾丁質酶的分子生物學研究
4.3.1 微生物幾丁質酶多樣性
微生物幾丁質酶大多屬于誘導酶,為利用環境中幾丁質,微生物在長期進化進程中逐漸形成了分解利用環境中不同衍生類型幾丁質的酶,因而幾丁質酶的類型及編碼基因會隨菌種及菌株差異而發生變化,甚至同一菌株產生的幾丁質酶也存在顯著差異。TAKESHIT等[28]在分析耕地土壤微生物幾丁質酶基因時發現,土壤類型及其pH值是決定土壤微生物幾丁質酶基因類型和種類的關鍵,根據其預測的幾丁質酶氨基酸序列分析結果發現,501個耕地土壤微生物幾丁質酶被分為9個類群,與現有已知幾丁質酶比較,差異顯著,同源性僅介于40%~70%之間。粘質沙雷氏菌(Serratiamarcescens)MB1466的5種幾丁質酶由不同基因編碼及橄欖綠鏈霉菌(Streptomyces olivaceoviridis)ATCC 11238可由相同基因編碼的前體酶蛋白經不同方式剪切形成同源性小,差異較大的5種幾丁質酶則進一步說明微生物幾丁質酶的多樣性[21,29]。
4.3.2 微生物幾丁質酶的基因結構
幾丁質酶作用機理與生態學意義是現階段研究的熱點之一,隨著分子生物學的迅猛發展,人們開始從微觀領域來闡明幾丁質酶在各應用領域的分子機理及生態學意義。一般說來微生物幾丁質酶從氨基端到羧基端依次含有決定幾丁質酶是否分泌到胞外的信號肽(signalpeptide,SP),起真正催化水解作用的幾丁質酶催化域(catalytic domain,CHC),與幾丁質結合并顯著提升催化效率的幾丁質結合域(chitin binding domain,CBD)及一個位于C末端可能與分泌相關的插入序列[30]。但產酶微生物種類及菌株差異會導致微生物幾丁質酶及其結構域存在一定差異,如埃博拉病毒、丙型肝炎病毒及登革熱病毒等病毒不具備完整幾丁質酶但含有幾丁質結合域并參與致病[4],哈維氏弧菌(Vibrio harveyi)由來幾丁質酶則主要包含了N-末端信號肽(SP),由137個氨基酸殘基組成,富含β折疊股的幾丁質結合域(ChBDVhChiA),428個氨基酸殘基折疊成含(α/β)8復雜結構的提姆-桶(TIM-barrel)催化域(catalytic domain,CatD)及由86個氨基酸殘基折疊成的較短且可區分幾丁質酶不同亞類的(α+β)-折疊插入域(α+β-fold insertion domain)等四個區域(見圖1)[31]。FERRANDON S等[32]在研究環狀芽孢桿菌(Bacilluscirculans)由來幾丁質酶時發現,幾丁質結合域中含有高度保守的色氨酸和脯氨酸(Trp687,Pro689,Pro693),其中687位的色氨酸(Trp687)是該結構域的活性中心;位于幾丁質酶催化域表面的色氨酸(Trp122,Trp134)是引導幾丁質進入催化活性中心裂隙的功能位點,而天冬胺酸和谷氨酸(Asp200,Glu204)是催化域中催化水解幾丁質的活性中心;而相關研究表明纖連蛋白III型結構域(FnⅢ)在部分產幾丁質酶細菌中可能跟致病性相關[4]。
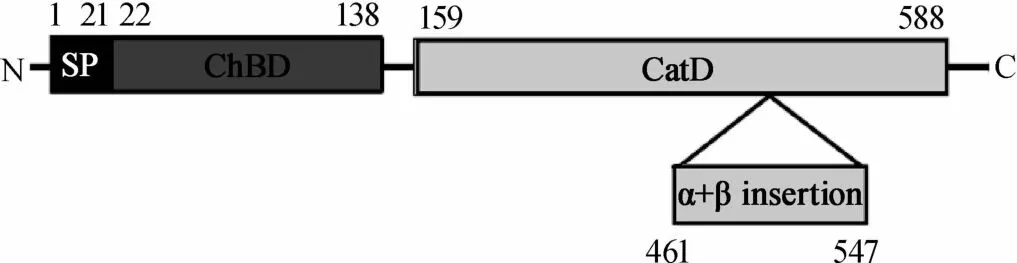
圖1 哈維氏弧菌幾丁質酶的一級結構Fig.1 Prim ary structure of chitinase from Vibrio harveyi
4.3.3 微生物幾丁質酶基因的表達調控
除蘇云金芽孢桿菌(Bacillus thuringiensis)等少數種屬菌株的幾丁質酶表達兼具組成型和誘導型特點外,微生物幾丁質酶大多屬于誘導酶,當外界環境中存在誘導底物時,幾丁質酶合成微生物能經過N-乙酰葡糖胺磷酸轉移酶系統(N-acetylglucosamine phosphotransferase system,PTS),三磷酸腺苷(adenosine triphosphate,ATP)結合盒轉運子(ATP-binding cassette,ABC)及主要協助轉運蛋白超家族(major facilitator superfamily,MFS)類轉運蛋白NagP等轉運系統將幾丁質降解產物幾丁寡糖或單體轉運到細胞內部,產生特定信號調控幾丁質酶相關基因的轉錄與表達,因而微生物幾丁質酶基因的表達調控可從轉運系統和基因表達兩個層面進行調控[33-34]。
COLSON S等[33]在研究菌株天藍色鏈霉菌(Streptomyces coelicolor)幾丁質酶基因調控時發現,幾丁二糖被ABC轉運系統轉運時會誘導產生幾丁質酶,但ABC轉運系統會受到全局性調節因子DasR的阻遏調控;當幾丁單糖被PTS轉運系統轉運時,轉運蛋白DasA則能通過與雙組份調節系統ChiS/ChiR中的感受器ChiS外部結構域結合,抑制幾丁質酶基因表達。糖催化特異性蛋白酶Ⅱ(EⅡ)是大腸桿菌PTS轉運系統中的關鍵,因為不論是轉運幾丁單糖PTS系統中編碼EⅡ的nagE-BACD操縱子,還是轉運幾丁二糖PTS系統中編碼EⅡ的chb-BCARFG操縱子均受調節因子NagC和cAMP受體蛋白-降解物激活蛋白(catabolite activator proteins,CAP)的調控,而chb操縱子還會受到自身基因chb-R產物ChbR的調控,當NagC及ChbR與相應操縱位點結合后可起到阻遏作用,而cAMP/CAP則可增強阻遏作用,進一步抑制PTS系統的轉運;此時,一旦受到6-磷酸-N-乙酰氨基葡萄糖的誘導,該阻遏作用就會消除[35]。
5 微生物幾丁質酶的應用
隨著研究深入,微生物幾丁質酶在生產及生活中的應用越來越受關注,加之其來源廣,易培養等特性,使微生物幾丁質酶被廣泛運用在生物防治、環境保護、醫藥、農業及食品加工等領域[16]。
5.1 微生物幾丁質酶的生物防控作用
微生物幾丁質酶生物防控作用主要體現在植物真菌及害蟲性病害與蚊媒傳播人畜共患病的預防等方面。相關研究發現木霉菌由來幾丁質酶對根霉等真菌細胞壁有降解作用,植物真菌感染及害蟲性病害與蚊媒傳播人畜共患病防治時,則因微生物幾丁質酶對殺蟲劑的增效作用而得到有效控制。KOBAYASHID Y等[36]成功證實嗜麥芽寡養單胞菌(Stenotrophomonasmaltophilia)34S1由來幾丁質酶是生物防治真菌感染導致草坪夏季斑枯病的關鍵。此外,SEODJ等[37]在類芽孢桿菌(Paenibacillusehimensis)MA2012由來幾丁質酶體外抗真菌實驗中發現,初步純化的類芽孢桿菌MA2012的幾丁質酶對引起經濟林果實腐爛,造成嚴重經濟損失的膠孢炭疽菌(Collectotrichum gloeosporioides)的孢子萌發有較強抑制作用,其抑制率可高達87%以上。而蘇云金芽孢桿菌以色列亞種(Bacillus thuringiensis subsp. israelensis)IPS78和蘇云金芽孢桿菌鲇澤亞種(Bacillus thuringiensis subsp.aizawai)HD133由來幾丁質酶則能通過破壞蟲體內富含幾丁質且起到抵御細菌和病毒入侵屏障-腸圍食膜的機制,發揮殺蟲增效作用,從而達到防治植物海灰翅夜蛾及小菜蛾害蟲,預防及控制埃及伊蚊所致蚊媒傳播人畜共患病的目的[38]。
5.2 微生物幾丁質酶及分解產物在醫學上的應用
微生物幾丁質酶與抗真菌藥物聯用,可預防不同類型真菌感染,而幾丁質經幾丁質酶降解后的N-乙酰幾丁寡糖和殼聚幾丁寡糖等產物具備抗腫瘤、抗感染及防治瘧疾等多種生理功能[39]。幾丁質降解產物幾丁六糖和殼六糖在ddY鼠抗腫瘤實驗中證實,注射劑量為100mg/(kg·d),連續注射3次后,幾丁六糖和殼六糖對S180肉瘤的抑制率可達85%和93%,注射5次后幾乎可完全抑制腫瘤生長[40];而幾丁六糖則在促進BALB/C鼠PEC(腹膜腔滲出細胞)活性氧生成,增強殺菌作用,發揮抗感染方面表現出巨大潛力[41]。REBECCA C L等[42]通過敲除惡性瘧原蟲(Plasmodium falcarum)幾丁質酶基因(PbCHT1)的研究證實,幾丁質酶是惡性瘧原蟲感染按蚊中腸的關鍵,針對惡性瘧原蟲幾丁質酶PbCHT1表面抗原決定簇的單克隆抗體1C3能有效抑制瘧原蟲對按蚊的侵染,從而利于控制瘧疾的傳播與感染。另外,人體腸道正常菌群也具有分泌幾丁質酶,并通過分解幾丁質產生N-乙酰幾丁寡糖和殼聚幾丁寡糖等降解產物的機制,發揮營養及增強機體免疫的功能[43]。
5.3 微生物幾丁質酶在幾丁質廢棄物處理上的應用
在日常生活及工業生產活動過程中會產生蟹殼、蝦殼等大量幾丁質廢棄物,這些廢棄物會對水體等自然環境造成嚴重污染,為提高廢棄物利用率,防止水體等環境被污染,產幾丁質酶微生物就被大量用于幾丁質廢棄物處理[39]。相關報道表明,幾丁質降解產物N-乙酰幾丁寡糖和殼聚幾丁寡糖等產物是良好的膳食纖維,有甜味適宜,吸濕性及保濕性強,能有效改善食品風味及品質,提升營養等特性;加之幾丁質水解產物氨基糖寡糖素具有調節動植物細胞代謝的特性,使微生物幾丁質酶在處理幾丁質廢棄物,提升食品、化妝品及飼料品質方面有巨大的開發應用前景[2]。而粘質沙雷氏菌(Serratiamarcescens)等幾丁質酶產生菌已被廣泛用于以蟹殼等幾丁質廢棄物為原料,分解制備高經濟價值單細胞蛋白的食品工業,并表現出巨大的市場潛力[21]。
5.4 微生物幾丁質酶在其他方面的應用
隨著研究深入,幾丁質酶除上述幾個應用領域外,幾丁質酶在基因工程、真菌性原生質體制備及提升菌株生物技術應用等領域表現出廣闊的應用前景。相關研究表明,轉入并成功表達微生物相關幾丁質酶基因的轉基因植物表現出極強的抗真菌感染能力與預防線蟲及昆蟲性病害的特性[39],幾丁質酶在作用于黑曲霉(Aspergillusniger)細胞壁后,能有效從黑曲霉培養液中制備丹寧酸酶(反膠團萃取該酶回收率可高達43%)[44],而去除細胞壁的真菌原生質體則被廣泛用于真菌細胞壁合成機理,酶合成分泌機理及生物技術應用方面的探究[45]。
6 結語與展望
綜上所述,微生物幾丁質酶是一類具有廣闊應用前景的新型生物酶,能有效用于生物防治,醫學應用,廢棄物處理,環境保護及食品加工等領域。現階段微生物幾丁質酶的研究多集中在菌種選育及產酶條件等方面,加之幾丁質酶結構及調控機理復雜,自然分離的酶活性不高,熱穩定性差等因素,使微生物幾丁質酶的應用及市場開發受到嚴重限制。堅信隨著熱穩定微生物幾丁質酶分子結構、催化機理及其基因水平調控機理研究的深入,微生物幾丁質酶將實現標準化的大規模生產,其應用領域將被進一步擴寬,市場發展前景也將越來越廣闊。
[1]李美玉,曹洪玉,張慶芳,等.幾丁質結合蛋白基因克隆、表達與純化[J].中國釀造,2015,34(11):41-46.
[2]GOODAY GW.The ecology of chitin decomposition[J].T Brit M ycol Soc,1968,51(2):293-309.
[3]BENECKEU.Bacillus chitinovorous einen chitin zersetzenden Spaltpilz [J].Bot Ztg,1905,63(8):227-242.
[4]PATEL S,GOYAL A.Chitin and chitinase:Role in pathogenicity,allergenicity and health[J].Int JBiol M acrom ol,2017,1864(9):1253-1259. [5]ROSAM D,DISTEFANOG,ZORENA K,etal.Chitinasesand immunity: Ancestralmoleculeswith new functions[J].Immunobiology,2015,221 (3):399-411.
[6]MAJETIN V,KUMAR R.A review of chitin and chitosan applications [J].React Funct Polym,2000,46(1):1-27.
[7]THARANATHANRN,KITTURFS.Chitin-theundisputed biomolecule ofgreatpotential[J].Crit Rev Food Sci Nutr,2003,43(1):61-87.
[8]張新軍,范麗卿,岳海梅,等.幾丁質酶產生菌發酵條件初步研究[J].中國農學通報,2010,26(24):42-46.
[9]FUNKHOUSER JD,ARONSON N N.Chitinase fam ily GH18:evolutionary insights from the genom ic history of a diverse protein fam ily[J]. BMC Evol Biol,2007,7(1):1-16.
[10]DOUGLASN L,MULLEN K M,TALMAGE SC,etal.Exploring the role of chitinolytic enzymes in the sea fan coral,Gorgonia ventalina[J]. Mar Biol,2007,150(6):1137-1144.
[11]STEFANIDIE,VORGIASC E.Molecular analysis of the gene encoding a new chitinase from themarine psychrophilic bacterium Moritella marina and biochem ical characterization of the recombinantenzyme[J]. Extrem ophiles,2008,12(4):541-552.
[12]YUECW,LIY Y,LüY H,etal.Isolation,expression and identification ofmultifunctional chitosanase from marine Streptomyces olivaceus FXJ7.023[J].China Biotechnol,2014,34(8):47-53.
[13]張圓.產幾丁質酶菌株的篩選與酶學性質研究[D].哈爾濱:東北農業大學,2015.
[14]SONG Y S,SEO DJ,JUWT,et al.Enzymatic properties of chitinaseproducing antagonistic bacterium Paenibacillus chitinolyticus with varioussubstrates[J].M icrobial Pathogenesis,2015,89:195-200.
[15]郝之奎,楊美玲,張自英,等.一株幾丁質酶產生菌的篩選及產酶條件優化[J].食品與生物技術學報,2015,34(11):1203-1211.
[16]RISHAD K S,REBELLO S,NATHAN V K,et al.Optim ised productionofchitinase from anovelmangrove isolate,Bacilluspum ilus MCB-7 using responsesurfacemethodology[J].Biocatal Agr Biotechnol,2016, 5:143-149.
[17]胡基華,陳靜宇,曹旭,等.高產幾丁質酶的粘質沙雷氏菌株的誘變選育[J].東北林業大學學報,2016,44(3):106-109.
[18]AHMADIK JA,YAZDIM T,NAJAFIM F,et al.Optim ization of medium and cultivation conditions for chitinase production by the newly isolated:Aeromonas sp.[J].Biotechnology,2008,7(2):266-272.
[19]SUZUKIS,NAKANISHIE,FURIHATA K,et al.Chitinase inhibitor allosam idin promotes chitinase production of Streptomyces generally [J].Int JBiol M acrom ol,2008,43(1):13-19.
[20]KARTHIK N,BINOD P,PANDEY A.Purification and characterisation of an acidic and antifungal chitinase produced by a Streptomyces sp.[J]. Bioresource Technol,2015,188(6):195-201.
[21]HARPSTERM H,DUNSMUIRP.Nucleotide sequenceof the chitinase B geneof Serratiamarcescens QMB1466[J].Nucleic Acids Res,1989, 17(13):5395-5395.
[22]FüL?P L,PONYI T.Classification of glycosyl hydrolases based on structuralhomology[J].JUniv Sci,2015,2(1):1-9.
[23]單立波,賈旭.幾丁質酶及其在抗真菌病基因工程中的應用[J].生物工程進展,1998,18(3):37-39.
[24]韓放,李景鵬.植物幾丁質酶的研究進展望[J].生物技術,2001,11(5):25-28.
[25]李麗,楊雪松,劉紅全.微生物幾丁質酶的特性及其應用的研究進展[J].廣西民族大學學報:自然科學版,2011,17(1):92-96.
[26]CHEN L,CHEN JP,KUMARA,etal.Effectsof domainsmodification on the catalytic potential of chitinase from Pseudomonas aeruginosa[J]. Int JBiol M acrom ol,2015,78:266-272.
[27]CHEBA BA,ZAGHLOULT I,EL-MASSRYM H,etal.Effectofmetal ions,chemical agents,and organic solvent on Bacillus sp.R2 chitinase activity[J].Proced Technol,2016,22:465-470.
[28]TAKESHIT,SEISHII,CHIAKIN,etal.Molecular diversity of bacterial chitinases in arable soils and the effects of environmental factors on thechitinolytic bacterialcommunity[J].Soil Biol Biochem,2009,41(3): 473-480.
[29]LIH M,PLATTNER H,SCHIMZ K L,et al.Cloning,sequencing and heterologous expression of a new chitinase gene,chi92,from Streptomyces olivaceoviridis ATCC 11238[J].Biotechnol Lett,2000,22(15): 1203-1209.
[30]GABER Y,MEKASHA S,VAAJE-KOLSTAD G,et al.Characterization ofachitinase from the cellulolytic actinomycete Thermobifidafusca [J].BBA-Pro Proteom,2016,1864(9):1253-1259.
[31]SUGINTAW,SIRIMONTREEP,SRITHO N,etal.The chitin-binding domain of a GH-18 chitinase from Vibrio harveyi is crucial for chitinchitinase interactions[J].Intl J Biol M acrom ol,2016,93(PtA):1111-1117.
[32]FERRANDON S,STERZENBACH T,MERSHA F B,et al.A single surface tryptophan in the chitin-binding domain from Bacillus circulans chitinase A1 playsapivotal role in binding chitinand can bemodified to create an elutable affinity tag[J].BBA-Gen Subjects,2003,1621(1): 31-40.
[33]COLSON S,VANWEZELG P,CRAIGM,etal.The chitobiose-binding protein,DasA,actsasa link between chitin utilization andmorphogenesis in Streptomyces coelicolor[J].M icrobiology,2008,154(Pt 2): 373-382.
[34]BOULANGER A,D GUILLAUME,LAUTIER M,et al.Identification and regulation of the N-acetylglueosam ine utilization pathway of the plantpathogenic bacterium Xanthomonas campestris pv.Campestris[J]. J Bacteriol,2010,192(6):1487-1497.
[35]謝池楚,賈海云,陳月華.細菌幾丁質酶基因的表達調控[J].遺傳,2011,33(10):1029-1038.
[36]KOBAYASHID Y,REEDY R M,BICK J,etal.Characterization of a chitinase gene from Stenotrophomonasmaltophilia strain 34S1 and its involvement in biological control[J].App l Environ M icrobiol,2002, 68(3):1047-1054.
[37]SEOD J,LEE Y S,KIM K Y,etal.Antifungalactivity of chitinaseobtained from Paenibacillus ehimensis MA2012 against conidial of Collectotrichum gloeosporioides in vitro[J].M icrob Pathogenesis,2016, 96:10-14.
[38]LIU M,CAIQ X,LIU H Z,et al.Chitinolytic activities in Bacillus thuringiensis their synergistic effects on larvicidal activity[J].J Appl M icrobiol,2002,93(3):374-379.
[39]SINGH R A,GUPTA R D.Chitinases from bacteria to human:properties,applications,and future perspectives[J].Enzyme Res,2015,2015 (2):1-8.
[40]TAKIGUCHIY Y,SHIMAHARA K.Isolation and identification of a thermophilic bacterium producing N-diacetylchitobiose from chitin[J]. Agr Biol Chem,1989,53(6):1537-1541.
[41]STLEGER R J,JOSHIL,ROBERTSD.Ambient pH is amajor determinantin theexpression of cuticle-degrading enzymesand hydrophobin by Metarhizium anisopliae[J].App l Environ M icrobiol,1998,64(2): 709-713.
[42]REBECCA C L,VINETZ JM.Monoclonal antibody against the Plasmodium falcarum chitinase PfCHT1,recognizesaMalaria transmissionblocking epitope in Plasmodium gallinaceum ookinetesunrelated to the chitianse PgCHT1[J].Infect Immun,2002,70(3):1581-1590.
[43]李麗,楊雪松,劉紅全.微生物幾丁質酶的特性及其應用的研究進展[J].廣西民族大學學報:自然科學版,2011,17(1):92-96.
[44]BARTHOMEUFC,REGERAT F,POURRAT H.Improvement in tannase recovery using enzymatic disruption ofmycelium in combination w ith reversem icellar enzyme extraction[J].Biotechnol Tech,1994,8 (2):137-142.
[45]VANAALTEN D M,KOMANDER D,SYNSTAD B,et al.Structural insights into the catalyticmechanism of a fam ily 18 exo-chitinase[J].P Natl Acad Sci USA,2001,98(16):8979-8984.
Research progressand application statusof microbial chitinase
GONG Fuming1,HECaimei2,TANGXiaoyan1,LIU Chenjian3*
(1.DepartmentofClinicalMedicine,Dehong VocationalCollege,Mangshi678400,China; 2.College ofChem istry and Bioengineering,Hezhou University,Hezhou 542899,China; 3.Faculty ofLife Science and Technology,Kunm ing University ofScience and Technology,Kunm ing 650500,China)
Chitinase isa kind of glucoside hydrolasewhich can catalyze chitin hydrolysis to N-acetylglucosamine oligomersormonomers,and w idely found inmicrobe(fungi,bacteria,actinomycetesand viruses),animalsand plants.Because of its special physiological function,chitinase isw idely used in biological control,medicalapplication,wastemanagement,environmentalprotection and other field.The source and classification,fermentation conditions,enzymology propertiesand applicationsofmicrobial chitinasewere summarized,in order to provide theoreticalguidance for further developmentand application of chitinase.
chitin;m icrobial chitinases;fermentation conditions;enzymatic property;application
Q939.99
0254-5071(2017)08-0020-06
10.11882/j.issn.0254-5071.2017.08.005
2017-04-13
云南省教育廳科學研究基金資助項目(2017ZZX109)
龔福明(1982-),男,講師,碩士,研究方向為食品微生物與食品安全。
*通訊作者:柳陳堅(1968-),教授,博士,研究方向為應用微生物、食品營養與安全。

