姜黃素減輕氧化型低密度脂蛋白誘導(dǎo)的人主動脈內(nèi)皮細胞損傷*
胡 勇, 蘇曉紅, 朱火蘭, 張凌霄, 劉 飛, 劉仲偉△
(1黃陵縣人民醫(yī)院心血管內(nèi)科, 陜西 黃陵 727300; 2陜西省人民醫(yī)院心血管內(nèi)科, 3西安醫(yī)學(xué)院臨床醫(yī)學(xué)系, 4西安交通大學(xué)附屬口腔醫(yī)院, 陜西 西安 710000)
姜黃素減輕氧化型低密度脂蛋白誘導(dǎo)的人主動脈內(nèi)皮細胞損傷*
胡 勇1, 蘇曉紅1, 朱火蘭2, 張凌霄3, 劉 飛4, 劉仲偉2△
(1黃陵縣人民醫(yī)院心血管內(nèi)科, 陜西 黃陵 727300;2陜西省人民醫(yī)院心血管內(nèi)科,3西安醫(yī)學(xué)院臨床醫(yī)學(xué)系,4西安交通大學(xué)附屬口腔醫(yī)院, 陜西 西安 710000)
目的: 觀察姜黃素對氧化型低密度脂蛋白(ox-LDL)誘導(dǎo)的人主動脈內(nèi)皮細胞(HAECs)損傷的作用及分子機制。方法: 以不同濃度姜黃素預(yù)處理體外培養(yǎng)的HAECs,再以ox-LDL對細胞進行干預(yù)。MTT法和EdU法評估細胞增殖能力;ELISA法對培養(yǎng)液中白細胞介素-6(IL-6)、轉(zhuǎn)化生長因子β1(TGFβ1)、高遷移率族蛋白1(HMGB1)以及分泌型晚期糖基化終產(chǎn)物受體(sRAGE)濃度進行檢測;凝膠電泳遷移率實驗(EMSA)評估過氧化物酶體增殖物激活受體γ(PPARγ)的結(jié)合活性;Western blot 法檢測HAECs中磷酸化PPARγ、血紅素氧合酶-1(HO-1)、HMGB1、IL-6、TGFβ1和RAGE的表達水平。結(jié)果: ox-LDL處理的HAECs細胞活力和增殖能力下降,細胞內(nèi)PPARγ/HO-1信號被抑制,其下游HMGB1/RAGE炎癥通路被激活,細胞分泌的IL-6、TGFβ1、HMGB1以及sRAGE濃度顯著增加。不同濃度姜黃素預(yù)處理可激活ox-LDL誘導(dǎo)的HAECs內(nèi)PPARγ/HO-1信號通路,從而抑制下游HMGB1/RAGE炎癥通路,降低IL-6、TGFβ1、HMGB1以及sRAGE炎癥因子水平。結(jié)論: ox-LDL能夠通過抑制PPARγ/HO-1而激活HMGB1/RAGE炎癥通路造成HAECs損傷。姜黃素則能夠通過活化PPARγ/HO-1通路抑制炎癥反應(yīng),減輕ox-LDL對HAECs的損傷。
姜黃素; 人主動脈內(nèi)皮細胞; 氧化型低密度脂蛋白; 過氧化物酶體增殖物激活受體γ
動脈粥樣硬化(atherosclerosis,AS)是動脈系統(tǒng)的常見病之一,其發(fā)病機制復(fù)雜。動脈血管內(nèi)皮細胞損傷在AS的發(fā)生發(fā)展過程中扮演重要的角色,如改變血流動力學(xué)、調(diào)控血管張力、誘發(fā)局部血小板凝聚及血栓形成等[1]。既往研究表明,機體內(nèi)過度產(chǎn)生的氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)導(dǎo)致的炎癥反應(yīng)是內(nèi)皮細胞損傷及死亡的重要原因[2]。高遷移率族蛋白1(high mobility group box-1 protein,HMGB1)被認為是重要的炎癥介導(dǎo)因子。在正常生理狀態(tài)下,HMGB1存在于細胞核中。在病理因素刺激下,HMGB1從細胞核中釋放,與其重要的受體——晚期糖基化終產(chǎn)物受體(receptor for advanced glycation end-products,RAGE)相結(jié)合構(gòu)成HMGB1/RAGE通路[3]。該信號通路活化后可誘導(dǎo)多種炎癥因子,如白細胞介素(interleukin,IL)及轉(zhuǎn)化生長因子(transforming growth factor,TGF)合成及分泌,從而誘發(fā)炎癥反應(yīng),導(dǎo)致細胞凋亡[4]。過氧化物酶體增殖物激活受體γ(peroxisome proliferator-activated receptor γ,PPARγ)信號通路的激活對炎癥反應(yīng)有抑制作用。PPARγ磷酸化是其激活的標志。近期的一項研究指出,PPARγ/血紅素氧合酶-1(heme oxygenase-1,HO-1)信號通路激活能夠抑制HMGB1/RAGE通路減弱炎癥反應(yīng)[5]。
中藥姜黃,其味辛苦,大寒,無毒,入心、肺二經(jīng),能行氣破瘀,通經(jīng)止痛。研究表明,姜黃具有抗動脈粥樣硬化的功效。姜黃素 (curcumin,Cur)屬于二酮類化合物,是姜黃的重要組成成分,具有抗腫瘤、抗感染、抗增殖、免疫調(diào)節(jié)以及抗炎等藥理活性。近期研究顯示,姜黃素可通過調(diào)控PPARγ信號通路發(fā)揮改善代謝紊亂、抗氧化以及抗纖維化等作用[6-7]。因此,我們提出如下科學(xué)假說:姜黃素可通過影響PPARγ/HMGB1/RAGE信號通路活性抑制內(nèi)皮細胞炎癥反應(yīng)。本研究以外源性ox-LDL處理人主動脈內(nèi)皮細胞(human aortic endothelial cells,HAECs)誘導(dǎo)炎癥反應(yīng),觀察姜黃素對細胞內(nèi)炎癥反應(yīng)的抑制作用并使用分子生物學(xué)手段闡明其可能分子機制,為姜黃素在抗動脈硬化的治療方面提供理論基礎(chǔ)。
材 料 和 方 法
1 細胞培養(yǎng)與處理
HAECs復(fù)蘇后以2×108/L濃度接種于培養(yǎng)瓶中,以含10%胎牛血清(Hyclone)的RPMI-1640細胞培養(yǎng)基(Hyclone)在適宜環(huán)境(37 ℃、5% CO2以及飽和濕度)的細胞培養(yǎng)箱中進行培養(yǎng)。取2~4代處于對數(shù)生長期的HAECs進行后續(xù)研究。根據(jù)干預(yù)不同,將細胞分為5組:(1)空白對照(control,Ctrl)組:以無血清RPMI-1640培養(yǎng)基進行細胞培養(yǎng);(2)ox-LDL處理組:以終濃度為150 mg/L的ox-LDL處理細胞24 h;(3)低濃度(10 μmol/L)姜黃素處理組(Cur 10組):先以終濃度為10 μmol/L的姜黃素對HAECs進行2 h干預(yù),而后以終濃度為150 mg/L的ox-LDL處理細胞24 h;(4)中濃度(20 μmol/L)姜黃素處理組(Cur 20組):先以終濃度為20 μmol/L的姜黃素對HAECs進行2 h干預(yù),而后以終濃度為150 mg/L的ox-LDL處理細胞24 h;(5)高濃度(40 μmol/L)姜黃素處理組(Cur 40組):先以終濃度為40 μmol/L的姜黃素對HAECs進行2 h干預(yù),而后以終濃度為150 mg/L的ox-LDL處理細胞24 h。
2 方法
2.1 細胞活力的檢測 采用四氮噻唑藍(MTT)法對細胞活力進行檢測。取處于對數(shù)生長期的細胞接種于96孔細胞培養(yǎng)板,分別給予ox-LDL和/或姜黃素處理,分別在姜黃素處理12 h、24 h及48 h取樣,各組設(shè)6個復(fù)孔,置于細胞培養(yǎng)箱中培養(yǎng)后,每孔分別加入20 μL終濃度為5 g/L的MTT溶液(Sigma)后繼續(xù)培養(yǎng)4 h。棄去每孔液體后,加入150 μL DMSO溶液(Sigma)充分振蕩。使用酶標儀(Bio-Rad)在570 nm讀取每孔的吸光度(A)。按照如下公式計算細胞活力抑制率:細胞活力抑制率(%)=(1-干預(yù)組A值/對照組A值)×100%。
2.2 細胞增殖能力的檢測 采用EdU熒光染色法對細胞增殖能力進行檢測。在細胞培養(yǎng)基中加入終濃度為10 μmol/L的EdU(Invitrogen),繼續(xù)培養(yǎng)2.5 h。經(jīng)過4%多聚甲醛固定和0.5% Triton X-100穿透處理后,避光條件下加入Apollo染色反應(yīng)液(Invitrogen)。最后以DAPI對細胞核進行染色。以熒光顯微鏡觀察,隨機選取5個視野,分別計數(shù)EdU陽性細胞數(shù)及細胞總數(shù),以兩者比值表示細胞增殖能力。
2.3 細胞培養(yǎng)液炎癥因子測定 各組細胞離心后,獲得的培養(yǎng)液經(jīng)過Centricon-YM10濃縮柱(Millipore)濃縮后,分別使用HMGB1 ELISA試劑盒(R&D)、分泌型RAGE(sRAGE) ELISA試劑盒(R&D)、IL-6 ELISA試劑盒(Invitrogen)以及TGFβ1試劑盒(Invitrogen)測定細胞培養(yǎng)液中HMGB1、sRAGE、IL-6以及TGFβ1的濃度。操作均按照產(chǎn)品說明書進行。
2.4 凝膠電泳遷移率實驗(electrophoretic mobility shift assay,EMSA)測定PPARγ結(jié)合活性 各組細胞離心后棄去上清,收集細胞,分別使用細胞漿蛋白抽提試劑盒及細胞核蛋白抽提試劑盒獲得相應(yīng)蛋白樣本,使用增強型BCA蛋白濃度試劑盒對提取的蛋白濃度進行檢測。過氧化物酶體增殖物反應(yīng)元件(PPRE)的寡核苷酸探針序列為5’-CAAACTAGGTCAAAGGTCA-3’。將2 μL以[32P]-ATP標記的探針、4 μg提取的核蛋白以及4 μL EMSA/Gel-shift binding buffer加無核酶水調(diào)整至總反應(yīng)體積18 μL,室溫下孵育20 min后加入5%聚丙烯酰胺凝膠中,在EMSA/Gel-shift running buffer中以100 V電壓進行電泳,直至溴酚藍到達凝膠底部。取出凝膠進行放射自顯影,以X線膠片曝光后進行分析。
2.5 Western blot實驗 使用上述2.4中獲得的蛋白樣本進行檢測。將樣本加入上樣緩沖液,在沸水中變性后,以聚丙烯酰胺凝膠電泳分離,再電轉(zhuǎn)印至NC膜或PVDF膜,5%脫脂牛奶封閉1 h。分別以抗PPARγ抗體、抗磷酸化PPARγ抗體、抗RAGE抗體、抗GAPDH抗體、抗histone H1抗體(Abcam)、抗HMGB1抗體、抗HO-1抗體(Invitrogen)、抗IL-6抗體(Santa Cruz)和抗TGFβ1抗體(Sigma),在4 ℃下孵育樣本8 h,用TBST洗滌后,用相應(yīng)辣根過氧化物酶標記的 II 抗在室溫孵育1 h。洗滌后采用ECL發(fā)光液(Thermo)處理,最后在X線膠片上曝光、分析。
3 統(tǒng)計學(xué)處理
使用統(tǒng)計學(xué)軟件SPSS 16.0進行統(tǒng)計學(xué)分析。本研究所得數(shù)據(jù)均采用均數(shù)±標準差(mean±SD)表示,組間差異比較采用單因素方差分析,以P<0.05為差異有統(tǒng)計學(xué)意義。
結(jié) 果
1 姜黃素預(yù)處理能夠顯著增加ox-LDL處理的HAECs的活力
MTT檢測結(jié)果如圖1所示,與對照組相比,經(jīng)ox-LDL處理后,HAECs的細胞活力抑制率顯著增加,差異有統(tǒng)計學(xué)意義(P<0.05)。不同濃度的姜黃素(10、20、40 μmol/L)預(yù)處理12 h、24 h及48 h均能夠降低ox-LDL對HAECs細胞活力的抑制作用,且呈現(xiàn)濃度依賴性,均具有統(tǒng)計學(xué)意義(P<0.05)。
2 姜黃素預(yù)處理能夠顯著增加ox-LDL處理的HAECs的增殖能力
EdU熒光染色如圖2所示,與對照組相比,經(jīng)ox-LDL處理后,HAECs的增殖能力顯著下降,差異具有統(tǒng)計學(xué)意義(P<0.05)。不同濃度的姜黃素(10、20、40 μmol/L)預(yù)處理均能提高ox-LDL處理的HAECs的增殖能力,且呈現(xiàn)顯著的濃度依賴性(P<0.05)。

Figure 1.The effect of curcumin (Cur) on the viability of ox-LDL-induced HAECs. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
圖1 不同濃度姜黃素對ox-LDL處理的HAECs細胞活力的影響

Figure 2.The effect of curcumin (Cur) on the proliferation of ox-LDL-induced HAECs were measured by EdU assay. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
圖2 EdU實驗檢測不同濃度姜黃素對ox-LDL誘導(dǎo)的HAECs細胞增殖能力的影響
3 姜黃素預(yù)處理顯著降低ox-LDL處理的HAECs培養(yǎng)液中炎癥因子水平
ELISA法檢測HAECs細胞培養(yǎng)液中炎癥因子水平的結(jié)果如圖3所示。與對照組相比,接受ox-LDL處理的HAECs細胞培養(yǎng)液中HMGB1、sRAGE、IL-6及TGFβ1水平均顯著升高,差異具有統(tǒng)計學(xué)意義(P<0.05)。不同濃度姜黃素(10、20和40 μmol/L)預(yù)處理能夠顯著降低ox-LDL處理的HAECs細胞培養(yǎng)液中HMGB1、sRAGE、IL-6及TGFβ1濃度,呈現(xiàn)出濃度依賴性,且差異均具有統(tǒng)計學(xué)意義(P<0.05)。
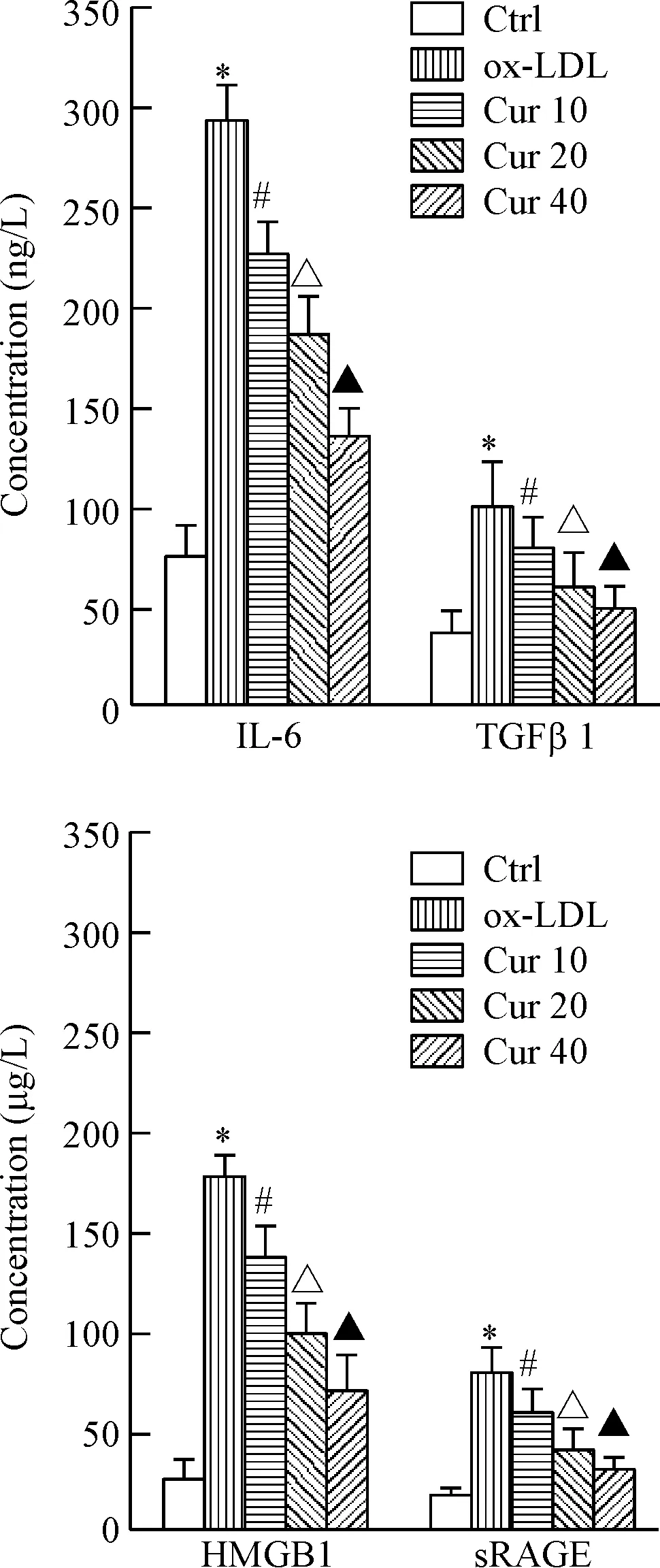
Figure 3.The effect of curcumin (Cur) on inflammatory factors in the cell culture medium of the ox-LDL-induced HAECs. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
圖3 姜黃素對ox-LDL處理的HAECs培養(yǎng)液中炎癥因子水平的影響
4 姜黃素預(yù)處理顯著提高ox-LDL處理的HAECs內(nèi)PPARγ活性
ox-LDL處理的HAECs細胞核內(nèi)PPARγ磷酸化水平顯著降低,提示PPARγ信號通路活性被抑制;EMSA結(jié)果表明PPARγ與DNA的結(jié)合能力顯著下降,與對照組相比差異均具有統(tǒng)計學(xué)意義(P<0.05)。采用不同濃度姜黃素(10、20、40 μmol/L)預(yù)處理不僅能夠顯著提高ox-LDL處理的HAECs細胞核內(nèi)PPARγ的磷酸化水平,還能夠提高PPARγ與DNA的結(jié)合能力,呈現(xiàn)出顯著的濃度依賴性,且差異均具有統(tǒng)計學(xué)意義(P<0.05),見圖4、5。
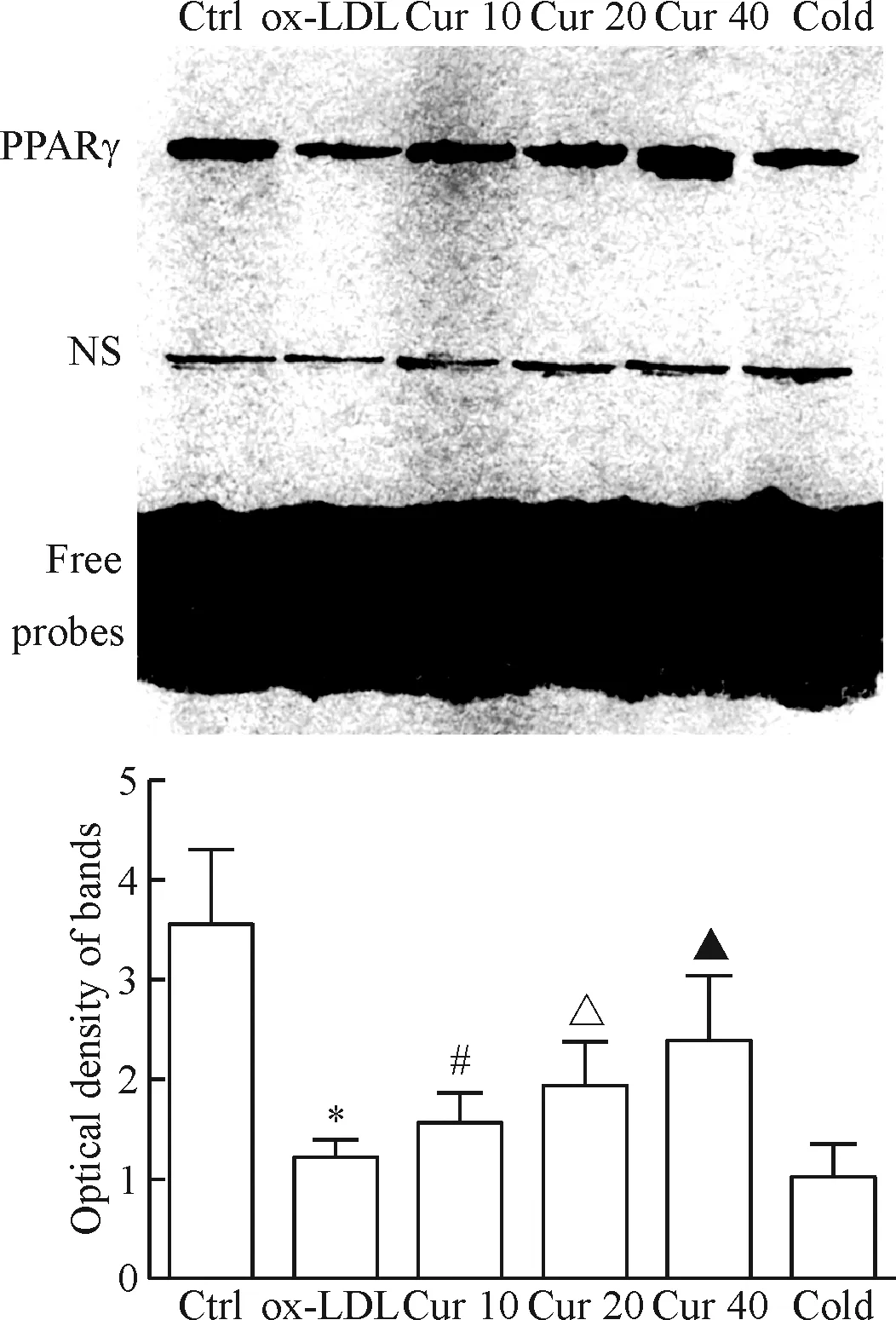
Figure 4.The effect of curcumin (Cur) on the binding activity of PPARγ to PPRE in the ox-LDL-induced HAECs. The optical densities of the EMSA electrophoretic bands in each lane were determined. NS: non-specific electrophoretic band; Cold: cold probes. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
圖4 姜黃素對ox-LDL處理的HAECs內(nèi)PPARγ與PPRE結(jié)合能力的影響
5 姜黃素預(yù)處理能夠激活ox-LDL處理的HAECs內(nèi)PPARγ下游HO-1信號通路,抑制HMGB1/RAGE炎癥通路信號活化
在以ox-LDL處理的HAECs中,HO-1表達水平顯著下降,同時HMGB1和RAGE水平顯著升高,提示ox-LDL能夠使HMGB1/RAGE炎癥通路激活。此外,HAECs內(nèi)炎癥細胞因子IL-6及TGFβ1表達水平顯著升高(P<0.05)。然而,在不同濃度姜黃素(10、20和40 μmol/L)預(yù)處理的HAECs中,HO-1表達水平顯著升高,同時HMGB1和RAGE表達水平被明顯抑制,且細胞內(nèi)IL-6及TGF-β1的表達水平顯著降低(P<0.05),呈現(xiàn)濃度依賴性,表明姜黃素能夠抑制PPARγ下游的HMGB1/RAGE炎癥信號通路的活化,見圖6。

Figure 5.The effect of curcumin (Cur) on the phosphorylation of PPARγ in the ox-LDL-induced HAECs were determined by Western blot. Histone H1 was used as the internal control. TheAratio of p-PPARγ/PPARγ was calculated. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
圖5 姜黃素對ox-LDL處理的HAECs內(nèi)PPARγ磷酸化的影響

Figure 6.The effect of curcumin (Cur) on the protein levels of HO-1, RAGE, HMGB1, IL-6 and TGFβ1 in the ox-LDL-induced HAECs determined by Western blot. GAPDH was used as the internal control. Mean±SD.n=3.*P<0.05vsCtrl group;#P<0.05vsox-LDL group;△P<0.05vsCur 10 group;▲P<0.05vsCur 20 group.
圖6 Western blot檢測姜黃素對ox-LDL處理的HAECs內(nèi)HO-1、RAGE、HMGB1、IL-6以及TGFβ1表達的影響
討 論
ox-LDL由LDL氧化修飾而來,是AS的重要致病因子,募集單核-巨噬細胞、參與形成泡沫細胞及脂質(zhì)條紋、誘發(fā)及促進炎癥反應(yīng)以及介導(dǎo)內(nèi)皮細胞損傷。血管內(nèi)皮功能障礙及損傷既是AS發(fā)生的始動因素,又是AS發(fā)展的促進因素[8]。過度產(chǎn)生的ox-LDL可誘導(dǎo)內(nèi)皮細胞出現(xiàn)炎癥反應(yīng),導(dǎo)致內(nèi)皮細胞出現(xiàn)損傷,從而促進AS的形成。本研究中,我們發(fā)現(xiàn)ox-LDL處理導(dǎo)致HAECs內(nèi)及培養(yǎng)液中炎癥因子水平、細胞抑制率顯著升高,細胞增殖能力顯著下降,表現(xiàn)出對細胞的毒性作用。
一些研究提出了通過干預(yù)HMGB1/RAGE信號通路來抑制炎癥反應(yīng)的策略[9]。在Wang等[5]的一項近期研究中,PPARγ激動劑羅格列酮能夠顯著抑制HMGB1/RAGE信號的激活。使用HMGB1特異性抗體能夠抑制實驗動物體內(nèi)的炎癥反應(yīng)[10];RAGE基因沉默動物也對病理應(yīng)激表現(xiàn)出較弱的炎癥反應(yīng)[11]。進一步的研究表明,HMGB1/RAGE信號通路受到其上游分子HO-1的調(diào)控[12]。以上分子共同組成PPARγ/HO-1/HMGB1/RAGE信號通路。本研究發(fā)現(xiàn),ox-LDL處理可使 HAECs細胞內(nèi)HMGB1/RAGE信號通路顯著活化,而使炎癥因子濃度明顯升高,造成HAECs損傷。
PPARs是核激素受體家族中的配體激活受體,目前共發(fā)現(xiàn)3種亞型,生物功能復(fù)雜,參與調(diào)控多種生理及病理過程。PPARs被激活后,可與視黃醇類X受體結(jié)合并形成二聚體,進而通過與PPRE的結(jié)合,調(diào)控靶基因的轉(zhuǎn)錄活性,產(chǎn)生眾多生物學(xué)效應(yīng)[13]。PPARγ以磷酸化的方式被激活。HO-1是PPARγ下游的重要靶基因,組成PPARγ/HO-1信號通路,其激活后在心血管系統(tǒng)中具有抗氧化以及抗炎等活性。本研究發(fā)現(xiàn),ox-LDL作用后,HAECs內(nèi)PPARγ的磷酸化水平及與PPRE的結(jié)合能力顯著降低,HO-1表達水平下調(diào),表明ox-LDL可通過降低PPARγ/HO-1信號通路的活性誘發(fā)HAECs的炎癥反應(yīng)而造成細胞損傷。以上結(jié)果表明,ox-LDL對HAECs造成的細胞損傷與PPARγ/HO-1/HMGB1/RAGE信號通路有關(guān),其中對PPARγ/HO-1信號的抑制導(dǎo)致了下游HMGB1/RAGE信號的活化,從而導(dǎo)致細胞炎癥反應(yīng)的加劇。
姜黃素是提取自植物姜黃中有效中藥單體,即[1,7-二(4-羥基-3甲氧基)苯基-1,6-庚二烯-3,5-二酮],其生物安全性得到了包括美國藥品食品管理局等權(quán)威機構(gòu)的認證[14]。姜黃素為脂溶性的二酮類化合物,其獨特的β-二酮及酮-烯-醇結(jié)構(gòu)使其具有抗氧化以及與多肽分子相互作用的藥理學(xué)活性。姜黃素在纖維化、脂肪細胞分化以及胰島素抵抗等多種病理生理過程中具有激活PPARγ信號的作用[15-17]。本研究發(fā)現(xiàn),使用姜黃素能夠減輕ox-LDL誘導(dǎo)的HAECs細胞炎癥反應(yīng)。我們的進一步研究發(fā)現(xiàn),姜黃素處理能夠提高PPARγ的活性,表現(xiàn)為對PPARγ磷酸化的促進作用及對PPARγ與PPRE結(jié)合能力的顯著提高。這一作用能夠使PPARγ的下游靶分子HO-1表達顯著上調(diào),進而抑制炎癥通路HMGB1/RAGE信號活化,最終起到抑制HAECs中炎癥反應(yīng)作用。
總之,通過本研究結(jié)果可知,姜黃素可通過影響PPARγ/HO-1/HMGB1/RAGE信號通路活性抑制ox-LDL誘導(dǎo)的HAECs中的炎癥反應(yīng),對細胞起保護作用。PPARγ是姜黃素的作用靶點之一。動脈粥樣硬化內(nèi)皮細胞損傷的發(fā)病機制復(fù)雜,目前臨床常用藥物的保護及逆轉(zhuǎn)作用并不十分理想。尋找新的、安全可靠的有效藥物具有很大的臨床價值。本研究結(jié)果提示姜黃素在動脈粥樣硬化的預(yù)防及治療中具有很大應(yīng)用潛力,為其臨床應(yīng)用提供了新理論基礎(chǔ)。
[1] Gao W, Liu H, Yuan J, et al. Exosomes derived from mature dendritic cells increase endothelial inflammation and atherosclerosis via membrane TNF-α mediated NF-κB pathway[J]. J Cell Mol Med, 2016, 12(10):2318-2327.
[2] Wei DH, Jia XY, Liu YH, et al.CathepsinLstimulates autophagy and inhibits apoptosis of ox-LDL-induced endothelial cells: potential role in atherosclerosis[J]. Int J Mol Med, 2013, 31(2):400-406.
[3] Jhun J, Lee S, Kim H, et al. HMGB1/RAGE induces IL-17 expression to exaggerate inflammation in peripheral blood cells of hepatitis B patients[J]. J Transl Med, 2015, 13:310.
[4] LeBlanc PM, Doggett TA, Choi J, et al. An immunogenic peptide in the A-box of HMGB1 protein reverses apoptosis-induced tolerance through RAGE receptor[J]. J Biol Chem, 2014, 289(11):7777-7786.
[5] Wang G, Liu L, Zhang Y, et al. Activation of PPARgamma attenuates LPS-induced acute lung injury by inhibition of HMGB1-RAGE levels[J]. Eur J Pharmacol, 2014, 726(5):27-32.
[6] Jaroonwitchawan T, Chaicharoenaudomrung N, Namkaew J, et al. Curcumin attenuates paraquat-induced cell death in human neuroblastoma cells through modulating oxidative stress and autophagy[J]. Neurosci Lett, 2016, 25(16):30805-30809.
[7] Lim W, Jeong M, Bazer FW, et al. Curcumin suppresses proliferation and migration and induces apoptosis on human placental choriocarcinoma cells via ERK1/2 and SAPK/JNK MAPK signaling pathways[J]. Biol Reprod, 2016, 95(4):83.
[8] Yuan X, Chen J, Dai M. Paeonol promotes microRNA-126 expression to inhibit monocyte adhesion to ox-LDL-injured vascular endothelial cells and block the activation of the PI3K/Akt/NF-kappa B pathway[J]. Int J Mol Med, 2016, 38(6):1871-1878.
[9] Gangemi S, Casciaro M, Trapani G, et al. Association between HMGB1 and COPD: a systematic review[J]. Mediators Inflamm, 2015, 2015: 164913.
[10]Gong Q, Xu JF, Yin H, et al. Protective effect of antagonist of high-mobility group box 1 on lipopolysaccharide-induced acute lung injury in mice[J]. Scand J Immunol, 2009, 69(1):29-35.
[11]Sims GP, Rowe DC, Rietdijk ST, et al. HMGB1 and RAGE in inflammation and cancer[J]. Annu Rev Immunol, 2010, 28:367-388.
[12]Kohno T, Anzai T, Naito K, et al. Role of high-mobility group box 1 protein in post-infarction healing process and left ventricular remodelling[J]. Cardiovasc Res, 2009, 81(3):565-573.
[13]Sheikh IA, Khweek AA, Beg MA. Peroxisome proliferator-activated receptors as potential targets for carcinogenic activity of polychlorinated biphenyls: a computational perspective[J]. Anticancer Res, 2016, 36(11):6117-6124.
[14]Deng YI, Verron E, Rohanizadeh R. Molecular mechanisms of anti-metastatic activity of curcumin[J]. Anticancer Res, 2016, 36(11):5639-5647.
[15]江振友, 岳 磊, 盧燕茹, 等. 姜黃素抑制小鼠矽肺纖維化[J]. 中國病理生理雜志, 2009, 25(5):976-979.
[16]Hu Y, Mou L, Yang F, et al. Curcumin attenuates cyclosporine A induced renal fibrosis by inhibiting hypermethylation of the klotho promoter[J]. Mol Med Rep, 2016, 14(4):3229-3236.
[17]Gu Q, Cai Y, Huang C, et al. Curcumin increases rat mesenchymal stem cell osteoblast differentiation but inhibits adipocyte differentiation[J]. Pharmacogn Mag, 2012, 8(31):202-208.
(責(zé)任編輯: 林白霜, 余小慧)
Effect of curcumin on ox-LDL-induced HAEC injury
HU Yong1, SU Xiao-hong1, ZHU Huo-lan2, Zhang Ling-xiao3, LIU Fei4, LIU Zhong-wei2
(1DepartmentofCardiology,HuanglingCountyPeople’sHospital,Huangling727300,China;2DepartmentofCardiology,ShanxiProvincialPeople’sHospital,3DepartmentofClinicalMedicine,Xi’anMedicalCollege,4DentalHospitalofXi’anJiaotongUniversity,Xi’an710000,China.E-mail:liuzhongwei@xjtu.edu.cn)
AIM: To investigate the effect of curcumin on oxidized low-density lipoprotein (ox-LDL)-induced injury of human aortic endothelial cells (HAECs). METHODS: HAECs were pre-treated with curcumin at different concentrations and then treated with ox-LDL. The cell viability was assessed by MTT assay. The cell proliferation ability was analyzed by EdU assay. ELISA was used to determine the concentrations of interleukin-6 (IL-6), transforming growth factor β1 (TGFβ1), high mobility group box-1 protein (HMGB1) and secretory receptor for advanced glycation end products (sRAGE) in the HAEC culture medium. The binding activity of peroxisome proliferator-activated receptor γ (PPARγ) was evaluated by electrophoretic mobility shift assay. The protein levels of HO-1, HMGB1, RAGE,IL-6,TGFβ1 and phosphorylated PPARγ in the HAECs were determined by Western blot. RESULTS: The viability and the proliferation ability decreased significantly in the HAECs treated with ox-LDL. The PPARγ/HO-1 signaling pathway was inhibited while its down-stream HMGB1/RAGE signaling pathway was activated by ox-LDL. The levels of IL-6, TGFβ1, HMGB1 and sRAGE were increased. Pre-treatment with curcumin activated PPARγ/HO-1 signaling pathway and inhibited HMGB1/RAGE signaling pathway in ox-LDL treated HAECs in a concentration-dependent manner. The levels of IL-6, TGFβ1, HMGB1 and sRAGE were also decreased dramatically by pre-treatment of curcumin in a concentration-dependent manner. CONCLUSION: ox-LDL induces HAEC damage by inhibiting PPARγ/HO-1 to activate HMGB1/RAGE inflammatory signaling. Curcumin exerts protective effect on ox-LDL treated HAECs via activating PPARγ/HO-1 signaling pathway.
Curcumin; Human aortic endothelial cells; Oxidized low-density lipoprotein; Peroxisome prolife-rator-activated receptor γ
1000- 4718(2017)08- 1359- 06
2016- 11- 28
2017- 04- 19
國家自然科學(xué)基金資助項目(No. 81600646)
R363.2+1; R965
A
10.3969/j.issn.1000- 4718.2017.08.003
雜志網(wǎng)址: http://www.cjpp.net
△通訊作者 Tel: 029-85251331-3194; E-mail: liuzhongwei@xjtu.edu.cn

