超敏肌鈣蛋白I和N末端B型鈉尿肽原對曲妥珠單抗致心臟毒性的預測價值
郭艷麗,薛 劍,李 軍,鄭本獻,馮 霞,張孝忠
超敏肌鈣蛋白I和N末端B型鈉尿肽原對曲妥珠單抗致心臟毒性的預測價值
郭艷麗1,2,薛 劍1,李 軍1,鄭本獻2,馮 霞2,張孝忠1
目的 評估超敏肌鈣蛋白I(high-Sesitivity troponin I,hs-cTnI)和N末端鈉尿肽原(N terminal brain natriuretic peptide,NT-proBNP)對曲妥珠單抗致心臟毒性的預測價值。方法 收集117例醫院接受蒽環類化療藥物序貫曲妥珠單抗治療的乳腺癌患者的病例資料,在蒽環類化療前(visit1)和曲妥珠單抗用藥前(visit2)、曲妥珠單抗治療開始的3個月(visit3)及隨后每3個月1次進行全面的心臟檢查和超聲心動圖評估心功能。在visit1、visit2和visit3檢測hs-cTnI 和NT-proBNP的濃度,共隨訪15個月,發生心臟毒性事件為觀察終點。根據曲妥珠單抗致心臟毒性的診斷指標,將患者分為心臟毒性組和非心臟毒性組。評價hs-cTnI 和NT-proBNP對曲妥珠單抗致心臟毒性的預測價值。結果 16例出現心臟毒性,心臟毒性組與非心臟毒性組的hs-cTnI水平在Visit2和Visit3,兩組組間比較有統計學差異(P<0.05),而NT-proBNP僅在曲妥珠單抗治療治療開始3個月兩組間比較差異有統計學意義(P<0.01)。以曲妥珠單抗治療開始3個月的血清hs-cTnI和NT-proBNP濃度水平進行ROC曲線分析,可見hs-cTnI的AUC、特異度和敏感性都很高,且均優于 NT-proBNP ,故可認為,hs-cTnI是一個曲妥珠單抗致心臟毒性的預測生物標志物。
超敏肌鈣蛋白I;N末端鈉尿肽原;心臟毒性;預測價值
人體表皮生長因子受體-2(Her-2)為乳腺癌的主要致病相關基因,曲妥珠單抗作為抗HER-2的單克隆抗體,已經成為HER-2陽性乳腺癌治療的主要靶向治療藥物,它聯合化療藥物可有效延長乳腺癌患者的中位生存期,使乳腺癌成為“慢性病”。然而,曲妥珠單抗存在心臟毒性,正引起人們關注。Bowles等[1]發現,單一使用曲妥珠單抗所致心臟毒性的發生率為2.5%~4.7%,在經過蒽環類為基礎的化療后給予曲妥珠單抗治療的患者心功能障礙的發生率高達27%[1-3]。顯然,由于蒽環類抗生素和曲妥單抗聯合使用,增加了老年乳腺癌患者心臟毒性的風險[4,5]。蒽環類或曲妥珠單抗所致的心臟損害,在臨床癥狀出現及超聲心動圖檢出心功能不全之前早已存在,目前唯一推薦的監測化療藥物所致心臟毒性的指標是超聲心動圖的左室射血分數(LVEF),但越來越多的研究表明,心肌細胞壞死導致的心臟損害在LVEF降低之前已經發生。因此,需要尋找出能發現心臟結構與功能早期微細變化的方法。近年來發現,一些生物標志物與心臟毒性的發展密切相關[6,7],本研究通過分析117例乳腺癌患者治療期間hs-cTnI和NT-proBNP的濃度變化,探討其在預測曲妥珠單抗致心臟毒性中的臨床價值。
1 對象與方法
1.1 對象 選取2013-06至2014-12我院Her-2陽性并符合AC(蒽環類+環磷酰胺)→TH(紫杉類+曲妥珠單抗)方案治療的早期乳腺癌患者,共117例進行前瞻性研究,年齡32~69 歲,中位年齡47歲。納入標準:(1) 同意入組并簽署知情同意書;(2)女性,年齡≥18歲;(3)卡氏評分(kps)≥70分 ;(4)病理證實為浸潤性乳腺癌根據第7版AJCC分期標準,病理分期為Ⅰ-Ⅲ期的患者;(5)HER-2陽性:免疫組織化學(IHC)檢測,HER-2表達呈現++或+++,并且熒光原位雜交檢測結果為陽性;(6)符合AC-TH治療方案的患者;(8)肝腎功能、肌鈣蛋白、心肌酶譜和腦鈉素測定正常。排除標準:(1)雙乳癌或存在遠處轉移;(2)顯著的心血管病患者包括心功能不全(LVEF≤50%)、心律失常、未控制的高血壓、心絞痛等;(3)其他腫瘤病史,曾接受過蒽環類或曲妥珠單抗治療。剔除標準: 治療期間因各種原因中止治療的患者,未定期復查而使主要觀察指標缺失者。
1.2 方法
1.2.1 給藥方案 AC-TH方案,即給予多柔比星(60 mg/m2)+環磷酰胺(600 mg/m2), 每21 d 1次,共4個周期,之后轉到兩種方案之一:(1)紫杉醇(80 mg/m2)同步使用曲妥珠單抗(初始負荷劑量為4 mg/kg,隨后劑量為2 mg/kg),每周給藥1次共12周;(2)多西他賽(80 mg/m2)同步使用曲妥珠單抗(初始負荷劑量為8 mg/kg,隨后劑量為6 mg/kg)每21 d 1次,共4個周期。在紫杉醇或多西他賽使用完畢后,繼續使用曲妥珠單抗(6 mg/kg)。每21 d 1次,使用1年。
1.2.2 觀察指標 基于歐洲醫學腫瘤學學會(ESMO)指南,用于檢測化療引起心臟毒性的方法是超聲心動圖,在抗腫瘤化療期間應每3個月1次進行全面的心臟檢查和超聲心動圖評估[8]。本研究在蒽環類藥物用藥前(visit1)、曲妥珠單抗用藥前(visit2)和曲妥珠單抗治療開始后的3個月(visit3)及隨后1年,每3個月1次進行全面的心臟檢查和超聲心動圖評估心功能,并在visit1、visit2和visit3增加檢測hs-cTnI 和NT-proBNP的濃度。
1.2.3 測定方法 采用ELISA酶聯免疫法對兩組患者的血漿 hs-cTnI濃度進行測定;采用Roche電化學發光儀對兩組患者的血漿NT -proBNP濃度進行測定。
1.2.4 隨訪 每3個月1次隨訪(門診復查、電話隨訪或電子病例),共15個月。以曲妥珠單抗所致心臟毒性的診斷標準進行評價,發生心臟毒性事件即觀察終止。曲妥珠單抗所致心臟毒性的診斷標準依據2002年美國的心臟毒性審查與考核委員會(CREC)確定,即LVEF從基線下降≥5%,降至<55%,伴有心衰癥狀和體征;或LVEF從基線下降≥10%,降至<55%,無心衰癥狀和體征[9]。

2 結 果
2.1 一般臨床資料 在蒽環類藥物治療前,心臟毒性組和非心臟毒性組之間的年齡、體重、腫瘤位置、雌激素受體、孕激素受體 、腫瘤分期、LVEF等一般資料比較,差異無統計學意義。
2.2 血清hs-cTnI和NT-proBNP水平與各時間點的關系 心臟毒性組與非心臟毒性組的hs-cTnI水平(visit1)差異無統計學意義。在visit2和visit3,心臟毒性組hs-cTnI水平與非心臟毒性組之間比較差異有統計學意義(P<0.05)。隨visit2到visit3的時間變化,心臟毒性組hs-cTnI水平呈進行性、大幅度上升,且比較差異有統計學意義(P<0.01)。這說明hs-cTnI水平可反映蒽環類和曲妥珠單抗藥物導致的心臟毒性作用,且hs-cTnI(visit2)水平高的患者曲妥珠單抗治療后更易發生心臟毒性。心臟毒性組與非心臟毒性組的NT-proBNP水平(visit2)比較差異無統計學意義,然而hs-cTnI(visit2)水平兩組比較差異有統計學意義(P<0.05),這點說明NT-proBNP未能較早期反映蒽環類抗生素導致的心臟毒性。在visit3,NT-proBNP水平兩組比較,差異有統計學意義(P<0.01),隨visit2到visit3 的時間變化,心臟毒性組NT-proBNP水平升高明顯,組內比較差異有統計學意義(P<0.05),表明NT-proBNP可以反映曲妥珠單抗治療后導致的心臟毒性作用(表1)。
2.3 血清hs-cTnI和NT-proBNP濃度水平對心臟毒性的預測價值 根據表1結果,以visit3的血清hs-cTnI和NT-proBNP濃度水平進行ROC曲線分析,可見N-proBNP 的預測價值不大,而hs-cTnI的曲線下面積(0.964)、特異度(92.08%)和敏感性(93.75%)均很高,故認為,當hs-cTnI>1373.2 pg/ml時可作為曲妥珠單抗心臟毒性的早期預測生物標志物(表2)。
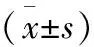
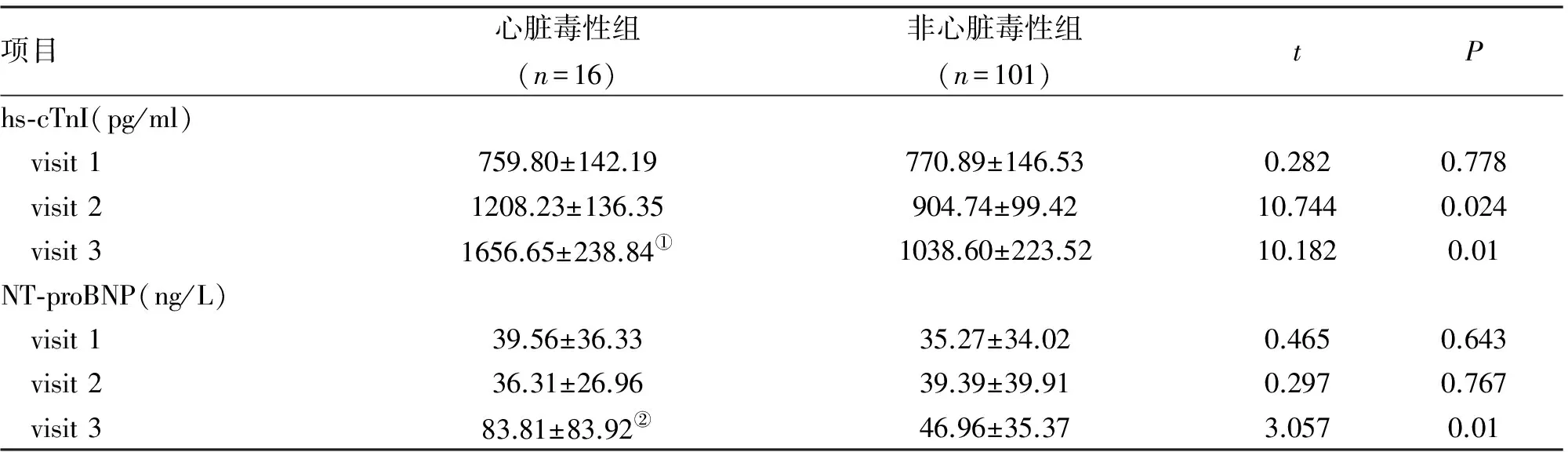
項目心臟毒性組(n=16)非心臟毒性組(n=101)tPhs?cTnI(pg/ml) visit1759.80±142.19770.89±146.530.2820.778 visit21208.23±136.35904.74±99.4210.7440.024 visit31656.65±238.84①1038.60±223.5210.1820.01NT?proBNP(ng/L) visit139.56±36.3335.27±34.020.4650.643 visit236.31±26.9639.39±39.910.2970.767 visit383.81±83.92②46.96±35.373.0570.01
注:與Visit 2比較, ①P<0.01 ②P<0.05
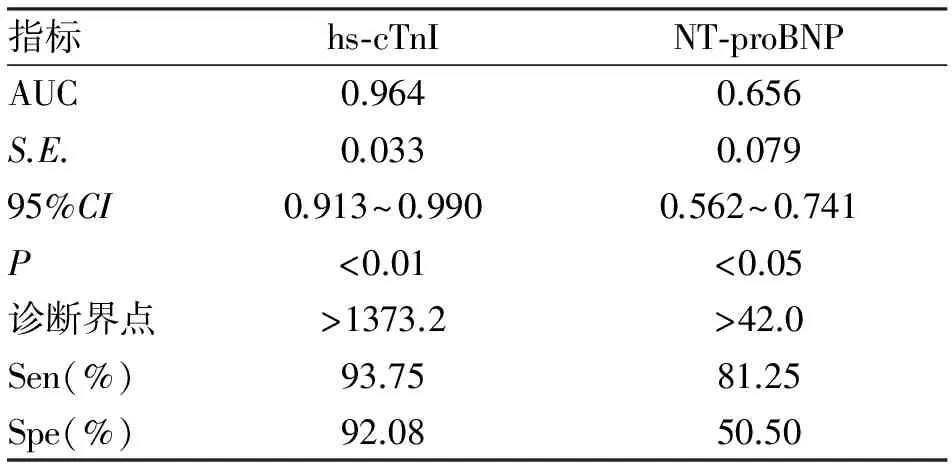
表2 早期乳癌患者血清hs-cTnI和 NT-proBNP對心臟毒性的預測價值
3 討 論
蒽環類藥物一直是抗腫瘤輔助化療的基石,也是引起心臟毒性最主要的化療藥物,其分子機制主要是產生氧自由基,從而破壞心肌細胞膜脂質、蛋白質、脫氧核糖核酸結構導致心肌細胞永久性損傷及死亡,嚴重后果是發展成左心室功能不全,甚至衰竭[10]。有些學者認為,蒽環類藥物導致的左心室功能損害是不可逆的,但也有研究稱,這種假說有點武斷,因為,只有當心肌細胞的損害達到死亡閾值,才會導致不可逆的左室功能不全。當它的損害沒達到不可逆轉的閾值,心肌細胞驚人的休眠能力,可能會發生可逆性修復[11]。曲妥珠單抗是Her-2過表達乳腺癌的主要靶向治療藥物,其分子機制主要是與心肌細胞的Erb2的細胞外結構域結合,阻斷心肌細胞的Erb2-Erb4保護及生長促進途徑[12,13]。曲妥珠單抗所致心臟毒性常在治療開始3個月后出現,表現為伴有或不伴有癥狀的左心衰。這種心肌損害通常是可逆的,因為它涉及的是心肌細胞收縮力的損失,而非心肌細胞的破環,它既不是累積性的,也不是劑量依賴性的[14,15]。因此,在臨床上應區分抗腫瘤藥物的可逆性與不可逆性心功能不全。事實上,達到最小化心臟毒性的最佳途徑將依賴心肌損害早期發現和及時的心臟干預措施。
在許多化療相關心臟毒性的研究中,已證實超聲心動圖測量左室射血分數來預測心臟毒性的方法是不恰當的。而血清生物標志物或許是一種有效的預測手段,肌鈣蛋白和B型尿鈉肽是目前研究的熱點。肌鈣蛋白包括肌鈣蛋白I、肌鈣蛋白C和肌鈣蛋白T 3個亞基,當心肌細胞膜破壞時,肌鈣蛋白才能釋放入血,其中肌鈣蛋白I心臟特異性高達100%,敏感性也高達90%以上,為檢測心肌損傷的金標準生物標志物。B型尿鈉肽,是具有生物活性的天然激素,當左心室功能不全時,由于心肌擴張而由心肌細胞快速合成釋放入血。由于其在正常人濃度極低,故B型尿鈉肽水平的變化是評價心力衰竭的最好指標[16]。
評估血清生物標志物的對心臟毒性的預測價值主要集中在蒽環類藥物治療的患者,隨著曲妥珠單抗導致心臟毒性的報道越來越多,曲妥珠單抗相關心臟毒性的研究引起了關注,筆者研究分析了hs-cTnI和 N-proBNP 在曲妥珠單抗相關心臟毒性的預測價值,發現NT-proBNP在曲妥珠單抗相關的心臟毒性的預測價值很小。與Fallah-Rad N、Sawaya H等人,在接受蒽環類藥物治療的乳腺癌患者中的研究結果一致[17]。但也有研究顯示,BNP的連續監測,可能是心臟預測毒性高風險患者的一個有效工具,甚至在正常的LVEF情況下,BNP的高水平可以提示亞臨床心肌應變[18-20]。目前,在hs-cTnI與化療相關心臟毒性的研究結論中,有著不同的觀點,多數學者認為cTnI水平與蒽環類化療藥物的心臟毒性相關[21-23]。本研究除得出了以上的結論外,并進一步證實了hs-cTnI水平與曲妥珠單抗治療心臟毒性密切相關。在曲妥珠單抗治療前,hs-cTnI水平較高的患者易發生心臟毒性,hs-cTnI水平在治療期間呈進行性、大幅度升高,且hs-cTnI水平>1373.2 pg/ml是隨后發生心臟毒性的高危患者。
本研究結果有重要的臨床意義,但也有一定的局限性。首先研究樣本有限,不能充分評估所有潛在的混雜因素的影響,有待進一步研究。此外,未能清楚區分發生的心臟毒性事件是繼發于哪種藥物,蒽環類藥物或曲妥珠單抗或者兩者的聯合,因此在接受單種藥物治療的患者中的研究是必要的。盡管如此,筆者認為hs-cTnI可以作為一個預測曲妥珠單抗的心臟毒性的早期敏感指標在臨床上推廣。臨床醫師在接診曲妥珠單抗治療的患者中,應進行密切的肌鈣蛋白監測,篩選出發生心臟毒性作用的高危患者,并監視心功能變化,必要時,心內科醫師介入采取積極的心臟保護措施。
[1] Seidman A, Hudis C, Pierri M K,etal. Cardiac dysfunction in the trastuzumab clinical trials experience[J]. J Clin Oncol,2002,20(5):1215-1221.
[2] Yeh E T, Bickford C L. Cardiovascular complications of cancer therapy: incidence, pathogenesis, diagnosis, and management[J]. J Am Coll Cardiol,2009,53(24):2237-2247.
[3] Slamon D, Eiermann W, Robert N,etal. Adjuvant trastuzumab in HER2-positive breast cancer[J]. N Engl J Med, 2011,365(14):1273-1283.
[4] Slamon D, Eiermann W, Robert N,etal. Adjuvant trastuzumab in HER2-positive breast cancer[J]. N Engl J Med, 2011,365:1273-1283.
[5] Guarneri V, Lenihan D J, Valero V,etal. Long-term cardiac tolerability of trastuzumab in metastatic breast cancer: The MD anderson cancer center experience[J]. J Clin Oncol,2006, 24(25):4107-4115.
[6] Roth H J, Leithauser R M, Doppelmayr H,etal. Cardiospecificity of the 3rd generation cardiac troponin T assay during and after a 216 km ultra-endurance marathon run in Death Valley[J]. Clin Res Cardiol,2007,96(6):359-364.
[7] Kurz K, Voelker R, Zdunek D,etal. Effect of stress-induced reversible ischemia on serum concentrations of ischemiamodified albumin, natriuretic peptides and placental growth factor[J]. Clin Res Cardiol,2007,96(3):152-159.
[8] Mackey J R, Clemons M, Cté M A,etal. Cardiac management during adjuvant trastuzumab therapy: recommendations of the Canadian Trastuzumab Working Group[J]. Curr Oncol,2008,15:24-35.
[9] Seidman A, Hudis C, Pierri M K,etal. Cardiac dysfunction in the trastuzumab clinical trials experience[J]. J Clin Oncol,2002,20(5):1215-1221.
[10] 張瑞生.關注抗腫瘤治療的心血管毒性[J].中國心血管雜志,2016,21(5):359-362.
[11] Hilmer S N, Cogger V C, Muller M,etal. The hepatic pharmacokinetics of doxorubicin and liposomal doxorubicin. Drug Metab[J]. Dispos,2004,32(8):794-799.
[12] Slamon D J, Leyland-Jones B, Shak S,etal. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N. Engl[J]. J Med,2001,344(11):783-792.
[13] Morris P G,Hudis C A. Anthracyclines and trastuzumab,getting to the heart of the matter: when getting to the heart is the matter[J].Breast Cancer Res Treat,2011,127(2):585-586.
[14] Ewer M S, Vooletich M T, Durand J B,etal. Reversibility of trastuzumab-related cardiotoxicity: new insights based on clinical course and response to medical treatment[J]. J Clin Oncol, 2005,23(31):7820-7826.
[15] 彭 毅,譚文勇.抗腫瘤治療相關的心臟血管毒性:腫瘤心臟病學亟待跟進[J].臨床與病理雜志,2015,35(3):433-443.
[16] 局 亮,尹 佳.評價藥物早期心臟毒性的生物標記物研究進展[J].藥物評價研究,2015,38(5):563-569.
[17] Sawaya H, Sebag I A, Plana J C,etal. Early detection and prediction of cardiotoxicity in chemotherapy-treated patients[J].Am J Cardiol,2011,107(9):1375-1380.
[18] Pichon M F, Cvitkovic F, Hacene K,etal. Drug-induced cardiotoxicity studied by longitudinal B-type natriuretic peptide assays and radionuclide ventriculography[J].In vivo,2005,19(3):567-576.
[19] Romano S, Fratini S, Ricevuto E,etal. Serial measurements of NT-proBNP are predictive of not-high-dose anthracycline cardiotoxicity in breast cancer patients[J]. Br J Cancer,2011,105(11):1663-1668.
[20] Sandri M T, Salvatici M, Cardinale D,etal. N-terminal pro-B-type natriuretic peptide after high-dose chemotherapy: a marker predictive of cardiac dysfunction[J].Clin Chem,2013,51(8):14.
[21] Lipshultz S E, Scully R E, Lipsitz S R,etal. Assessment of dexrazoxane as a cardioprotectant in doxorubicin-treated children with high-risk acute lymphoblastic leukaemia: long-term follow-up of a prospective, randomised, multicentre trial[J].Lancet Oncol,2010,11(10):950-961.
[22] Cardinale D, Colombo A, Lamantia G,etal. Anthracycline-induced cardiomyopathy: clinical relevance and response to pharmacologic therapy[J].J Am Coll Cardiol,2010,55(3):213-220.
[23] Cardinale D, Sandri M T, Colombo A,etal. Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy[J].Circulation,2004,109(22):2749-2754.
(2017-03-21收稿 2017-06-10修回)
(責任編輯 張 楠)
Value of hs-cTnI and NT-proBNP in prediction of trastuzumab-induced cardiotoxicty
GUO Yanli1,2, XUE Jian1,LI Jun1, ZHENG Benxian2,FENG Xia2,and ZHANG Xiaozhong1.
1. Department of Cardiology, Affiliated Hospital of Academy of Military Medical Sciences,Beijing 100071,China;2. No. 61 Research Institute of Equipment Development,Academy of Military Sciences, Beijing 100141,China
Objective To evaluate the predictive value of cardiac troponin I (hs-cTnI) and N terminal brain natriuretic peptide (NT-proBNP) for cardiac toxicity induced by trastuzumab.Methods Clinical data on 117 patients with breast cancer treated in our hospital with anthracycline chemotherapy and sequential therapy of trastuzumab was collected. At baseline (visit1),before administration of anthracycline (visit2), 3 months into the administration of trastuzumab and paclitaxel(visit3), 6 months into the administration of trastuzumab,hs- cTnI and NT-proBNP levels were detected.The follow-up was 15 months. Echocardiography and questionnaires were used every three months(a total of 6 times).The patients were divided into two groups according to the diagnostic criteria of cardiac toxicity to assess the predictive value of hs-cTnI and NT-proBNP in the cardiac toxicity of trastuzumab.Results There were 16 cases of cardiac toxicity. and the difference in hs-cTnI levels at Visit2 and Visit3 was statistically significant between the cardiac toxicity group and the non cardiac toxicity group (P<0.05), while levels of NT-proBNP were significantly different between the two groups only 3 months into trastuzumab treatment(P<0.01). ROC curve analysis of the serum hs-cTnI and NT-proBNP concentrations suggested that the AUC, specificity and sensitivity of hs-cTnI were quite good.Conclusions hs-cTnI can serve as a predictive biomarker of cardiac toxicity s induced by trastuzumab.
high-sensitivity troponin I; N terminal brain natriuretic peptide; cardiac toxicity; predictive value
郭艷麗,碩士,主治醫師。
1.100071 北京,軍事醫學科學院附屬307醫院心內科;2.100141 北京,軍事科學院第61研究所門診部
張孝忠,E-mail:zxzz947136@163.com
R737.9

