單倍型相合造血干細胞移植治療惡性血液病與人類白細胞抗原相合同胞移植療效相當
高欣寶,溫樹鵬,邢麗娜,牛志云,王 穎,王福旭,張學軍
(河北醫科大學第二醫院 血液科,河北 石家莊 050000)
·論著·
單倍型相合造血干細胞移植治療惡性血液病與人類白細胞抗原相合同胞移植療效相當
高欣寶,溫樹鵬,邢麗娜,牛志云,王 穎,王福旭,張學軍
(河北醫科大學第二醫院 血液科,河北 石家莊 050000)
目的 對單倍型相合造血干細胞移植(Haplo-SCT)及人類白細胞抗原相合同胞造血干細胞移植(humanleukocyteantigenmatchedsiblingdonortransplantation,MSDT)治療惡性血液病進行臨床觀察,對比分析兩者療效。方法 回顧性分析2012年7月至2016年12月在我院接受異基因造血干細胞移植的惡性血液病患者58例,Haplo-SCT組33例,同期MSDT組25例,分析影響移植后生存的相關危險因素。結果 ①Haplo-SCT組與MSDT組移植后均獲得造血重建。②兩組Ⅱ~Ⅳ度急性移植物抗宿主病(acutegraftversushostdisease,aGVHD)的累積發生率分別為33.3%和24%(P=0.261),Ⅲ~Ⅳ度aGVHD累積發生率分別為18.2%和8%(P=0.611)。③兩組1年無白血病生存(leukemia-freesurvival,LFS)率分別為77%和61%(P=0.211),2年總生存(overallsurvival,OS)率分別為72%和61%(P=0.118)。④多因素分析顯示移植后復發是影響OS的危險因素。結論 對于缺乏HLA相合同胞供者的惡性血液病患者而言,單倍型相合供者是可供選擇的干細胞來源。
造血干細胞移植;血液腫瘤;移植物抗宿主病
白血病、骨髓增生異常綜合征(myelodysplasticsyndrome,MDS)、侵襲性淋巴瘤等是威脅人類健康的血液系統惡性腫瘤,早年常以化療為主,然而近20年來異基因造血干細胞移植(allogeneichematopoieticstemcelltransplantation,Allo-HSCT)逐漸成為治療惡性血液病的主要手段,尤其是對于高危患者[1-2],但是由于供者T淋巴細胞與受者不相合的人類白細胞抗原(HLA)產生免疫反應,從而引起了可對器官、組織等造成不同程度損害的移植物抗宿主病(GVHD)[3]。因此HLA相合的親緣供者的移植曾是治療惡性血液病的金標準[4],然而僅有不到1/3的患者能獲得HLA同胞全合供者[5-6],并且伴隨我國特殊生育政策的實施,HLA相合同胞供者更難獲得。對于缺乏全合供者的惡性血液病患者,HLA不全相合的親緣供者可作為干細胞來源[7],多于90%的患者可找到相應供者,如父母、子女甚至旁系親屬,這既節省時間,又可使再次回輸供者干細胞及淋巴細胞時容易獲取。因此部分學者們開始探索親緣間單倍體供者移植治療惡性血液病,但由于受當時移植體系的限制,移植后患者常因不能植入、重度GVHD等導致死亡,故單倍型相合僅作為替代供者。現如今隨著移植技術的發展以及抗人胸腺細胞球蛋白(antihumanthymocyteglobulin,ATG)/抗人T淋巴細胞球蛋白(rabbitanti-humanT-lymphocyteimmunoglobulin,ATG-F)在移植中的使用,打破了這一瓶頸,單倍體移植大獲成功。
目前,HLA不全相合的Allo-HSCT以及Allo-HSCT后急、慢性GVHD的防治成為研究主題。本研究對單倍型相合供者造血干細胞移植(Haplo-SCT)患者與HLA同胞全相合移植(MSDT)患者進行隨訪觀察,分析兩組間療效差異及影響Allo-HSCT后生存的危險因素。
1 資料與方法
1.1 病例選擇 2012年7月至2016年12月河北醫科大學第二醫院血液內科病區因患惡性血液病行Allo-HSCT患者共58例,其中33例為Haplo-SCT,25例為MSDT。Haplo-SCT組中,男18例,女15例,年齡6~54歲,中位年齡48歲;急性髓細胞白血病(AML)13例,急性淋巴性細胞白血病(ALL)11例,其中Ph染色體(philadelphiachromosome)陽性4例;2例慢性粒細胞白血病(CML)加速期、1例CML急淋變;4例MDS中,RCMD亞型1例、RAEB-Ⅰ亞型1例、RAEB-Ⅱ亞型2例,IPSS-R分期均為高危及以上;急性混合細胞白血病(mixedphenotypeacuteleukemia,MAL)伴Ph染色體陽性1例;T淋巴母細胞淋巴瘤1例。MSDT組中,男11例,女14例,年齡23~57歲,中位年齡39歲;AML9例,ALL8例,其中Ph陽性1例;CML加速期2例、慢性期1例;MDS3例,RCMD伴骨髓纖維化1例,RAEBⅠ、Ⅱ亞型各1例,IPSS-R分期均為高危;漿細胞白血病(plasmacellleukemia,PCL)1例。所有患者均通過細胞形態學、分子生物學及細胞遺傳學等檢查確診,符合惡性血液病診斷標準[8]。
根據患者移植前原發病狀態分為穩定期和進展期:將AML-CR1、CR2,ALL-CR1,CML慢性期,MDS-RA型,MAL、PCL-CR1定義為穩定期;其他為進展期[9]。Haplo-SCT組穩定期為17例(51.5%),MSDT組穩定期16例(64%)。Haplo-SCT33例中,1~2點位不合1例(3%),3~4點位不合12例(36.4%),余為5個點位不合(60.6%)。供受者及家屬充分知情并簽署相關知情同意書。
1.2 預處理方案Haplo-SCT組主要以阿糖胞苷(Ara-C)+白消安(Busulfan,Bu)+環磷酰胺(Cyclophosphamide,CTX)+ATG/ATG-F+司莫司汀(Me-CCNU)為主,ATG和ATG-F用量分別為10mg/kg和20mg/kg;MSDT組,若供、受者中年齡≥40歲則加用ATG/ATG-F(7例,28%),用量分別為5mg/kg和10mg/kg;個別患者予全身照射(Totalbodyirradiation,TBI)+CTX或Bu+CTX+依托泊苷(VepesideVP-16)+ATG方案。
1.3 干細胞動員、采集和回輸 兩組多數患者采用骨髓+外周干細胞,少數患者單獨用外周干細胞進行移植;動員劑常用重組人粒細胞集落刺激因子(Granulocytecolony-stimulatingfactor,G-CSF),以5~10μg/(kg·d)皮下注射,常規動員5天;于第4天在腰硬聯合麻醉下行骨髓采集,采集量800~1 000ml,采髓期間回輸自體血800ml,晶體液2 000ml,目標單個核細胞數(mononuclearcell,MNC)計數>2×108/kg;外周干采集量200ml/次,1~2次,目標MNC>3×108/kg。供受者ABO血型相合者直接回輸,不合的去紅細胞和去血漿后立即回輸。骨髓+外周干細胞CD34+計數達到2×106/kg。
1.4GVHD的預防及治療 急、慢性GVHD的診斷和分級符合西雅圖Przepiorka等[10]、Filipovich等[11]標準。常規預防采用嗎替麥考酚酯(MMF)+環孢素A(CsA)+短療程甲氨蝶呤(MTX),若患者出現急性移植物抗宿主病(acutegraftversushostdisease,aGVHD),首先調整CsA用量,同時予甲潑尼龍1~2mg/kg,3天后如果病情進展或5~7天后癥狀未緩解,則聯合二線藥物,如益賽普(注射用重組人Ⅱ型腫瘤壞死因子受體抗體融合蛋白)、抗CD25單克隆抗體(巴利昔單抗)等。
1.5 其他并發癥的防治及支持治療 移植患者均入住層流病房,口服聯磺甲氧芐啶片、氟康唑、鹽酸小檗堿、諾氟沙星等預防感染;靜脈予前列地爾預防肝靜脈閉塞癥(hepaticveno-occlusivedisease,VOD);移植過程中應用水化、堿化及美司鈉預防出血性膀胱炎(hemorrhagiccystitis,HC);別嘌醇片、苯妥英鈉預防其他藥物不良反應;血制品需經25Gy輻照后輸注;定期檢測感染性指標。
1.6 觀察指標 干細胞回輸后中性粒細胞連續3天>0.5×109/L為中性粒細胞植入;連續7天不輸注血小板,其計數>20×109/L的第1天為血小板植入。移植后15天骨髓細胞形態學檢查及移植后嵌合狀態動態分析;30天除上述檢查外,需檢測微小殘留病、移植后免疫重建,供受者性別、血型不合需檢測性染色體錯配、ABO血型等。所有病例定期隨訪,觀察終止時間為患者死亡時間或截止至2016年12月底。兩組療效指標包括急、慢性GVHD累積發生率、總生存(OS)率、移植相關死亡率(transplant-relatedmortality,TRM)、無白血病生存(LFS)率、復發率(relapserate,RR)及影響OS的危險因素。
1.7 統計學方法 采用SPSS19.0統計軟件分析,計數資料及兩樣本均數用t檢驗;計數資料用χ2檢驗;Kaplan-Meier計算GVHD累積發生率、生存率、生存曲線;組間生存比較應用Log-Rank檢驗;對影響OS的多因素分析采用Cox比例風險回歸。P<0.05為差異有統計學意義。
2 結 果
2.1 基線資料比較 兩組性別、年齡、移植前疾病種類及狀態、供受者性別匹配、輸注MNC、CD34+細胞數等方面差異無統計學意義(P>0.05)。但兩組在預處理方案是否加用ATG,差異有統計學意義(P<0.01),Haplo-SCT組均加用ATG或ATG-F,而MSDT組僅7例(28%)使用ATG或ATG-F,見表1。
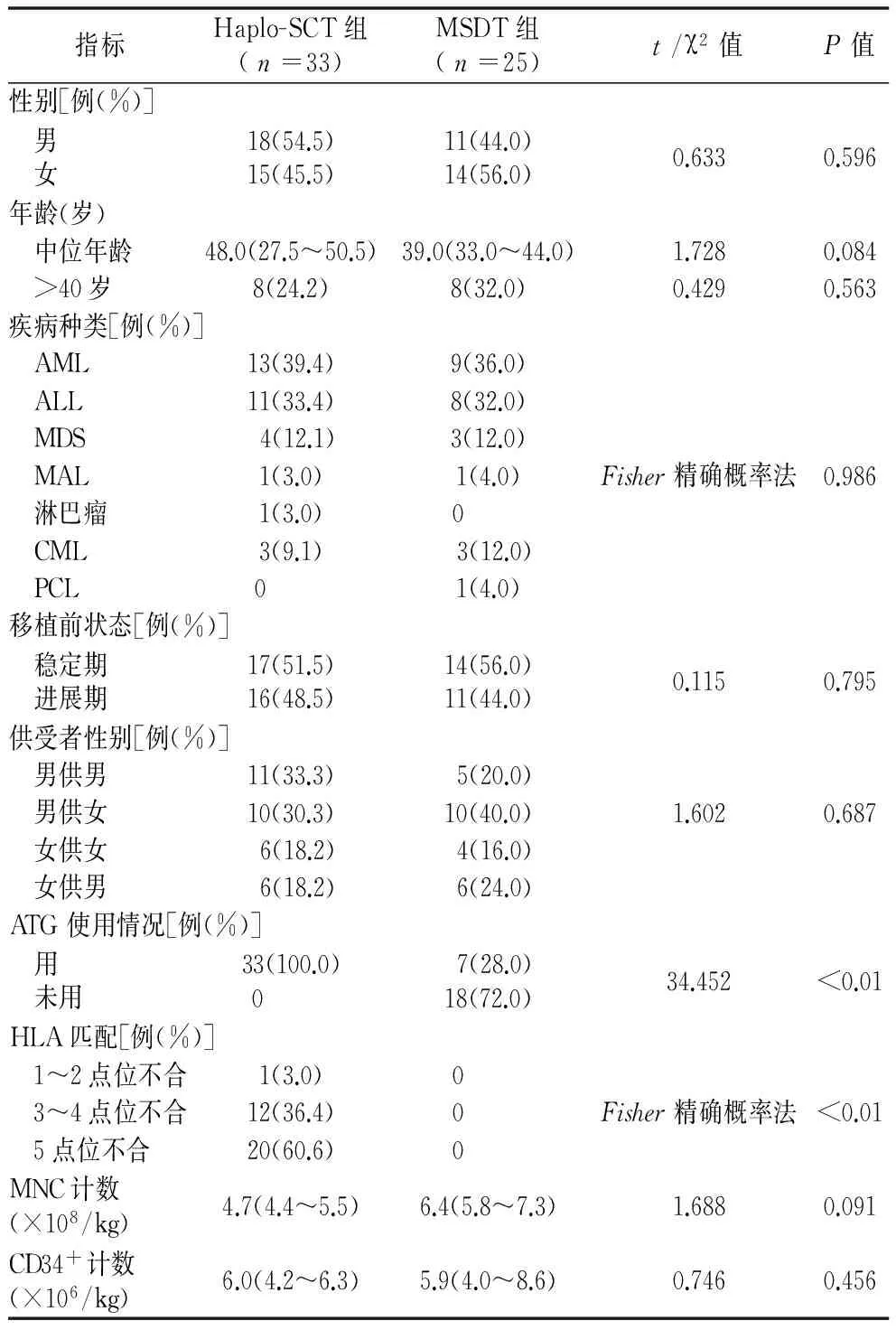
表1 兩組基線資料比較
2.2 造血重建Haplo-SCT組與MSDT組中性粒細胞植入率分別為97%(32/33)和100%(P>0.05),Haplo-SCT組中有1例患者,移植后出現消化道出血,后粒細胞、血小板均不能植入,于移植后25天死亡(不納入統計),中性粒細胞植入的中位時間分別為11(8~19)天、11(9~19)天,兩組差異無統計學意義(P=0.203)。兩組血小板的植入率分別為97%(32/33)和92%(23/25)(P>0.05),MSDT組中2例血小板未植入患者中,其中1例移植后>28天尚未植入,后因aGVHD死亡,1例于移植后19天死于感染(不納入統計)。血小板植入中位時間分別為15(10~28)天、12(6~22)天,兩組差異無統計學意義(P=0.416)。
2.3GVHD的累積發生率Haplo-SCT組33例中11例發生Ⅱ~Ⅳ度aGVHD,累積發生率為33.3%,供受者類型中:男供女5例、男供男5例、女供男1例,父母供子女3例、子女供父母3例、同胞類型供者5例(均為年幼供年長);11例患者中多數發生于腸道(9例),其余2例為皮膚型GVHD。Ⅲ~Ⅳ度aGVHD的累積發生率為18.2%(6/33),其中男供女2例、男供男3例、女供男1例,父母供子女1例、子女供父母2例、同胞類型供者3例(均為年幼供年長);6例患者均有腸道aGVHD。在移植后100天以上的患者中,cGVHD發生率為30%(9/30),其中廣泛型3例,局限型6例。
MSDT組25例中發生Ⅱ~Ⅳ度aGVHD6例,累積發生率為28%,供受者類型中:男供女2例、男供男2例、女供男2例,長供幼2例、幼供長4例;6例均有腸道GVHD表現。發生Ⅲ~Ⅳ度aGVHD2例,累積發生率為8%,男供女1例、女供男1例,幼供長2例;其中1例為腸道GVHD,1例為腸道、皮膚、肝臟多器官損害,2例均死于aGVHD。在移植后100天以上的患者中,8例發生cGVHD,發生率為36.4(8/22),其中廣泛型3例,局限型5例。兩組aGVHD與cGVHD的累積發生率比較差異無統計學意義(P>0.05),見圖1、2。
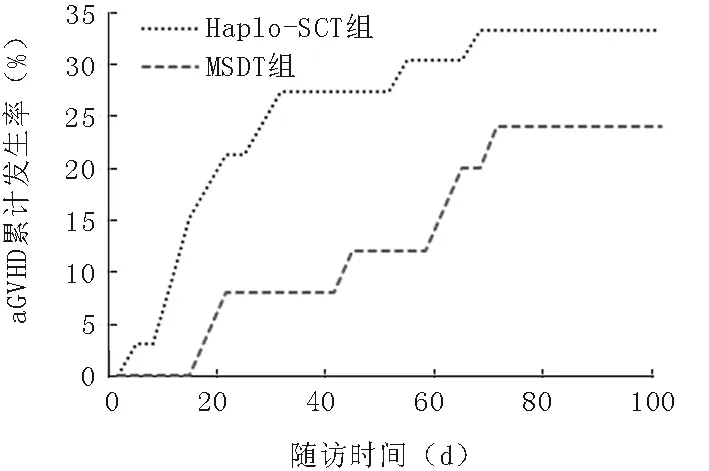
圖1 兩組Ⅱ~Ⅳ度aGVHD的累積發生率比較(P=0.261)
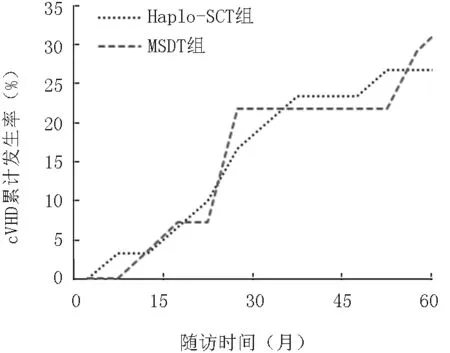
圖2 兩組cGVHD的累積發生率比較(P=0.629)
2.4 移植后病毒感染累積發生率Haplo-SCT組與MSDT組EB病毒(Epstein-Barrvirus,EBV)血癥的累積發生率分別為51.5%和20.0%(P=0.028),巨細胞病毒(Cytomegalovirus,CMV)血癥的發生率分別為75.8%和40%(P=0.007)。Haplo-SCT組EBV、CMV的發生率明顯高于MSDT組。
2.5 原發病復發情況 隨訪至2016年12月末,Haplo-SCT組中7例(21.2%)復發,其中診斷為AML3例:AML-M7CR2 1例、AML-M2 2例,均于移植前基因學復發;ALL患者2例:ALLCR3 1例,存在中樞神經系統浸潤、Ph染色體陽性ALL1例;CML患者2例:1例CML急淋變、1例CML加速期;供受者類型:男供女1例、男供男4例、女供男2例,父母供子女3例、子女供父母3例、弟供兄1例;這7例患者移植前原發病均為進展狀態;其中3例患者已死于原發病復發,1例予聯合化療后再緩解。
MSDT組復發6例(24%),AML-M2 3例:移植前復發(原始細胞3%)1例、CR2 1例、血液學緩解(hematologicalcompleteremission,HCR)1例;ALL2例;MAL1例;供受者類型:男供女2例、男供男2例、女供男1例、女供女1例,長供幼2例、幼供長4例;6例患者中4例移植前疾病狀態為進展期,其中已有4例患者因復發死亡,AML-M2(伴AML1-ETO融合基因陽性)1例,移植后3個月復發,后經淋巴細胞輸注(DLI)治療,隨后出現DLI相關GVHD,且原發病仍為復發狀態,于移植后約6.2個月死亡,另1例AML-CR2(伴AML1-ETO融合基因陽性)經過2次供者淋巴細胞回輸(donorlymphocyteinfusion,DLI)后緩解。MSDT組原發病復發率略高于Haplo-SCT組,但差異無統計學意義(P=0.801),見圖3。
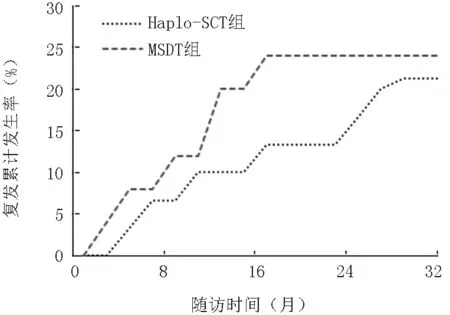
圖3 兩組復發累積發生率比較(P=0.801)
2.6 移植相關死亡及相關并發癥Haplo-SCT組中,因GVHD、VOD、感染、臟器功能衰竭等移植相關死亡共5例(15.2%),其中因感染死亡1例,因GVHD死亡2例,因消化道出血及VOD各1例;MSDT組中移植相關死亡6例(24%),因感染死亡3例,因GVHD死亡3例;兩組TRM率差異無統計學意義(P=0.504)。Haplo-SCT組中發生VOD、HC、純紅細胞再生障礙性貧血(Pureredcellaplasia,PRCA)、毛細血管滲漏綜合征(capillaryleaksyndrome,CLS)等移植早期并發癥12例(36.4%),其中HC的發生率過半,為58.3%(7/12),發生PRCA2例(16.7%),CLS1例,2例VOD中1例因此死亡。MSDT組發生相關并發癥3例(12%),均為HC;Haplo-SCT組移植早期并發癥發生率高于MSDT組,且差異有統計學意義(P=0.036)。
2.7 生存分析Haplo-SCT組隨訪生存中位時間為25個月,1年LFS率為77.0%,2年OS率為72.0%;MSDT組隨訪中位時間為16個月,1年LFS率為61.0%(P=0.211),2年OS率為61.0%(P=0.118);Haplo-SCT組LFS率及OS率均略高于MSDT組,但差異無統計學意義,見圖4、5。對于移植前處于穩定期患者,Haplo-SCT組與MSDT組2年OS率分別為94%和76.0%(P=0.323),而處于進展期患者Haplo-SCT組與MSDT組2年OS率僅為54.0%和44.0%(P=0.482);由此可見穩定期患者比進展期患者更有生存優勢,見圖6、7。
單因素分析結果顯示,移植前疾病狀態、原發病復發、aGVHD與OS密切相關(P<0.05),進一步行多因素COX比例風險模型分析結果顯示,移植后原發病復發是OS的危險性因素(P=0.033),其他各指標對OS無明顯影響,差異無統計學意義。見表2。

圖4 兩組無白血病生存率比較(P=0.777)
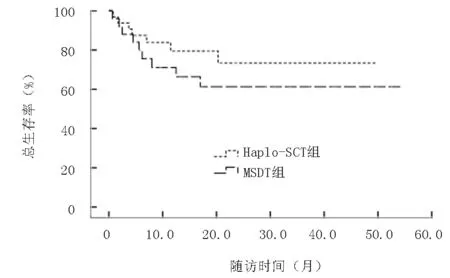
圖5 兩組總生存率比較(P=0.330)
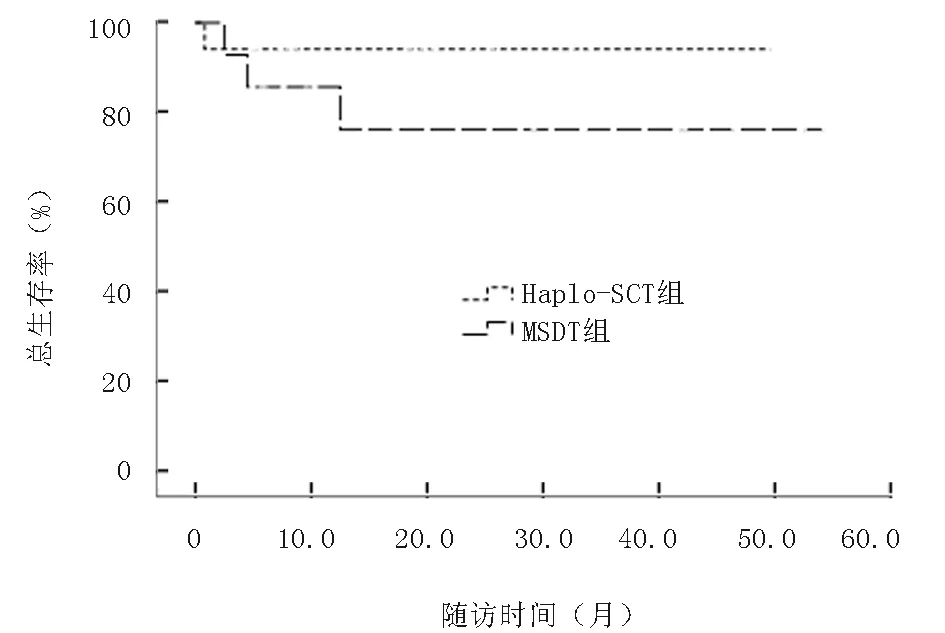
圖6 兩組穩定期總生存率比較(P=0.323)
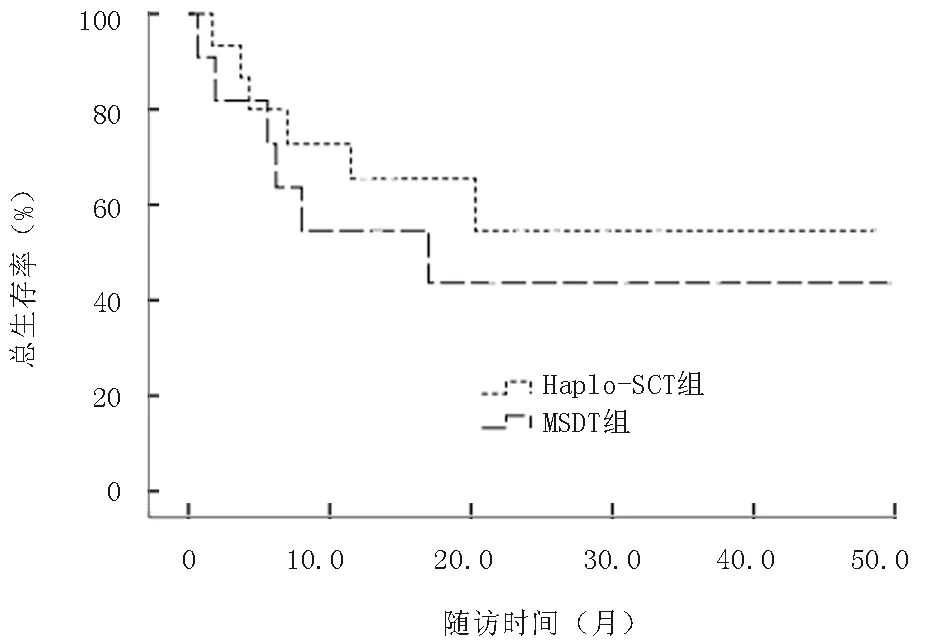
圖7 兩組進展期總生存率(P=0.482)
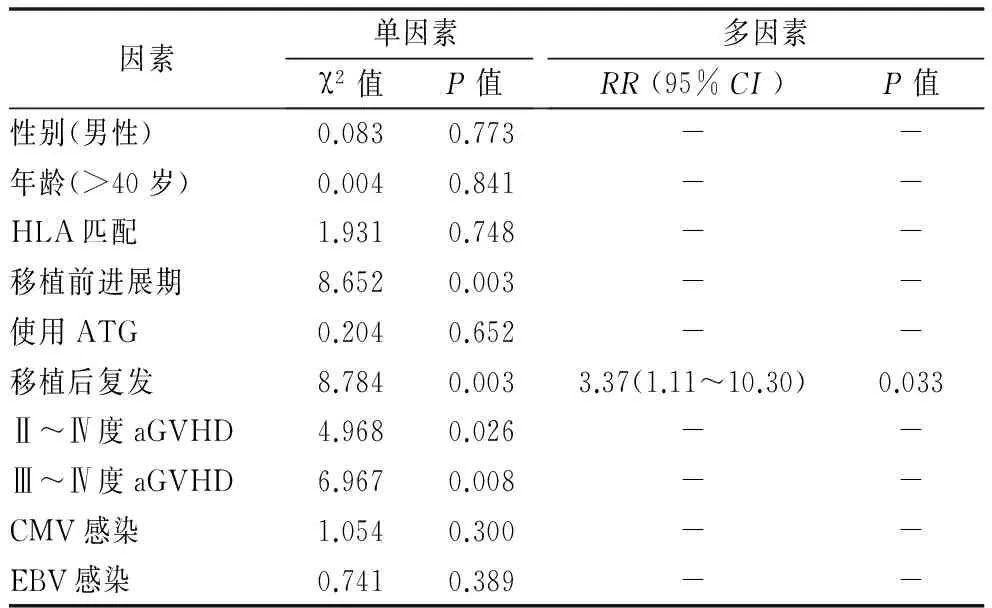
因素單因素χ2值P值多因素RR(95%CI)P值性別(男性)0.0830.773--年齡(>40歲)0.0040.841--HLA匹配1.9310.748--移植前進展期8.6520.003--使用ATG0.2040.652--移植后復發8.7840.0033.37(1.11~10.30)0.033Ⅱ~Ⅳ度aGVHD4.9680.026--Ⅲ~Ⅳ度aGVHD6.9670.008--CMV感染1.0540.300--EBV感染0.7410.389--
3 討 論
Allo-HSCT是治愈惡性血液病并使患者長期獲益的有效手段,甚至是唯一手段。但由于HLA基因產物可產生GVHD,HLA相合同胞移植可減少發生GVHD的風險及嚴重程度,但同胞全合供者來源較少、無關供者等待時間長;然而隨著移植技術的發展,Haplo-SCT由于供者來源廣泛,且安全性及有效性不斷提高,加上移植方式的改善,越來越多的應用于臨床。本研究旨在對比親緣Haplo-SCT與MSDT在治療惡性血液病時療效及可能影響HSCT后生存的危險因素。
本研究結果顯示,Haplo-SCT組與MSDT組在造血重建、急、慢性GVHD發生率、移植后復發率、TRM、OS率及LFS率方面的差異無統計學意義(P均>0.05)。而兩組在EBV、CMV發生率及移植早期并發癥的發生率上差異有統計學意義,Haplo-SCT組發生率均高于MSDT組。此外,在多因素分析中,移植后原發病復發是影響OS的獨立危險因素。
本研究中兩組GVHD發生率、OS率及LFS率差別無統計學意義,這與早年陸道培等[12]研究相符,該研究將135例Haplo-SCT與158例MSDT相比較,并在Haplo-SCT組中加入ATG,結果所有患者均成功植入,兩組在aGVHD發生率、TRM、移植后復發率上差別均無統計學意義,兩組OS分別為71%、72%(P>0.05),2年LFS分別為64%、71%(P>0.05)。也與近年Wang及Chang等[13-14]的報道相似。以往認為Haplo-SCT具有植入失敗率高,造血、免疫重建延遲、GVHD發生率高等特點[15-16],然而現在能與MSDT療效相當,這很可能是由于通過G-CSF動員過的移植物及在預處理中加入了ATG或其他免疫抑制劑的聯合應用, 跨越了人類HLA的異基因屏障,使得Haplo-SCT在較短的時間內達到造血重建[9,17]。在本研究中,Haplo-SCT組LFS及OS均略高于MSDT組,且Haplo-SCT組移植后復發率也略低于MSDT組,但差異并無統計學意義,可能與納入統計的病例數較少有關,但可以推斷出Haplo-SCT效果與MSDT相當,甚至略優于MSDT組;這一推斷提示我們,Haplo-SCT更適合應用于或者更應該應用于高危的惡性血液病患者,而非MSDT。
值得注意的是,本研究中Haplo-SCT組中EBV、CMV感染發生率明顯高于MSDT組,這與國內相關報道結果相似[18],且該文獻指出,CMV感染是導致繼發性血細胞減少、植入功能不良的獨立危險因素。而導致這一結果的原因可能是由于本研究Haplo-SCT組均在預處理中使用了ATG的緣故。國內外一些研究證實,預處理方案中使用ATG是EBV、CMV感染發生的重要危險因素[19-23],系因ATG具有較長的半衰期及較強的T細胞去除作用,免疫抑制作用強大;而Allo-HSCT預處理過程應用大劑量免疫抑制劑,使機體免疫功能受損,且免疫重建緩慢,病毒被激活。CMV感染是Allo-HSCT后常見合并癥,也是導致患者死亡的主要原因之一[24]。且病毒感染往往能增加GVHD的發生率,二者可相互促進。Jiang等[25]研究證實低劑量ATG可使T細胞較早恢復,從而降低病毒感染發生率;而較高劑量則能更有效的降低GVHD的發生。本研究中還將兩組移植早期并發癥發生率作比較,Haplo-SCT組明顯高于MSDT組,且以發生HC為主(58.3%,7/12);有文獻報道[26-27]HLA不相合、CMV感染、GVHD、應用ATG及供受者性別差異等因素與HC發生密切相關。因此移植后對CMV-DNA、EBV-DNA的監測及對ATG的合適使用劑量的研究頗為重要。這些研究結論提示我們,對于低危、具有MSDT供者、既往有病毒感染史的惡性血液病患者可能更適合MSDT。
此外,在本研究關于影響OS的單因素分析中顯示重度GVHD、移植前原發病為進展狀態及復發是影響OS的危險因素,這與其他中心多樣本研究結果相似[4,9]。并且在本研究的多因素分析中,發現移植后原發病的復發仍是影響HSCT后患者生存的獨立危險因素(RR=3.37, 95%CI=1.11~10.30)。一項新研究顯示[28],移植后復發的危險因素與疾病種類、移植前疾病狀態、誘導緩解的療程等有關,其中ALL患者、移植前疾病為進展狀態及超過1個療程達到緩解的復發率較高。而本研究與之相似,多數復發患者移植前原發病狀態處于進展期。對于高危類型白血病患者移植后復發率可高達50%~70%[29]。因此在移植前應盡量誘導原發病達到CR,減少白血病細胞,以降低患者移植后復發風險。另外及時的逐漸減少免疫抑制劑的用量以及預防性的進行DLI,均可降低復發風險,延長生存期。本研究中,Haplo-SCT組復發率略低于MSDT組,這可能與Haplo-SCT在免疫重建后產生的移植物抗白血病效應(GVL)可殺傷白血病細胞有關。但是,與DLI一樣,在增強GVL作用的同時往往可引起嚴重的GVHD、骨髓抑制等,這也是影響生存的因素。我國學者[29-33]對此作了進一步探索,將G-CSF動員后的供者外周干細胞進行回輸,而非單純的淋巴細胞回輸,隨后予CSA、MTX預防DLI相關的GVHD,此法取得了較好療效,提高了患者的生存率;而且將其與化療聯合應用可使移植后復發再緩解率達64%。
本研究初步結果表明,Haplo-SCT與MSDT在治療惡性血液病時療效差異無統計學意義,對于高危的惡性血液病患者,在現有移植體系下,進行Haplo-SCT是安全可行的,并且高危患者也更適合進行Haplo-SCT。但Haplo-SCT增加了移植后病毒或細菌、真菌感染的風險,對此我們應提高警惕,定期監測相關指標變化以及積極預防尤為重要。此外,為減少移植后復發,提高生存率,移植前應盡量使患者在移植前處于CR狀態。本研究旨在通過分析能夠提示在臨床工作中如何選擇更有效的移植方式治療原發病。但本研究為單中心研究,病例數較少。因此需要更多移植中心、更大樣本量的研究。
4 結論
對于缺乏HLA相合同胞供者的惡性血液病患者而言,單倍型相合供者是可供選擇的干細胞來源。
[1]LjungmanP,BregniM,BruneM,etal.Allogeneicandautologoustransplantationforhematologicaldiseases,solidtumoursandimmunedisorders:currentpracticeinEurope2009[J].BoneMarrowTransplant, 2010, 45(2): 219-234.
[2]Xiao-JunH,Lan-PingX,Kai-YanL,etal.HLA-mismatched/haploidenticalhematopoieticstemcelltransplantationwithoutinvitroTcelldepletionforchronicmyeloidleukemia:improvedoutcomesinpatientsinacceleratedphaseandblastcrisisphase[J].AnnMed, 2008,40(6):444-455.
[3] 陳瑤,陸道培,劉開彥. 異基因造血干細胞移植后急性移植物抗宿主病151例危險因素分析[J]. 中華血液學雜志,2005,26(2):13-16.
[4] 王莉紅, 任漢云, 李淵.HLA相合同胞和不全相合血緣關系供者造血干細胞移植的臨床對比研究[J]. 中華血液學雜志, 2008,29 (8):507-511.
[5]AppelbaumFR.Allogeneichematopoieticcelltransplantationforacutemyeloidleukemiawhenamatchedrelateddonorisnotavailable[J].HematologyAmSocHematolEducProgram, 2008:412-417.
[6] 于嗣儉, 戴敏, 孫競, 等.親緣HLA不相合與無關HLA全相合供者造血干細胞移植治療血液腫瘤療效比較[J].中華血液學雜志,2014,35(9): 826-830.
[7] 王福旭. 造血干細胞移植治療高危急性髓細胞白血病的研究進展[J].國際輸血及血液學雜志,2013,36(5): 412-417.
[8] 張之南, 沈悌.血液病診斷及療效標準[M].3版.北京:科學出版社,2007.
[9] 王萌,董玉君,邱志祥. 83例單倍體相合造血干細胞移植治療惡性血液病的臨床療效及預后分析[J]. 中國實驗血液學雜志,2016,24(3):833-839.
[10]PrzepiorkaD,WeisdorfD,MartinP,etal. 1994ConsensusConferenceonAGVHDGrading[J].BoneMarrowTransplant, 1995, 15(6):825-828.
[11]FilipovichAH,WeisdorfD,PavleticS,etal.NationalInstitutesofHealthconsensusdevelopmentprojectoncriteriaforclinicaltrialsinchronicgraft-versus-hostdisease: Ⅰ.diagnosisandstagingworkinggroupreport[J].BiolBloodMarrowTransplant, 2005, 11(12): 945-956.
[12]LuDP,DongL,WuT,eta1.ConditioningincludingantithymocyteglobulinfollowedbyunmanipulatedHLA-mismatched/haploidenticalbloodandmarrowtransplantationcanachievecomparableoutcomeswithHLA-identicalsiblingtransplantation[J].Blood, 2006, 107(8): 3065-3073.
[13]WangY,LiuQF,XuLP,etal.Haploidenticalvsidentical-siblingtransplantforAMLinremission:amulticenter,prospectivestudy[J].Blood, 2015, 125(25): 3956-3962.
[14]ChangYJ,WangY,HuangXJ.Haploidenticalstemcelltransplantationforthetreatmentofleukemia:currentstatus[J].ExpertRevHematol, 2014,7(5): 635-647.
[15] 向茜茜,孔佩艷,李杰平. 親代間單倍體相合造血干細胞移植治療血液病45例臨床分析[J]. 解放軍醫學雜志,2012,37(2):121-125.
[16] 黃河. 以低劑量抗T淋巴細胞免疫球蛋白為基礎、非體外去T細胞的親緣HLA單倍體相合造血干細胞移植與全相合同胞供者移植、非血緣供者移植療效的比較[J].中華內科雜志,2015,54(2):150.
[17] 紀樹荃,陳惠仁,王恒湘.G-CSF預處理供者單倍體相合骨髓移植加用CD25單克隆抗體預防急性GVHD的臨床研究[J]. 中國實驗血液學雜志,2002,10(5):447-451.
[18] 林志娟, 孔圓, 王昱, 等.異基因造血干細胞移植術后繼發性造血細胞減少的危險因素分析[J].中華血液學雜志,2014,35(1): 4-8.
[19] 張永平,胡凱勛,孫琪云,等. 非清髓異基因外周血造血干細胞移植后巨細胞病毒感染的危險因素分析[J].中國實驗血液學雜志, 2014, 22(2): 458-463.
[20]GeorgeB,KerridgeIH,GilroyN,etal.Ariskscoreforearlycytomegalovirusreactivationafterallogeneicstemcelltransplantationidentifieslow-,intermediate-,andhigh-riskgroups:reactivationriskisincreasedbygraft-versus-hostdiseaseonlyintheintermediate-riskgroup[J].TransplInfectDis, 2012, 14(2): 141-148.
[21] 張欽,張斌,陳虎. 造血干細胞移植后EB病毒感染的細胞免疫治療[J]. 中國實驗血液學雜志,2015,23(6):1763-1768.
[22] 陳歡, 劉開彥, 許蘭平, 等.異基因造血干細胞移植后實時定量聚合酶鏈反應在巨細胞病毒感染診斷和治療中的應用[J].中華血液學雜志,2009,30(2): 77-81.
[23] 韓婷婷, 許蘭平, 劉代紅, 等.異基因造血干細胞移植后EB病毒感染情況分析[J].中華血液學雜志,2013,34(8): 651-654.
[24] 劉開彥. 造血干細胞移植患者巨細胞病毒感染的診治進展[J]. 中國實用內科雜志, 2007, 10(27) : 1597-1598.
[25]LiuJ,XuLP,BianZetal.Differentialimpactoftwodoseofantithymocyteglobulinconditioningonlymphocyterecoveryuponhaploidenticalhematopoieticstemcelltransplantation[J].JTranslMed, 2015,13:391.
[26] 張紅宇,黃曉軍,許蘭平,等. 異基因造血干細胞移植后出血性膀胱炎發生率及其危險因素分析[J].中華血液學雜志,2007,28(4).243-246.
[27]RuggeriA,Roth-GuepinG,BattipagliaG,etal.Incidenceandriskfactorsforhemorrhadiccystitisinunmanipulatedhaploidenticaltransplantrecipients[J].TransplInfectDis,2015,17(6):822-830.
[28] 舒曉艷,閆俠芳,董磊. 異基因造血干細胞移植后白血病復發的危險因素分析和治療[J]. 中國實驗血液學雜志,2016,24(4):1137-1142.
[29] 劉代紅,黃曉軍,陳歡. 異基因造血干細胞移植后供者外周血造血干細胞輸注預防高危白血病復發[J]. 中華血液學雜志,2006,29(1):6-9.
[30]HuangXJ,WangY,LiuDH,etal.Modifieddonorlymphocyteinfusion(DLI)fortheprophylaxisofleukemiarelapseafterhematopoieticstemcelltransplantationinpatientswithadvancedleukemia-feasibilityandsafetystudy[J].JClinImmunol, 2008, 28 (4): 390-397.
[31]HuangXJ,WangY,LiuDH,etal.Administrationofshort-termimmunosuppressiveagentsafterDLIreducestheincidenceofDLI-associatedacuteGVHDwithoutinfluencingtheGVLeffect[J].BoneMarrowTransplant, 2009, 44(5): 309-316.
[32]WangY,LiuDH,XuLP,etal.PreventionofrelapseusinggranulocyteCSF-primedPBPCsfollowingHLA-mismatched/haploidentical,T-cell-depletehematopoieticSCTinpatientswithadvancedstageacuteleukemia:aretrospectiverisk-factoranalysis[J].BoneMarrowTransplant, 2012, 47(8): 1099-1104.
[33] 黃河. 異基因造血干細胞移植術后復發防治策略[J]. 中國實用內科雜志,2014,34(2):122-126.
HaploidenticalhematopoieticstemcelltransplantationforhematologicmalignanciesisequivalenttoHLAmatchedsiblingtransplantation
GaoXinbao,WenShupeng,XingLina,NiuZhiyun,WangYing,WangFuxu,ZhangXuejun
DepartmentofHematology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China
WenShupeng,Email:hebih@126.com
ObjectiveTocomparetheclinicalefficacyfortreatmentofmalignanthematologicaldiseaseinhaploidenticalhematopoieticstemcelltransplantation(Haplo-SCT)andhumanleukocyteantigenidenticalsiblinghematopoieticstemcelltransplantation(humanleukocyteantigenmatchedsiblingdonortransplantation,MSDT).MethodsFifty-eightpatientswithhematologicmalignanciesundergoingrelatedhaploidentical(n=33)andHLA-identicalsibling(n=25)inourhospitalwereenrolledforaretrospectiveanalysis.Theclinicalefficacyandrelatedriskfactorsofposttransplantationoverallsurvival(OS)wereanalyzed.Thetherapeuticeffectsofthetwotreatmentsandtheriskfactorsrelatedtooverallsurvival(OS)wereevaluated.Results①Haploidenticalandidenticalsiblingcohortsweresuccessfullyengrafted. ②ThecumulativeincidencesofgradesⅡtoⅣacutegraft-versus-hostdisease(aGVHD)andgradesⅢtoⅣaGVHDinthemismatchedandmatchedcohortswere33.3%versus24%(P=0.261)and18.2%versus8%(P=0.611),respectively. ③One-yearleukemia-freesurvival(LFS)andtwo-yearOSinmismatchedandmatchedcohortswere77%vs61% (P=0.211)and72%vs61% (P=0.118),respectively. ④Multivariateanalysisshowedthatonlyrelapseafterallo-HSCT(P=0.033)wereriskfactorsforOS.ConclusionForpatientswithhematologicalmalignancieslackingmatchedsiblingdonor,HLA-haploidenticaldonorswereanalternativestemcellsource.
haploidenticalstemcelltransplantation;hematologicneoplasms;graft-versus-hostdisease
溫樹鵬,Email:hebih@126.com
R
A
1004-583X(2017)08-0665-07
10.3969/j.issn.1004-583X.2017.08.006
2017-04-11 編輯:張衛國

