化學(xué)平衡中的常見量變規(guī)律及其應(yīng)用
江蘇 李萬春
化學(xué)平衡中的常見量變規(guī)律及其應(yīng)用
江蘇 李萬春
當(dāng)外界條件發(fā)生改變了導(dǎo)致化學(xué)平衡移動(dòng)時(shí),平衡體系的哪些量會(huì)發(fā)生改變?這是化學(xué)平衡部分最重要的考點(diǎn)之一,也是同學(xué)們?nèi)菀壮鲥e(cuò)的問題。下面就此進(jìn)行分析,以澄清大家的一些模糊認(rèn)識。
一、化學(xué)平衡中的常見量變規(guī)律
1.基本平衡量的變化規(guī)律
(1)化學(xué)平衡發(fā)生移動(dòng),一般會(huì)造成化學(xué)反應(yīng)速率、物質(zhì)的平衡濃度和百分含量等都發(fā)生變化,但速率、平衡濃度變了,并不意味著平衡一定發(fā)生移動(dòng)。因此,平衡移動(dòng)與否應(yīng)該看物質(zhì)的百分含量是否改變。
(2)化學(xué)平衡向右移動(dòng),生成物的物質(zhì)的量必定增加。
(3)物質(zhì)的量濃度既與物質(zhì)的量有關(guān),也與體積有關(guān)。因此,只有定容時(shí),平衡向右移動(dòng),生成物的濃度才增加。
(4)物質(zhì)的百分含量既與本身物質(zhì)的量(或氣體體積)有關(guān),也與總的物質(zhì)的量(或氣體總體積)有關(guān)。因此,只有不改變體系總質(zhì)量時(shí),平衡右移,生成物的百分含量才會(huì)增加,即此時(shí)物質(zhì)的量、濃度、產(chǎn)率和百分含量才會(huì)有一致的關(guān)系。
(5)在反應(yīng)混合物總質(zhì)量不變的前提下(如壓強(qiáng)或溫度的變化使化學(xué)平衡移動(dòng)時(shí)),化學(xué)平衡總是各向著平衡混合物某組成成分百分含量增大的方向移動(dòng)。百分含量越大,平衡移動(dòng)的程度越大。
(6)一個(gè)具體反應(yīng)的平衡常數(shù)只與溫度有關(guān),溫度不變時(shí),平衡常數(shù)K不發(fā)生變化。
2.轉(zhuǎn)化率
(1)不改變反應(yīng)物的用量而改變溫度或壓強(qiáng),平衡向正反應(yīng)方向移動(dòng)時(shí),各反應(yīng)物的轉(zhuǎn)化率增大;反之,則減小。
(2)投料比等于氣態(tài)反應(yīng)物的化學(xué)計(jì)量數(shù)之比時(shí),各反應(yīng)物的轉(zhuǎn)化率相同。
(3)投入反應(yīng)物的物質(zhì)的量相同時(shí),各反應(yīng)物的轉(zhuǎn)化率之比等于化學(xué)計(jì)量數(shù)之比。
(4)反應(yīng)達(dá)平衡后,增加一種氣態(tài)反應(yīng)物的量,另一反應(yīng)物的轉(zhuǎn)化率增大,而自身的轉(zhuǎn)化率減小。
(5)恒溫恒容時(shí),同等倍數(shù)地增大(或減少)氣態(tài)反應(yīng)物的量,各反應(yīng)物的轉(zhuǎn)化率同倍數(shù)地增大、減小或不變(由反應(yīng)前后氣態(tài)反應(yīng)物化學(xué)計(jì)量數(shù)的大小決定)。
若a+b=c+d,A、B的轉(zhuǎn)化率不變;
若a+b<c+d,A、B的轉(zhuǎn)化率都減小(或增大);
若a+b>c+d,A、B的轉(zhuǎn)化率都增大(或減小)。
(6)由于加入催化劑不能使化學(xué)平衡移動(dòng),所以不能改變反應(yīng)物的轉(zhuǎn)化率。可逆反應(yīng)的平衡常數(shù)和轉(zhuǎn)化率都可以表示反應(yīng)進(jìn)行的程度,但轉(zhuǎn)化率更直觀一些。對同一反應(yīng),平衡常數(shù)只受溫度的影響,而轉(zhuǎn)化率則會(huì)受濃度、溫度、壓強(qiáng)等很多外界因素的影響。對于一個(gè)可逆反應(yīng),化學(xué)計(jì)量數(shù)不一樣時(shí),平衡常數(shù)表達(dá)式也不一樣,但對應(yīng)物質(zhì)的轉(zhuǎn)化率相同。
3.氣體的平均摩爾質(zhì)量
當(dāng)不增加或減少混合物中各組分的量,只改變溫度或容器的體積等條件時(shí),混合氣體的總質(zhì)量守恒。
①若n(反應(yīng)物)=n(生成物),平均摩爾質(zhì)量不變;
②若n(反應(yīng)物)<n(生成物),平均摩爾質(zhì)量減小;
③若n(反應(yīng)物)>n(生成物),平均摩爾質(zhì)量增大。
(2)對于有固體或純液體參加或生成的可逆反應(yīng),由于有固態(tài)或純液態(tài)物質(zhì)的參加或生成,化學(xué)平衡發(fā)生移動(dòng)時(shí),混合氣體的總質(zhì)量要隨之改變,混合氣體的總物質(zhì)的量也隨之改變,此時(shí)混合氣體的平均摩爾質(zhì)量的變化情況比較復(fù)雜,需要具體討論。
4.密度
(1)當(dāng)氣體的質(zhì)量或體積中有一個(gè)量發(fā)生變化時(shí),密度就會(huì)發(fā)生改變。
(2)當(dāng)濃度或壓強(qiáng)改變時(shí),混合氣體的質(zhì)量或體積就會(huì)發(fā)生改變,則密度改變。
(3)對于反應(yīng)物、生成物均為氣體的可逆反應(yīng),僅是溫度發(fā)生變化時(shí),不管化學(xué)平衡如何移動(dòng),混合氣體的質(zhì)量和體積均不會(huì)改變,所以密度不發(fā)生變化。
5.壓強(qiáng)
壓強(qiáng)影響化學(xué)平衡的實(shí)質(zhì)是:改變反應(yīng)物或生成物的濃度。在一定的條件下,改變氣體的物質(zhì)的量n、體系的溫度T、容器的體積V都能改變壓強(qiáng),但改變n和T不能用壓強(qiáng)影響平衡的原理來解釋。在平衡體系中,加入一種與平衡不相關(guān)的氣體,對平衡有如下兩種影響。
(1)體積不變時(shí),雖然混合氣體的總壓強(qiáng)增大,但平衡體系中各組分的濃度不發(fā)生改變,平衡不移動(dòng)。
(2)壓強(qiáng)不變時(shí),體積增大,各組分濃度變小,對反應(yīng)前后氣體的物質(zhì)的量不變的可逆反應(yīng),化學(xué)平衡不移動(dòng);對反應(yīng)前后氣體的物質(zhì)的量可變的可逆反應(yīng),化學(xué)平衡向氣體的物質(zhì)的量增大的方向移動(dòng)。如:T、p一定,向2SO2+O22SO3(g)體系中充入一定量N2,則平衡逆向移動(dòng)。
二、考查平衡量變規(guī)律的題型
1.定性判斷
例1 將NO2裝入帶活塞的密閉容器中,當(dāng)反應(yīng)(g)達(dá)到平衡后,改變下列一個(gè)條件,其中敘述正確的是( )
A.升高溫度,氣體顏色加深,則此反應(yīng)為吸熱反應(yīng)
B.慢慢壓縮氣體體積,平衡向右移動(dòng),混合氣體顏色變淺
C.慢慢壓縮氣體體積,若體積減小一半,壓強(qiáng)增大,但小于原來的兩倍
D.恒溫恒容時(shí),充入惰性氣體,壓強(qiáng)增大,平衡向右移動(dòng),混合氣體的顏色變淺
解析:顏色加深時(shí)平衡向左移動(dòng),所以正反應(yīng)為放熱反應(yīng),A錯(cuò)誤;B選項(xiàng),首先假設(shè)平衡不移動(dòng),加壓時(shí)顏色加深,但平衡向右移動(dòng),使混合氣體顏色在加深后的基礎(chǔ)上變淺,但一定比原平衡的顏色深,B錯(cuò)誤;C選項(xiàng),首先假設(shè)平衡不移動(dòng),若體積減小一半,壓強(qiáng)為原來的兩倍,但平衡向右移動(dòng),使壓強(qiáng)在原平衡兩倍的基礎(chǔ)上減小,C正確;D選項(xiàng),體積不變時(shí),反應(yīng)物及生成物濃度不變,所以正逆反應(yīng)速率均不變,平衡不移動(dòng),顏色無變化,錯(cuò)誤。
答案:C
2.定量計(jì)算
例2 在密閉容器中,將1.0mol CO與1.0mol H2O混合加熱到800℃,發(fā)生下列反應(yīng):CO2(g)+H2(g)。一段時(shí)間后該反應(yīng)達(dá)到平衡,測得CO的物質(zhì)的量為0.5mol。則下列說法正確的是( )
A.800℃下,該反應(yīng)的化學(xué)平衡常數(shù)為0.25
B.427℃時(shí)該反應(yīng)的平衡常數(shù)為9.4,則該反應(yīng)的ΔH>0
C.800℃下,若繼續(xù)向該平衡體系中通入1.0mol的CO(g),則平衡時(shí)CO物質(zhì)的量分?jǐn)?shù)為33.3%
D.800℃時(shí),繼續(xù)向該平衡體系中通入1.0mol H2O(g),則平衡時(shí)CO轉(zhuǎn)化率為66.7%
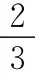
答案:D
3.綜合應(yīng)用
例3 煤化工中常需研究不同溫度下平衡常數(shù)、投料比及產(chǎn)率等問題。
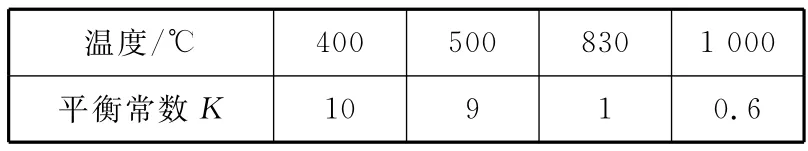
溫度/10 9 1 0.6℃400 500 830 1 000平衡常數(shù)K
試回答下列問題:
(1)上述反應(yīng)的正反應(yīng)是_________(填“放熱”或“吸熱”)反應(yīng)。
(2)某溫度下,上述反應(yīng)達(dá)到平衡后,保持容器體積不變升高溫度,正反應(yīng)速率________(填“增大”“減小”或“不變”),容器內(nèi)混合氣體的壓強(qiáng)________(填“增大”“減小”或“不變”)。
(3)830℃時(shí),在恒容反應(yīng)器中發(fā)生上述反應(yīng),按下表中的物質(zhì)的量投入反應(yīng)混合物,其中向正反應(yīng)方向進(jìn)行的有________(填字母)。
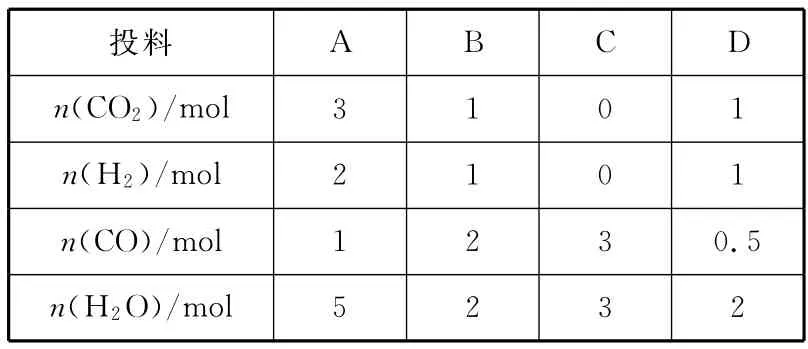
A B C D n(CO2)/mol投料3 1 0 1 n(H2)/mol 2 1 0 1 n(CO)/5 2 3 2 mol 1 2 3 0.5 n(H2O)/mol
(4)在830℃時(shí),在2L的密閉容器中加入4mol CO(g)和6mol H2O(g)達(dá)到平衡時(shí),CO的轉(zhuǎn)化率是________。
解析:(1)由表中數(shù)據(jù)可知,升溫時(shí),化學(xué)平衡常數(shù)減小,故正反應(yīng)為放熱反應(yīng)。(2)升高溫度時(shí),正、逆反應(yīng)速率均增大;容器體積不變的情況下,升高溫度,則容器內(nèi)混合氣體的壓強(qiáng)增大。(3)830℃時(shí),化學(xué)平衡常數(shù)為1,即若n(CO2)×n(H2)<n(CO)×n(H2O),則反應(yīng)向正反應(yīng)方向進(jìn)行,符合此要求的是B、C。
(4)830℃時(shí),化學(xué)平衡常數(shù)為1。
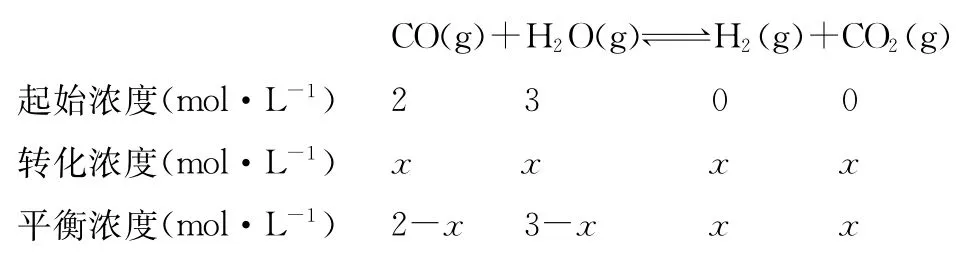
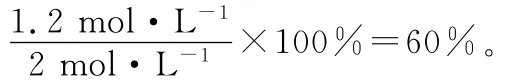
答案:(1)放熱 (2)增大 增大 (3)BC (4)60%
(作者單位:江蘇省常州市橫山橋高級中學(xué))

