巧建思維模型,快解平衡問題
湖南 左傳鵬 楊落星
巧建思維模型,快解平衡問題
湖南 左傳鵬 楊落星
化學的核心內容涉及微觀世界,建立模型有助于我們認識事物及其變化過程,加深對事物的理解,使復雜的問題簡單化。化學平衡和水溶液中的離子平衡是中學化學重要的基本理論知識,該部分內容抽象,且近年來在高考試題中有難度加大趨勢。筆者結合高考試題,通過建立思維模型方法,可解決化學平衡中的轉化率變化問題和水溶液質子守恒問題,在教學中取得了較好的效果。
一、建立“復制壓縮”(或“復制相加”)模型,解轉化率問題
化學平衡是化學理論知識中的核心內容,是高考考查的重點和熱點,不少學生遇到該類試題心生畏懼,特別是改變投料而產生的轉化率、百分含量等物理量的變化問題。針對在恒溫恒容或恒溫恒壓條件下的可逆反應,可以通過建立“復制壓縮”或“復制相加”模型虛擬一個中間過程,快速解題。
例1 在一容積不變的密閉容器中充入1mol NO2,建立如下平衡:(g),測得NO2的轉化率為a%,在其他條件不變下,再充入1mol NO2,待新平衡建立時,又測得NO2的轉化率為b%,則a與b的關系為( )
A.a>b B.a<b
C.a=b D.無法確定
解析:恒容達平衡后充入NO2,平衡右移,NO2轉化量增加,但起始投料量也增加,根據轉化率的定義難以直接比較a與b的大小。可先“復制”虛擬出一個中間過程Ⅱ,易知Ⅰ與Ⅱ兩狀態等效,NO2的轉化率均為a%,再將容器Ⅱ“壓縮”,使容積恢復到原來大小,即得到容器Ⅲ狀態,容器Ⅱ與容器Ⅲ中NO2起始投料量相同,又因“壓縮”時平衡正移,故達新平衡后NO2的轉化率b%必大于a%。應選B項。
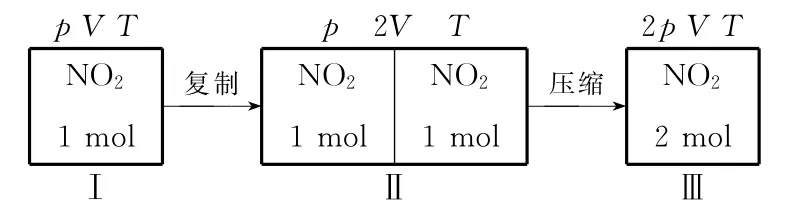
不難發現,對于單一反應物可逆反應,達平衡后追加投料,在恒溫恒容條件下:
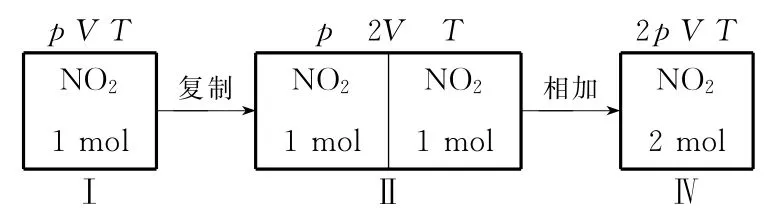
若本題改為在一容積可變的密閉容器中進行,即在恒溫恒壓條件下進行,又會得出什么結果呢?
再充入1mol NO2前后,壓強不變,即反應在恒溫恒壓條件下進行,同樣可通過“復制”虛擬一個中間過程Ⅱ,Ⅰ與Ⅱ兩過程等效,NO2的轉化率均為a%,此時,只需撤掉容器Ⅱ中間隔離,“相加”即為容器Ⅳ平衡狀態。容器Ⅱ與容器Ⅳ中NO2起始投料量相同,故達新平衡后NO2的轉化率b%必等于a%。不難發現,在恒溫恒壓條件下,對于單一反應物可逆反應,平衡后追加反應物投料,無論氣體體積如何變化,上述三種情況的轉化率均不會改變。
變式 (2014·山東·29節選)研究氨氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
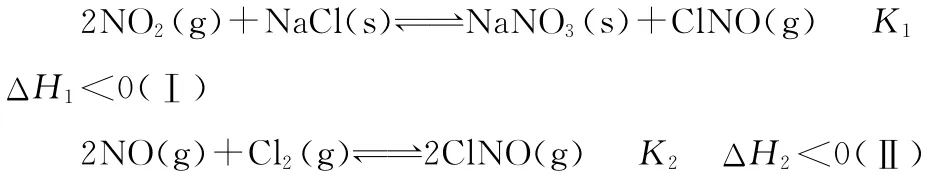
(2)為研究不同條件對反應(Ⅱ)的影響,在恒溫條件下,向2L恒容密閉容器中加入0.2mol NO和0.1mol Cl2,10min時反應(Ⅱ)達到平衡。測得10min內v(ClNO)=7.5×10-3mol·L-1·min-1,則平衡后NO的轉化率α1=________。其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,平衡時NO的轉化率α2_______________(填“>”“<”或“=”)α1。
解析:平衡時容器中n(ClNO)=7.5×10-3mol·L-1·min-1×10min×2L=0.15mol,則平衡后NO的轉化率=0.15mol/0.2mol×100%=75%;建立“復制壓縮”模型,將恒容平衡狀態壓縮即得到恒壓平衡狀態,平衡正向移動,NO的轉化率增大,故α2>α1。

二、建立“組分分離”(或“組分不分離”)模型,列質子守恒式
Br?nsted-Lowry酸堿質子理論認為酸堿反應的實質是質子的傳遞。可逆反應達平衡,酸堿得失質子數相等,即質子守恒。對于含單一溶質的溶液,常規方法是由物料守恒式和電荷守恒式聯立得到。但近幾年高考試題中出現了不少混合溶質題型,難度明顯加大,利用常規方法書寫時,因物料守恒式的書寫難度較大,且兩式聯立處理過程煩瑣而容易出錯。選取起始溶質和溶劑水為基準,筆者建立“組分分離”(或“組分不分離”)模型,可快速列出質子守恒式。
例2 (2014·安徽·11節選)室溫下,下列溶液中粒子濃度關系正確的是( )
B.Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O-4)+2c(H2C2O4) (A、C、D選項省略)
解析:選溶質Na2C2O4和溶劑H2O為基準,建立思維模型:
模型中左右微粒濃度之和相等,即為Na2C2O4溶液的質子守恒式:c(OH-)=c(H+)+c(HC2O-4)+2c(H2C2O4)。
變式1 (2012·四川·10節選)常溫下,下列溶液中的微粒濃度關系正確的是( )
D.0.2mol/L CH3COOH溶液與0.1mol/L NaOH溶液等體積混合:
2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH)
(A、B、C選項省略)
解析:0.2mol/L CH3COOH溶液與0.1mol/L NaOH溶液等體積混合后得到濃度比為1∶1的CH3COOH與CH3COONa水溶液。書寫質子守恒式時把混合溶液視為兩種孤立溶液,建立“組分分離”模型:
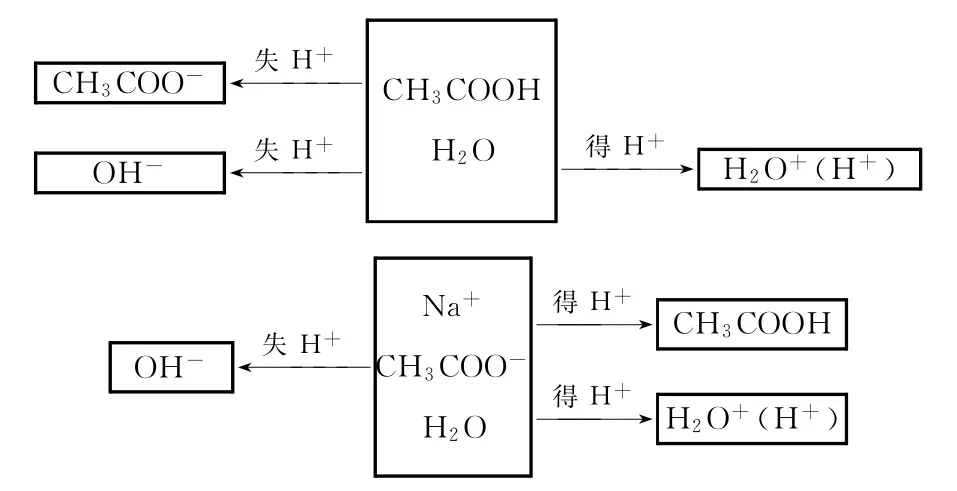
則有:c(CH3COO-)+2c(OH-)=c(CH3COOH)+2c(H+),故D選項正確。
“組分分離”模型適用于溶質間存在平衡轉化關系的混合體系,如變式1中。當CH3COOH與CH3COONa濃度比為m∶n時,對模型中兩個孤立體系對應擴大倍數,質子守恒式為mc(CH3COO-)+(m+n)c(OH-)=nc(CH3COOH)+(m+n)c(H+)
當溶質為多種鹽且粒子間無平衡轉化關系時,只來自于水,質子守恒式與溶質比例無關,選取溶劑水為基準,建立“組分不分離”模型即可快速列出,見變式2。
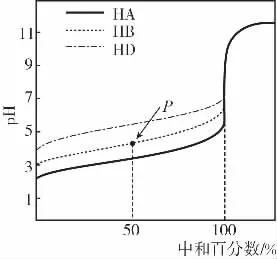
變式2 (2016·天津·6節選)室溫下,用相同濃度的NaOH溶液,分別滴定濃度均為0.1mol·L-1的三種酸(HA、HB和HD)溶液,滴定的曲線如圖所示,下列判斷錯誤的是( )
D.當中和百分數達100%時,將三種溶液混合后:
c(HA)+c(HB)+c(HD)=c(OH-)-c(H+)(A、B、C選項省略)
解析:當中和百分數達100%時,NaOH恰好與三種酸完全反應,溶質為NaA、NaB和NaD。
方法一:
電荷守恒:c(A-)+c(B-)+c(D-)+c(OH-)=c(H+)+c(Na+),物料守恒:c(A-)+c(B-)+c(D-)+c(HA)+c(HB)+c(HD)=c(Na+),兩式抵消Na+即為質子守恒式。
方法二:
建立“組分不分離”模型如下,模型中左右兩邊微粒濃度之和相等,快速列質子守恒式:c(OH-)=c(HA)+c(HB)+c(HD)+c(H+),D項正確。
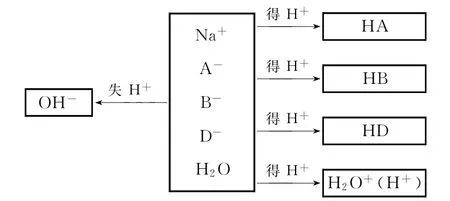
當混合溶液中溶質除了鹽還含酸或堿分子,且溶質間無平衡轉化關系時,情況較為復雜,高中階段一般不做要求。
建立思維模型是將化學微觀問題宏觀化的一種重要手段,也是高中化學核心素養中“宏微結合”與“模型認知”的具體體現。模型教學在傳授學生學科知識的同時,培養了學生的觀察能力、想象能力、記憶能力和創造性思維能力,既有利于教師的教,也有利于學生的學,是一條提高教師教學效果和學生學習效率的重要途徑。
(作者單位:湖南省長沙市長郡中學)

