蘇木、川芎對 PG-BE1 干細胞樣細胞標志蛋白ABCG2影響的體內研究
王耀焓,張培彤,楊棟,韓海英,郭秀偉,祁鑫,張蕓
中國中醫科學院廣安門醫院腫瘤科,北京 100053
蘇木、川芎對 PG-BE1 干細胞樣細胞標志蛋白ABCG2影響的體內研究
王耀焓,張培彤,楊棟,韓海英,郭秀偉,祁鑫,張蕓
中國中醫科學院廣安門醫院腫瘤科,北京 100053
目的 體內實驗觀察不同劑量蘇木、川芎對腫瘤干細胞樣細胞標志物 ABCG2 的影響。方法 將無血清培養獲得的球細胞接種于裸鼠腋下,將裸鼠隨機分為對照組、蘇木高劑量組、蘇木低劑量組、川芎高劑量組和川芎低劑量組,各給藥組給予相應藥物灌胃,21 d 后檢測抑瘤率,激光共聚焦、Western blot和 RT-PCR分別檢測瘤體 ABCG2 蛋白和 mRNA 表達。結果 經無血清培養獲得的球細胞具有無限增殖、抗凋亡、高表達干細胞標志物等干細胞性能,川芎高、低劑量組可明顯抑制瘤體生長(P<0.05),其中川芎低劑量組抑瘤率明顯高于川芎高劑量組,蘇木高、低劑量組雖對瘤體有一定的抑制作用,但差異無統計學意義(P>0.05);與對照組比較,川芎低劑量組可明顯抑制ABCG2蛋白的表達,蘇木高、低劑量組對ABCG2蛋白表達均無抑制作用,除川芎低劑量組外,各給藥組對 ABCG2 mRNA 表達均有上調作用。結論 低劑量川芎可能通過抑制腫瘤干細胞標志物ABCG2蛋白的表達,靶向殺傷腫瘤干細胞。
蘇木;川芎;腫瘤干細胞;ABCG2蛋白
化療在改善腫瘤患者生存質量、提高患者生存率方面起到重要作用。然而,化療耐藥的存在一直制約著臨床療效的發揮。有研究顯示,經化療后再復發或發生遠處轉移的乳腺癌患者,大約 40%是由于化療耐藥引起的[1]。因此,尋找可以增強化療敏感性的藥物是目前面臨的挑戰。近幾年來,腫瘤干細胞理論的提出對化療耐藥的治療提出了新的理念。該理論認為,腫瘤干細胞具有自我更新、多向分化、化療耐藥等性能,是腫瘤復發及轉移的主要原因。課題組前期研究表明,蘇木、川芎嗪對腫瘤轉移具有明顯的抑制作用[2-3]。體內實驗顯示,蘇木、雞血藤及二者聯合順鉑可以將腫瘤細胞阻滯在 G0/G1 期,并可抑制與細胞增殖相關的蛋白增殖細胞核抗原(PCNA)、低氧誘導因 子 -1α (HIF-1α )表 達 ,另 外 對 P16-Cyclin D1-CDK4-RB 途徑也具有調節作用,三者相互作用共同阻滯腫瘤的發生發展[4-5]。基于以上研究基礎,我們選用川芎、蘇木作為活血的代表藥,體內實驗觀察不同劑量蘇木、川芎對肺癌干細胞樣細胞的干預作用。ABCG2 蛋白是目前比較公認的腫瘤干細胞標志物之一。因此,本實驗主要研究在體內環境中不同劑量川芎、蘇木對 PG-BE1 干細胞樣細胞標志蛋白 ABCG2的影響。
1 實驗材料
1.1 動物
BALB/c-nu 裸鼠,4~6 周齡,體質量(16±2)g,雌雄各半,北京維通利華實驗動物技術有限公司,動物許可證號 SYXK(京)2013-0032,飼養于北京大學醫學部實驗動物中心。
1.2 細胞系
高轉移性人巨細胞肺癌細胞 PG-BE1,中國中醫科學院廣安門醫院腫瘤研究室。
1.3 藥物
蘇木、川芎,康美藥業股份有限公司;順鉑注射液,齊魯制藥(海南)有限公司,批號 20120724。
1.4 主要試劑與儀器
Human FGF-basic(美國 Pero Tech),Human EGF(美國 Pero Tech),B27 Supplement(50×,美國Gibco),Tripsin inhibition from Glycine max(soybea,美國 Sigma),Anti-BCRP/ABCG2 抗體(美國 Abcam),CCK8 試劑盒(日本同人),ANNEXIN V(美國 BD),ABCG2 Gene、A lexa Fluor 594 donkey anti-rabbit IgG(H+L)、TRIzol Reagent(美國 Life Technologies)。高速冷凍離心機(美國 Sigma),NanoDrop 2000 超微量分光光度計(美國 Thermo Scientific),PROGENE PCR 擴增儀(英國 Techene),Applied Biosysterns 7500 RT-PCR Systems(美國 ABI),DYY-12 型電腦三恒多用電泳儀(北京六一儀器廠),Chem iDoc XRS 凝膠成像系統(美國 Bio-Rad),ZEISS LSM 710 激光共聚焦顯微鏡(德國 Zeiss),水平電泳槽(美國 Bio-Rad)。
2 實驗方法
2.1 藥物制備、分組及給藥
取蘇木、川芎各 15 g,雙蒸水浸泡 30 min,煎煮2 次,將 2 次煎劑濃縮至 60 m L,濃度 0.25 g/m L,為高劑量藥液。另取蘇木、川芎各 5 g,雙蒸水浸泡 30 min,將 2 次煎劑濃縮至 100 m L,濃度 0.05 g/m L,為低劑量 4 ℃冰箱保存備用。將裸鼠隨機分為對照組、川芎低劑量組、川芎高劑量組、蘇木高劑量組、蘇木低劑量組,每組5只,蘇木低、高劑量和川芎低、高劑量小鼠給藥劑量相當于成人(體質量 60 kg)臨床給藥量 10、30 倍(成人每日臨床給藥量為蘇木、川芎各10 g)。小鼠給藥體積為 200 μL/次,1 次/d。
2.2 干細胞樣細胞分選
常規復蘇、培養 PG-BE1 細胞,待其生長至 70%~80%時,胰酶消化成單個細胞,PBS 清洗 2 次,重懸于含 0.02 μg/m L EGF、0.02 μg/m L bFGF、5 μg/m L 胰島素、2%B27、4%BSA 的 DMEM/F-12 的培養基,調整細胞濃度 2×104/孔,接種于低黏附 6 孔板,待細胞成球且折光率變低時收集 PG-BE1 球細胞,離心、胰酶消化,1 mg/m L 大豆胰蛋白酶抑制劑終止消化,重懸于上述完全培養基 DMEM/F-12 中。使用傳代至第 3 代的 PG-BE1 球細胞。
2.3 干細胞樣細胞鑒定
2.3.1 CCK-8檢測細胞增殖 分別收集PG-BE1貼壁細胞及第 3 代 PG-BE1 球細胞,接種于 96 孔板,1000 個/孔,分為 3、4、5、6、7 d 組,每組 5 個復孔。分別于第 3、4、5、6、7 日時加入 Cell Counting Kit-8細胞增殖檢測試劑,10 μL/100 μL 培養基,酶標儀檢測吸光度(OD)。
2.3.2 AV/PI檢測細胞凋亡 分別收集PG-BE1貼壁細胞及第 3 代 PG-BE1 球細胞,預冷的 PBS 清洗細胞2 次,并重懸于 1×Binding Buffer,調整細胞濃度至1×106/m L。取 100 μL 上述細胞懸液置于流式管中,加 5 μL FITC Annexin V 及 5 μL PI。輕柔震蕩細胞,室溫(25 ℃)避光孵育 15 m in。每管加 400 μL 1×Binding Buffer,流式細胞儀檢測。
2.3.3 免疫熒光檢測細胞 ABCG2 表達 分別收集PG-BE1 貼壁細胞及第 3 代 PG-BE1 球細胞,調整細胞濃度至 1×105/m L,接種于 96 孔板。24 h 后,每孔依次加入 4%多聚甲醛固定,0.1%Triton-X 透膜,免疫熒光封閉液室溫封閉 1 h,一抗 4 ℃孵育過夜,熒光二抗避光孵育 1 h,滴加 DAPI避光孵育 5 min,最后加入適量抗熒光淬滅封片液。
2.3.4 Western blot 檢測細胞 ABCG2、SOX-2、Nanog、OCT-4 表達 分別收集 PG-BE1 貼壁細胞及第 3 代PG-BE1 球細胞,提取蛋白。BCA 法測定各組總蛋白濃度,分別制備濃縮膠與分離膠,加樣后分別行蛋白電泳、電轉移,5%脫脂奶粉封閉后,一抗(稀釋倍數 1∶1000)、二抗(稀釋倍數 2∶1000)孵育各 1 h,暗室中滴加超敏發光液,凝膠成像系統拍照。
2.4 川芎、蘇木對裸鼠模型抑瘤率的影響
將 1×107/m L 濃度 PG-BE1 球細胞接種于裸鼠腋下,0.2 m L/只,24 h 后,連續給藥 21 d,小鼠脫頸處死,稱量瘤質量,計算抑瘤率。抑瘤率(%)=(實驗組平均瘤質量-對照組平均瘤質量)÷對照組平均瘤質量×100%。
2.5 激光共聚焦檢測瘤體內 ABCG2 蛋白表達
將腫瘤組織從液氮中取出,冷凍切片包埋劑包埋,置于-20 ℃冰凍切片機中待其凝固;將已凝固腫瘤組織進行粗切片,直至露出腫瘤組織為止,切取 8 μm厚度、完整的組織切片,平鋪在防脫磨砂載玻片上,室溫放置 10 min;然后將玻片浸泡于 4 ℃丙酮中,固定 10 min;PBS 沖洗 3 次×10 m in;再將玻片浸泡于免疫封閉液中,封閉 1 h;PBS 沖洗 3 次,滴加一抗Anti-BCRP/ABCG2(按 1∶100 比例稀釋),4 ℃過夜;PBS 沖洗 3 次,滴加 Alexa Fluor 594 donkey anti-rabbit IgG(H+L)二抗(稀釋濃度 1∶200),室溫避光孵育1 h;PBS 沖洗,滴加 DAPI,室溫避光孵育 5 m in;PBS沖洗,滴加抗熒光淬滅封片液,蓋玻片封片,激光共聚焦顯微鏡拍照。
2.6 Western blot 檢測腫瘤組織 ABCG2 蛋白表達
分別收集各組腫瘤組織,提取蛋白。用 BCA 法測定各組總蛋白濃度,分別制備濃縮膠與分離膠,加樣后分別行蛋白電泳、電轉移,5%脫脂奶粉封閉后,一抗(稀釋倍數 1∶1000)、二抗(稀釋倍數 2∶1000)孵育各 1 h 后于暗室中滴加超敏發光液,于 ChemiDoc XRS 凝膠成像系統拍照,并用 Image J 軟件分析各組蛋白表達量。
2.7 RT-PCR 檢測腫瘤組織 ABCG2 基因表達
分別提取各組腫瘤組織 RNA,應用 Nanodrop 測定RNA濃度與純度,并驗證RNA完整性。將提取的RNA進行反轉錄及熒光定量,檢測各組基因表達量。
3 統計學方法
采用 SPSS17.0 統計軟件進行分析。計量資料以—x±s 表示,符合正態分布用 t檢驗,不符合正態分布用秩和檢驗。P<0.05 表示差異有統計學意義。
4 結果
4.1 干細胞樣細胞分選結果
接種后第3日可見細胞球形成,隨時間延長,球體積變大,折光率變低,傳代至第 3 代的 PG-BE1 球細胞,見圖1。

圖 1 PG-BE1 球細胞成球情況(×200)
4.2 CCK-8 法檢測結果
PG-BE1 球細胞組第 3、4、5、6、7 日 OD 值明顯高于 PG-BE1 貼壁細胞(P<0.01);以 PG-BE1 貼壁細胞 OD 值為基線,其 PG-BE1 球細胞第 3、4、5、6、7 日相對 OD 值分別為 0.10、0.17、0.21、0.24、0.32,見圖 2。
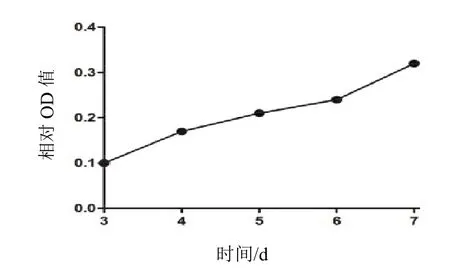
圖 2 PG-BE1 球細胞增殖趨勢圖
4.3 AV/PI 檢測結果
PG-BE1 球細胞和貼壁細胞早期凋亡率分別為0.638%、1.273%(P<0.05);中晚期凋亡率分別為2.53%、2.78%,PG-BE1 球細胞中晚期凋亡率低于PG-BE1 貼壁細胞(P>0.05),見圖 3。
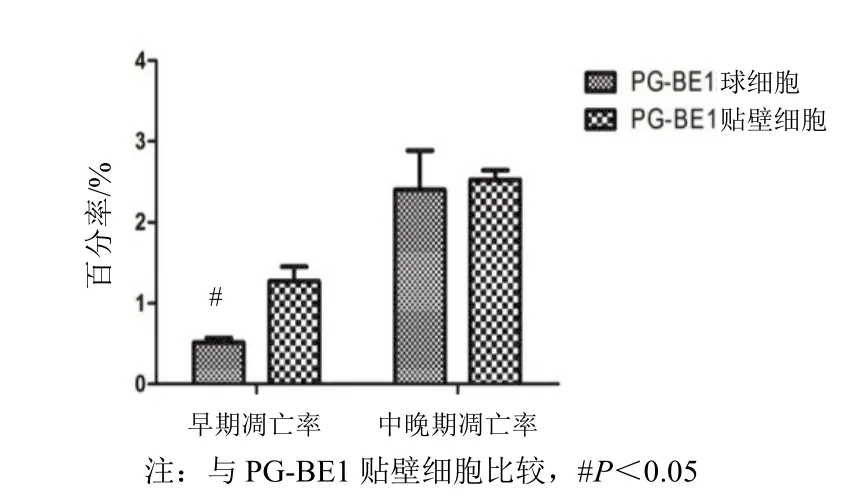
圖 3 PG-BE1 球細胞和貼壁細胞凋亡率比較
4.4 免疫熒光檢測結果
PG-BE1 球細胞 ABCG2 高表達,而 PG-BE1 貼壁細胞ABCG2低表達甚至不表達,二者差異有統計學意義(P<0.05),見圖 4、圖 5。
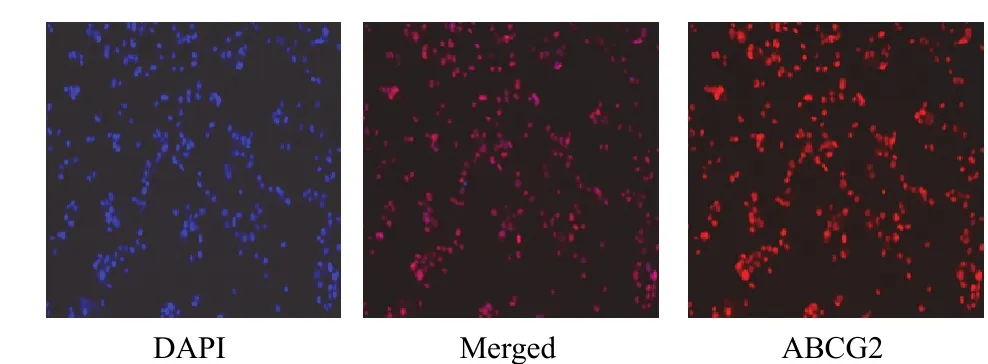
圖 4 PG-BE1 球細胞 ABCG2 蛋白表達(免疫熒光染色,×200)
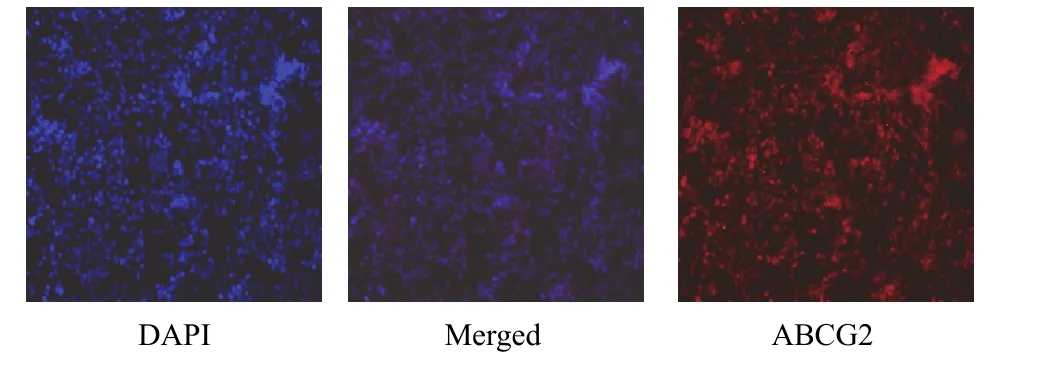
圖 5 PG-BE1 貼壁細胞 ABCG2 蛋白表達(免疫熒光染色,×200)
4.5 Western blot 檢測結果
ABCG2 蛋白在 PG-BE1 球細胞中表達量明顯高于 PG-BE1 貼壁細胞(P<0.05)。OCT-4、Nanog 在PG-BE1 貼壁細胞中不表達或低表達,而在 PG-BE1球細胞中可見明顯表達(P<0.05);SOX-2 在 PG-BE1球細胞及貼壁細胞中表達也有明顯差異(P<0.01)。見圖6。
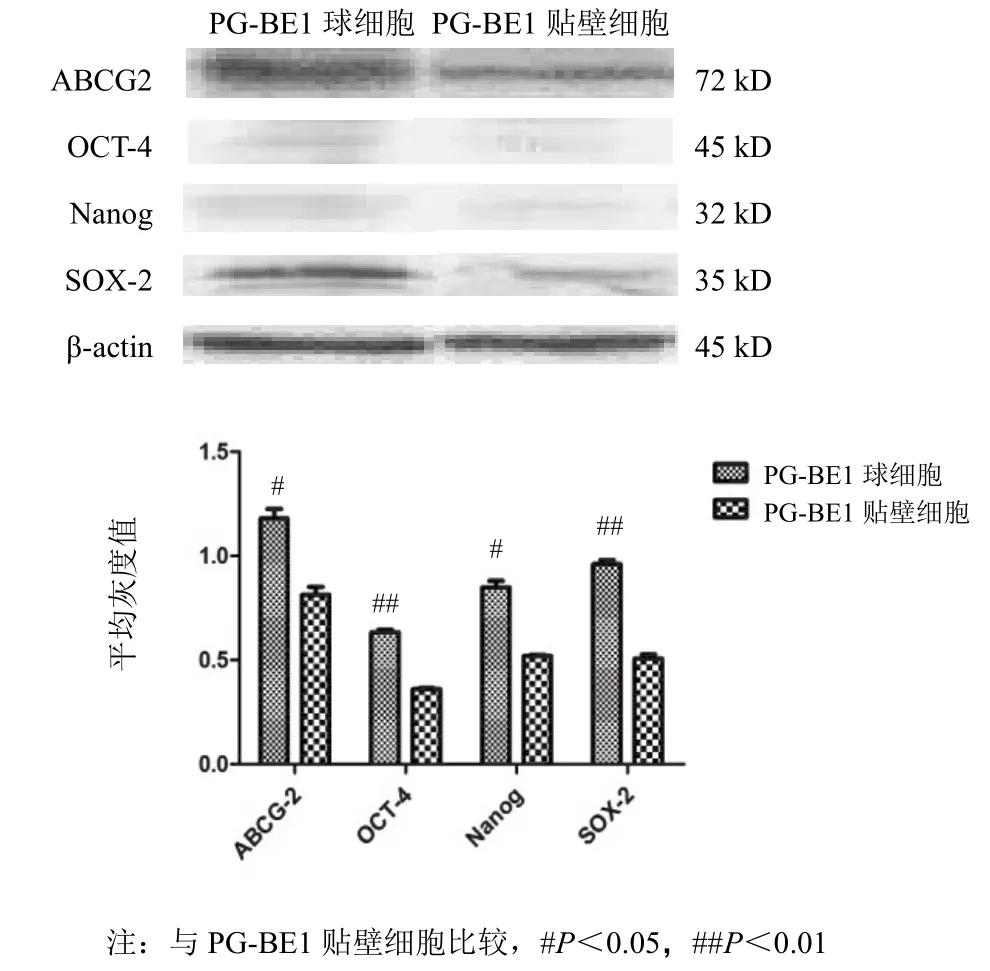
圖 6 腫瘤干細胞標志物蛋白表達
4.6 不同劑量川芎、蘇木對抑瘤率的影響
川芎高、低劑量組和蘇木高、低劑量組抑瘤率分別為 36.26%、42.63%、24.60%、26.32%。與對照組比較,川芎高、低劑量組可明顯抑制瘤體生長(P< 0.05),其中川芎低劑量抑瘤率明顯高于川芎高劑量組(P<0.05);蘇木各劑量組雖對瘤體有一定的抑制作用,但差異無統計學意義(P>0.05)。見圖 7。
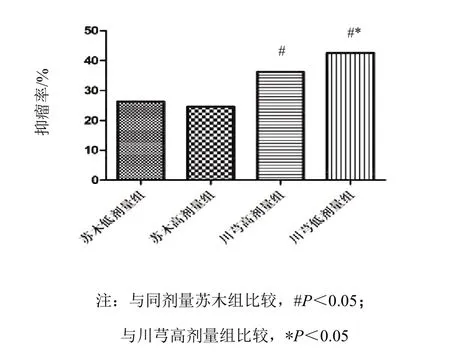
圖 7 各組 PG-BE1 球細胞抑瘤率比較
4.7 激光共聚焦檢測不同劑量川芎、蘇木對瘤組織ABCG2 蛋白表達的影響
與對照組比較,蘇木各劑量組 ABCG2蛋白表達無明顯差異,川芎各劑量組可明顯抑制 ABCG2蛋白的表達,見圖8。
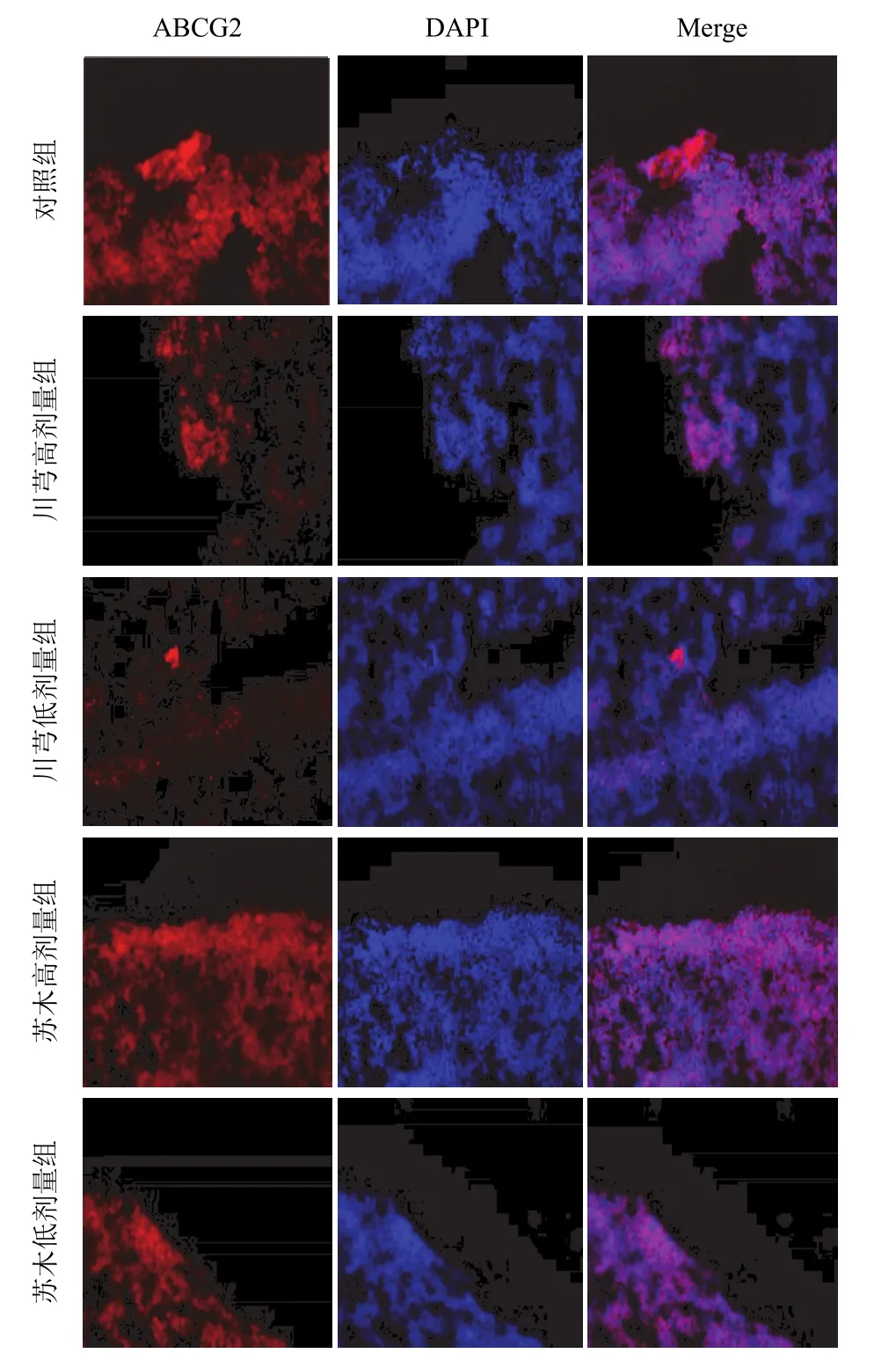
圖 8 激光共聚焦檢測 ABCG2 蛋白表達(×200)
4.8 Western blot 檢測不同劑量川芎、蘇木對 ABCG2蛋白表達的影響
與對照組比較,川芎低劑量組可抑制ABCG2蛋白的表達(P<0.05),川芎高劑量組對 ABCG2 蛋白的表達無明顯的抑制作用;蘇木各劑量組對 ABCG2蛋白表達均無抑制作用。見圖9。
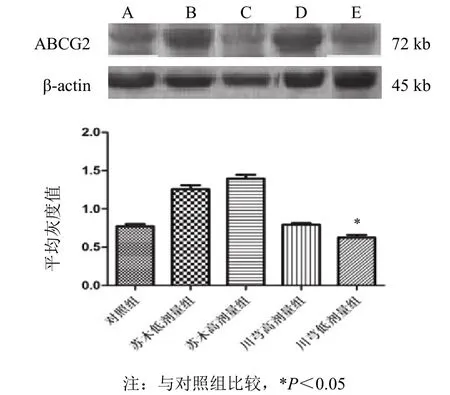
圖 9 各組瘤組織 ABCG2 蛋白表達
4.9 RT-PCR 檢測不同劑量川芎、蘇木對 ABCG2 mRNA表達的影響
與對照組比較,除川芎低劑量組外,各給藥組對ABCG2 mRNA 表達均有上調作用,見圖 10。
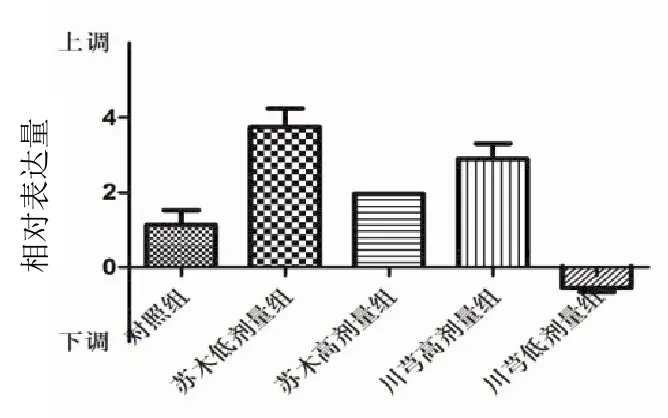
圖 10 各組瘤組織 ABCG2 mRNA 表達比較
5 討論
側群(side population,SP)細胞可以特異性地將Hoechst33342 染料快速泵出細胞外。研究發現,SP細胞具有某些干細胞特性,如具有極強的自我更新及增殖能力[6]。目前,在許多組織胚胎及腫瘤細胞中,都發現了 SP 細胞的存在[7-11]。他們具有與干細胞相似的干性,如同源性、自我更新能力、多向分化潛能。基于此,很多學者認為 SP細胞中富含干細胞,是干細胞研究的重要資源,可以作為干細胞分離、鑒定的一種方法[12]。
而 SP 細胞之所以可以將 Hoechst33342 染料泵出細胞外,是因為 ABCG2蛋白的存在。三磷酸腺苷結合盒(ATP binding cassette,ABC)超家族是一種由多種轉運體組成的、在機體內廣泛表達的大家族。ABCG2蛋白作為 ABC 家族成員之一,與 SP 細胞表型的表達存在密切關系,如 ABC 轉運蛋白活性可被ABC轉運蛋白抑制劑或者鈣離子通路阻滯劑所抑制,從而減少 SP 表型[13]。Zhou S 等[14]研究發現,雖然不同 SP細胞來源于不同的組織,但均表達 ABC 家族中的 ABCG2/BCRP1 耐藥基因,經反轉錄基因轉染實驗后發現,ABCG2/BCRP1 的表達與 SP 細胞表型呈強相關,即 ABCG2/BCRP1 是 SP 細胞表型特征的決定因素。因此,認為 ABCG2蛋白可以作為另一種腫瘤干細胞標志物用于腫瘤干細胞的鑒定。
本實驗應用無血清培養法獲得 PG-BE1 球細胞,經抗凋亡實驗檢測球細胞凋亡能力、CCK-8 法檢測球細胞增殖能力、Western blot檢測干細胞標志物表達發現,該細胞具有較強的增殖能力、抗凋亡能力,高表達 ABCG2、Nanog、OCT-4、SOX2 等蛋白。而 Nanog、OCT4、SOX2 基因是干細胞中代表性標志物,與干細胞多潛能性和自我更新能力有密切關系,是目前腫瘤干細胞標志物之一。本實驗中獲得的 PG-BE1 球細胞在高表達 SOX2、OCT-4、Nanog 蛋白的同時高表達ABCG2蛋白,表明 ABCG2蛋白作為腫瘤干細胞標志物的可靠性。以上體外實驗結果表明,無血清球培養獲得的 PG-BE1 球細胞具有腫瘤干細胞干性。
目前大量實驗研究顯示,中藥提取物或中醫復方在殺傷腫瘤干細胞方面存在較好療效。研究發現異甘草素可以通過抑制腫瘤干細胞的自我更新及多向分化而明顯降低乳腺癌細胞中 SP 及 CSC 的比率[15]。進一步研究發現,GRP78 作為異甘草素的直接作用靶點,異甘草素可以剪短 ATP 表達域中 GRP78 的表達,進而抑制 ATP 酶的活性、促進 β-catenin 降解,導致β-catenin/ABCG2 信號通路失活;體內實驗也表明,異甘草素可通過 GRP78/β-catenin/ABCG2 信號通路增強乳腺癌干細胞的化療敏感性,且對周圍組織及乳腺干細胞無毒副作用。姜黃素通過誘導 ABCG2耐藥蛋白的低表達,提高乳腺癌干細胞對絲裂霉素的敏感性,達到殺傷乳腺癌干細胞、減少球細胞形成、低表達腫瘤干細胞標志物 CD44+CD24-的目的。經姜黃素干預的乳腺癌細胞對紫杉醇、順鉑、阿霉素等化療藥的敏感性明顯提高[16]。片仔癀對 SP 細胞分選出的結腸癌干細胞有顯著的殺傷作用,且呈劑量依賴性。其可以抑制結腸癌干細胞活性及成球能力,深入研究發現片仔癀對腫瘤干細胞的殺傷作用與其可以抑制ABCG2 mRNA 的表達有關[17]。
本研究以ABCG2蛋白作為腫瘤干細胞標志物,觀察蘇木、川芎體內實驗對 PG-BE1 干細胞樣細胞的作用,經激光共聚焦及 Western blot檢測發現,低、高劑量蘇木及高劑量川芎對 ABCG2蛋白并無抑制作用,而低劑量川芎可明顯抑制 ABCG2蛋白的表達。故而認為低劑量川芎對 PG-BE1 干細胞樣細胞的生長有抑制作用。進一步經 RT-PCR 檢測后發現,低劑量川芎組可明顯抑制 ABCG2 mRNA 的表達,其余各組對 ABCG2 mRNA 表達均為上調作用,Western blot與 RT-PCR 的結果基本一致。因此,考慮低劑量川芎對 ABCG2 蛋白的抑制作用可能與其抑制 ABCG2 mRNA 的表達相關,低劑量川芎對 PG-BE1 干細胞樣細胞殺傷作用可能是通過抑制ABCG2蛋白在mRNA水平的表達實現的,其具體機制尚需進一步研究。
[1] GERBER B. Recur rent breast cancer:t reatment strategies for maintaining and prolonging good qual ity of l ife[J]. Dtsch Arztebl Int,2010,107(6):85-91.
[2] 楊棟,張培彤,王耀焓,等.川芎嗪對高轉移性人肺巨細胞癌 PG-BE1 干細胞樣細胞黏附能力的影響[J].中醫雜志,2015,56(13):1140-1144.
[3] 江保中,張培彤,楊棟,等.蘇木對 PG 細胞增殖、黏附及侵襲能力的影響[J].中國腫瘤,2014,23(3):239-243.
[4] 郭秀偉,張培彤,楊棟,等.蘇木含藥血清對人肺癌 PG 細胞增殖周期影響的對比研究[J].中國中西醫結合雜志,2014,34(6):745-750.
[5] 郭秀偉,張培彤,楊棟,等.雞血藤血清聯合順鉑對人肺癌 PG 細胞增殖及周期影響的研究[J].中國腫瘤,2016,26(3):219-225.
[6] YEH J Y, HUANG W J, KAN S F, et al. Ef fects of bufalin and cinobufagin on the proli feration of androgen dependent and independent prostate cancer cel ls[J]. Prostate,2003,54(2):112-124.
[7] NIGAM A. Breast cancer stem cel ls, pathways and therapeytic perspect perspectives 2011[J]. Indian J Surg,2013,75(3):170-180.
[8] GAO Y J, LI B, WU X Y, et al. Thyroid tumor-initiating cel ls:increasing evidence and opportunities for anticancer therapy (review)[J]. Oncol Rep,2014,31(3):1035-1042.
[9] ZHANG H H, CAI A Z, WEI X M, et al. Characterization of cancer stem-like cel ls in the side population cel ls of human gastric cancer cel l l ine MKN-45[J]. J Zhej iang Univ-Sci B,2013,14(3):216-223.
[10] LIU J, CHI N, ZHANG J Y, et al. Isolation and characterization of cancer stem cel ls f rom medul loblastoma[J]. Genet Mol Res,2015, 14(2):3355-3361.
[11] XIE Z Y, LV K, XIONG Y, et al. ABCG2-meditated mul tidrug resistance and tumor-initiating capacity of side population cel ls f rom colon cancer[J]. Oncol Res Treat,2014,37(11):666-668.
[12] CHALLEN G A, LITTLE M H. A side order of stem cel ls:the SP phenotype[J]. Stem Cel ls,2006,24(1):3-12.
[13] UNNO K, JAIN M, LIAO R. Cardiac side population cel ls:moving toward the center stage in cardiac regeneration[J]. Circ Res, 2012,110(10):1355-1363.
[14] ZHOU S, SCHUETZ J D, BUNTING K D, et al. The ABC transpor ter BCRP1/ABCG2 is expressed in awide variety of stem cel ls and is a molecular determinant of the side-population phenotype[J]. Nat Med,2001,7(9):1028-1034.
[15] WANG N, WANG Z H, CHENG P, et al. Dietary compound isol iquiritigenin targets GRP78 to chemosensitize breast cancer stem cel ls via β-catenin/ABCG2 signal ing[J]. Carcinogenesis, 2014,35(11):2544-2554.
[16] ZHOU Q M, YE M N, LU Y Y, et al. Curcumin improves the tumoricidal ef fect of mitomycin C by suppressing ABCG2 expression in stem cel l-l ike breast cancer cel ls[J]. PLoS One,2015,10(8):e0136694.
[17] WEI L H, CHEN P Y, CHEN Y Q, et al. Pien Tze Huang suppresses the stem-l ike side population in colorectal cancer cel ls[J]. Molecular Medicine Reports,2014,9(1):261-266.
Effects of Sappan Lignum and Chuanxiong Rhizoma on Expression of ABCG2 Protein of PG-BE1 Stem Like Cells in Vivo
WANG Yao-han, ZHANG Pei-tong, YANG Dong, HAN Hai-ying, GUO Xiu-wei, QI Xin, ZHANG Yun (Department of Oncology, Guang’anmen Hospital, China Academy of Chinese Medical Sciences, Beijing 100053, China)
Objective To observe the effects of different doses of Sappan Lignum and Chuanxiong Rhizoma on tumor stem cells marker ABCG2 in vivo. Methods Sphere cells obtained from serum culture were inoculated in nude mouse armpit, which were random ly divided into 5 groups∶ control group, Sappan Lignum high- and low-dose groups, and Chuanxiong Rhizoma high- and low-dose groups. Each medication group was given relevant medicine for gavage. 21 days later, inhibition tumor rate and ABCG2 protein and mRNA expression were detected With confocal m icroscope, Western blot, and RT-PCR. Results The sphere cells obtained from serum free culture had the abilities of cancer stem cells, such as proliferation, anti-aptosis and high expression of cancer stem cells markers. Chuanxiong Rhizoma high- and low-dose groups could inhibit tumor grow th (P<0.05), and the inhibitory rate of Chuanxiong Rhizoma low-dose group was higher than the Chuanxiong Rhizoma high-dose group. Sappan Lignum high- and low-dose groups inhibited tumor grow th Without statistical significiance (P>0.05). Compared With the control group, Chuanxiong Rhizoma low-dose group could significantly inhibit the expression of resistant protein of ABCG2. Sappan Lignum high- and low-dose groups could not inhibit the protein expression of ABCG2. Each medication group up-regulated the mRNA expression of ABCG2 except for Chuanxiong Rhizoma low-dose group. Conclusion Low dose of Chuanxiong Rhizoma can inhibit the expression of ABCG2 protein levels, which can be the targeting killer for cancer stem cells.
Sappan Lignum; Chuanxiong Rhizoma; cancer stem cells; ABCG2 protein
10.3969/j.issn.1005-5304.2017.08.014
R285.5
A
1005-5304(2017)08-0060-06
2016-11-06)
(
2017-02-26;編輯:華強)
國家自然科學基金(81173450)
張培彤,E-mai l:zhangpeitong@sohu.com

