薄層色譜畫像解析法快速判定魚肉的脂質氧化度
于 慧,佐藤實,山口敏康,中野俊樹
(1.魯東大學食品工程學院,山東 煙臺 264025;2.日本東北大學農學研究科,日本 仙臺 981-8555)
薄層色譜畫像解析法快速判定魚肉的脂質氧化度
于 慧1,佐藤實2,山口敏康2,中野俊樹2
(1.魯東大學食品工程學院,山東 煙臺 264025;2.日本東北大學農學研究科,日本 仙臺 981-8555)
為了快速判定魚肉的脂質氧化度,建立薄層色譜畫像(thin layer chromatography image,TLC-i)解析法快速測定魚類氧化生成的極性化合物含量。取黃鰭金槍魚油0.5 μL點樣于硅膠板上,用正己烷-乙醚-醋酸(30∶70∶1,V/V)的混合液展開12 min后,3%醋酸銅磷酸溶液噴霧顯色,150 ℃加熱15 min后,將氧化生成的極性化合物通過面積分析軟件進行半定量分析。結果表明,此方法測得的極性化合物含量與常用的過氧化值(peroxide value,POV)、羰基值(carbonyl value,CV)相比,具有較好的相關性,相關系數分別為0.993 8和0.972 5。將此方法用于判定遠東多線咸魚在4 ℃貯藏期間的脂質氧化情況,發現極性化合物含量與POV具有較好的正相關性(R2=0.962 5)。將此方法用于判定鹽漬紅鮭在-5 ℃貯藏期間的脂質氧化情況,發現極性化合物含量與a*值具有較好的負相關性(R2=-0.822 9)。結果表明,該方法具有簡單化、快速化、微量化、可視化的優點,且不需要昂貴的設備,適合魚肉脂質氧化度的快速評價。
薄層色譜畫像解析;脂質氧化;極性化合物;快速檢測
魚類由于含有豐富的多不飽和脂肪酸,如二十碳五烯酸(eicosapentaenoic acid,EPA)、二十二碳六烯酸(decosahexaenoic acid,DHA)等,在貯藏過程中極易氧化生成氫過氧化物,過氧化物逐漸進一步分解生成醛、酮類物質,這不僅使魚類的風味和營養價值有所降低,還對人體健康產生很大危害,如促進衰老,導致心腦血管疾病和腫瘤等[1-4]。目前常用的脂質氧化測定法有過氧化值(peroxide value,POV)、羰基值(carbonyl value,CV)、硫代巴比妥酸反應物(thiobarbituric acid reactive substance,TBARS)、氣相色譜、液相色譜等[5-7]。POV是評價脂質初級氧化產物氫過氧化物的主要指標,也是油脂過氧化值國際通過分析方法。但此方法需要花費大量的時間、玻璃儀器、溶劑和油脂,檢測成本高,檢測靈敏度較低,且過氧化物不穩定,隨時會分解,只能粗略地反映脂質氧化程度[8]。CV是評價脂質次級氧化產物羰基化合物量的指標,也是評價脂質氧化度的另一重要指標[9]。但此方法和POV一樣,操作繁瑣,需要花費大量的時間。氣相色譜和液相色譜等多種色譜技術已用于測定脂質的氧化程度,但是氣相色譜分析前需要對樣品進行衍生化,此步操作可能會引起穩定性較差的不飽和樣品物性變化,從而帶來檢測誤差[2],且這些方法只適合實驗室檢測,難以滿足生產中現場化測定的要求。為了開發簡便、快速的魚肉脂質氧化度的判定方法,本實驗以黃鰭金槍魚油為例建立了薄層色譜畫像(thin layer chromatography image,TLC-i)解析法。魚類在氧化酸敗過程中產生的脂質過氧化物及其分解產物、游離脂肪酸等[10-11],會使其極性顯著增加,因此,脂質氧化也可以通過極性化合物含量的檢測來表征。總脂質經薄層色譜分離后,將氧化生成的比甘油三酯極性強的化合物利用面積分析軟件進行半定量,并利用該法評價遠東多線咸魚和鹽漬紅鮭在低溫貯藏過程中的脂質氧化度,以期為今后進一步評價魚類的脂質氧化提供理論依據。
1 材料與方法
1.1 材料與試劑
黃鰭金槍魚油(Thunnus albacares) 日本Maruha Nichiro食品株式會社;遠東多線咸魚(Pleurogrammus azonus)(PE保鮮膜包裝,4 ℃貯存)和冷凍鹽漬紅鮭(Oncorhynchus nerka)(真空包裝,-18 ℃貯存)日本宮城縣仙臺市超市。
2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,2,4-DNPH)、反-2-癸烯醛 美國Sigma公司;正丁醇、氯仿、冰醋酸、碘化鉀、乙醚、氫氧化鉀等均為分析純。1.2 儀器與設備
UV-2550型紫外-可見分光光度計 日本島津公司;NF777型手持式色差計 日本電色工業株式會社;Silica gel 60 F254硅膠板 德國Meker公司。
1.3 方法
1.3.1 黃鰭金槍魚油的加速氧化
將魚油分裝在小玻璃皿(內徑28 mm,深度13 mm)中,每個玻璃皿放3 mL,將其放入50 ℃的恒溫箱中保存,每天定時取樣測定。
1.3.2 遠東多線咸魚總脂質的提取
將遠東多線咸魚置于4 ℃貯存,定時取其魚肉樣品5 g,按照Folch等[12]方法對其總脂質進行提取。
1.3.3 鹽漬紅鮭總脂質的提取
將紅鮭切成7~8 cm長的魚段,隨機裝入保鮮袋中,分成2 組,一組充入氧氣,一組不做任何處理(以下分別稱為氧氣組和對照組),置于-5 ℃貯存。每周取其魚肉樣品5 g,按照Folch等[12]方法對其總脂質進行提取。
1.3.4 TLC-i解析法測定
用微量注射器取0.5 μL魚油,點樣于活化硅膠板上,用正己烷-乙醚-醋酸(30∶70∶1,V/V)的混合液展開12 min,后采用3%醋酸銅磷酸溶液噴霧顯色,150 ℃加熱15 min后,將氧化生成的極性化合物通過面積分析軟件進行半定量分析。
1.3.5 POV的測定
參照Bilinski等[13]的方法,稱取50 mg魚肉脂質于20 mL玻璃瓶中,加入3 mL氯仿-醋酸(2∶3,V/V)混合液溶解,在通入氮氣條件下,加入0.5 mL飽和KI溶液,攪拌1 min,后置于暗處5 min。取出后加3 mL蒸餾水,搖勻后加入淀粉指示劑1~2 滴,用0.01 mol/L Na2S2O3標準溶液滴定至藍色褪去,記錄所需Na2S2O3標準溶液體積。同時作空白對照實驗。按公式(1)計算樣品POV:
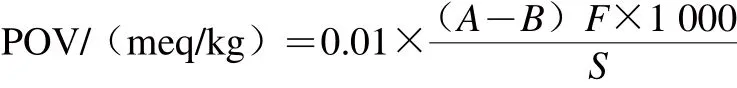
式中:A為樣品滴定時所消耗的Na2S2O3標準溶液體積/mL;B為空白實驗滴定時所消耗的Na2S2O3標準溶液體積/mL;F為Na2S2O3標準溶液的滴定度;S為樣品質量/g。1.3.6 CV的測定
參照Endo等[14]的方法,定時稱取黃鰭金槍魚油10 mg用1 mL正丁醇溶解。取0.5 mL加入0.5 mL 0.05%的2,4-DNPH溶液,40 ℃水浴加熱20 min。冷卻至室溫后加入4 mL 8% KOH溶液混勻,2 000 r/min離心5 min。取上清液于波長420 nm處測定吸光度。另取0.5 mL反-2-癸烯醛標準溶液按照上述步驟操作,CV表示為μmol羰基化合物量/g魚油。
1.3.7 色差值的測定
定時取紅鮭魚肉6 g向其加入氯仿-甲醇(2∶1,V/V)的混合溶液27.5 mL,勻漿過濾。取其殘渣再加入氯仿-甲醇(2∶1,V/V)的混合溶液16.5 mL,勻漿過濾后合并濾液。向其加入0.9% NaCl溶液,振蕩混勻,離心10 min得兩相液面。取下層氯仿溶液3 mL置于玻璃皿中,用手持式色差計測定紅度值(a*)的變化。
1.4 數據處理
采用Tukey-Kramer post-hoc test對實驗結果進行差異顯著性分析,用Excel 2010軟件對數據進行平均數和標準偏差的統計分析并作圖。
2 結果與分析
2.1 黃鰭金槍魚油極性化合物含量的測定
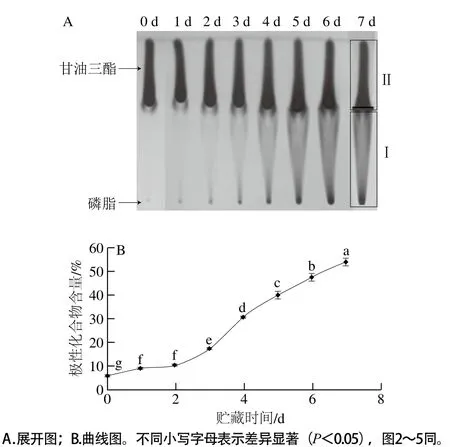
圖1 黃鰭金槍魚油貯藏過程中極性化合物含量的變化Fig. 1 Time course of the amount of polar compounds in yellowfin tuna oil during storage
從圖1A中第0天的展開圖譜可以看出,黃鰭金槍魚油中的甘油三酯含量較高,而磷脂含量較低。在50 ℃伴隨貯藏時間的延長,圖中Ⅰ部分的顏色逐漸加深,說明比甘油三酯極性強的化合物在逐漸形成,這些極性化合物是魚油氧化酸敗生成的比甘油三酯極性較強化合物的統稱,主要包括過氧化物、分解生成物、聚合物及游離脂肪酸等[10-11]。利用面積分析軟件將極性化合物Ⅰ占全脂質(Ⅰ+Ⅱ)的比例作為極性化合物含量的表示方法。如圖1B所示,極性化合物含量隨貯藏時間的延長逐漸增加,和圖1A中觀察到的Ⅰ部分顏色的變化趨勢基本一致。該方法平行處理5 份,相對標準偏差在0.15%~1.49%之間,可見該方法重復性和穩定性較好。2.2 黃鰭金槍魚油的POV變化
POV是評判油脂氧化酸敗程度的重要指標,一般POV越高其氧化酸敗程度也越嚴重[7]。如圖2A所示,隨著貯藏時間的延長,曲線呈一定的上升趨勢,說明黃鰭金槍魚油發生了不同程度的氧化酸敗。同時發現該曲線的上升趨勢與圖1B中極性化合物曲線的上升趨勢較為接近,比較極性化合物含量與POV的相關性,發現它們具有較好的正相關性(R=0.993 8)(圖2B)。
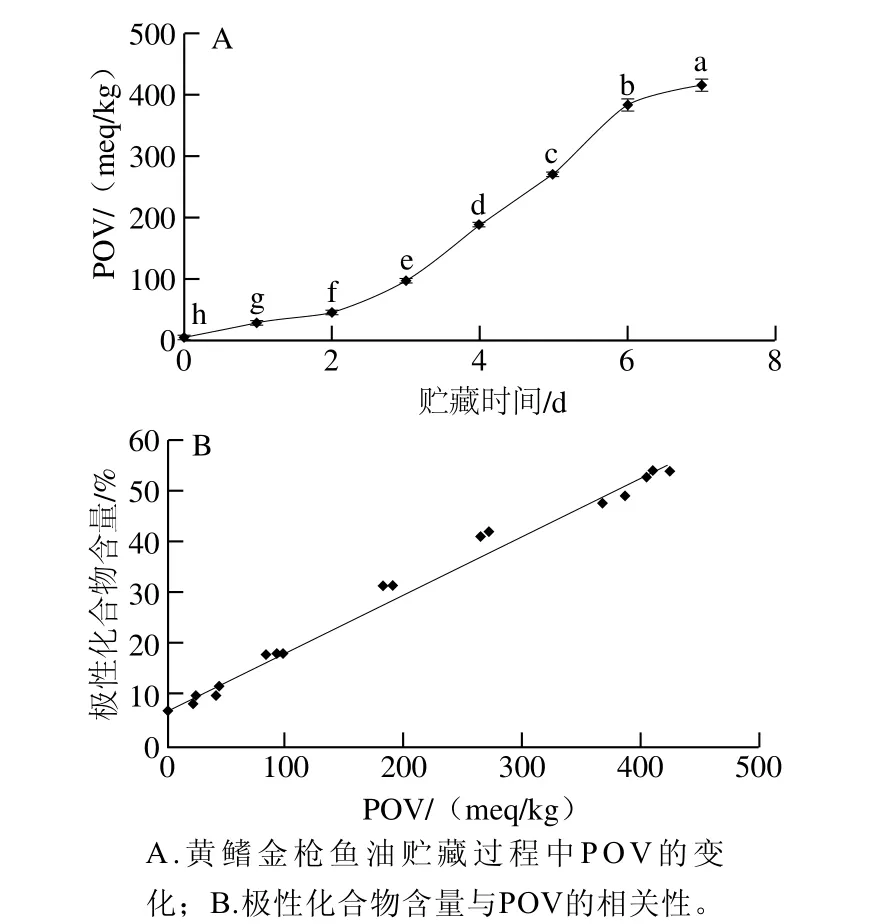
圖2 極性化合物含量與POV的相關性Fig. 2 Correlation between the amount of polar compounds and POV
2.3 黃鰭金槍魚油的CV變化
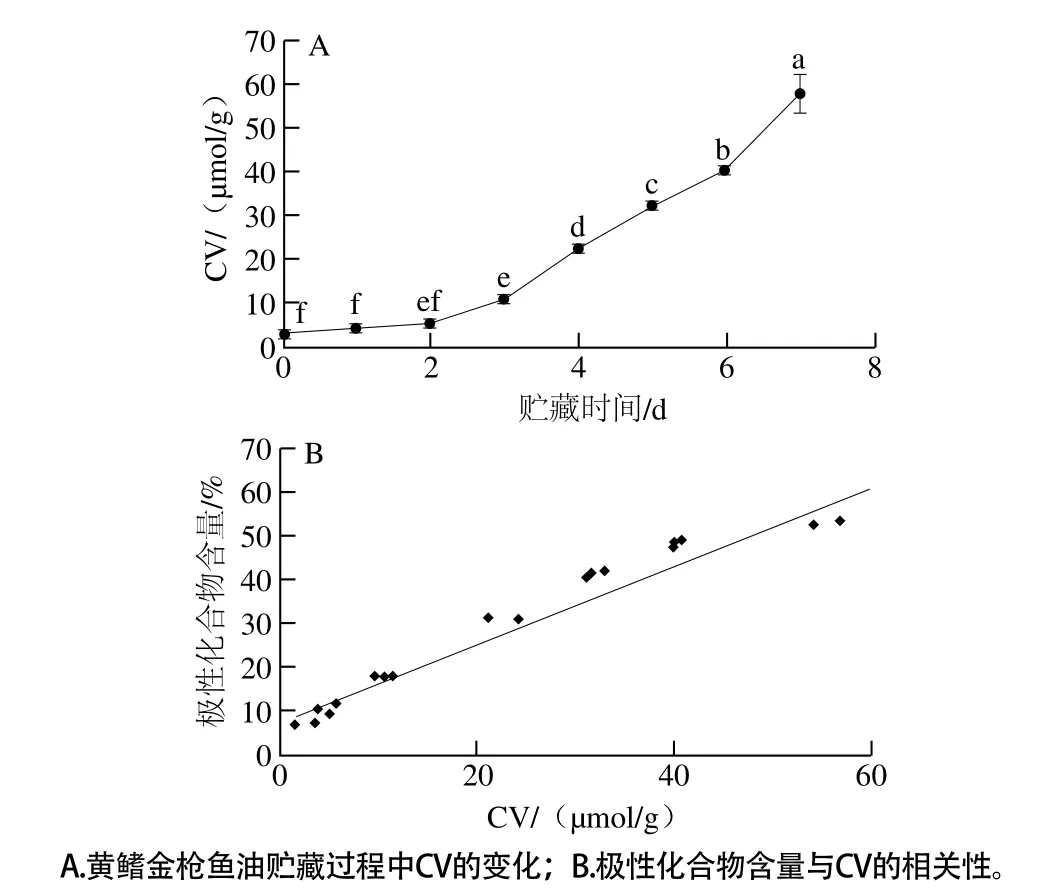
圖3 極性化合物含量與CV的相關性Fig. 3 Correlation between the amount of polar compoundsand CV
魚油在貯藏過程中受環境影響,首先氧化生成氫過氧化物,隨后分解成含羰基的化合物,這些二次產物中羰基化合物(醛、酮類化合物)的積聚量就是CV[9]。一般CV越高,其氧化生成的醛、酮等物質的量越高。如圖3A所示,隨著貯藏時間的延長,曲線呈一定的上升趨勢,說明黃鰭金槍魚油發生了不同程度的氧化酸敗。該曲線的上升趨勢也與圖1B中極性化合物曲線的上升趨勢較為接近,比較極性化合物含量與CV的相關性,發現它們也具有較好的正相關性(R=0.972 5)(圖3B)。結合極性化合物含量與POV也具有較好的正相關性,說明該方法有較好的精密度。以上結果說明利用TLC-i解析法測定該魚油的脂質氧化度是可行的。
2.4 遠東多線魚極性化合物含量的測定
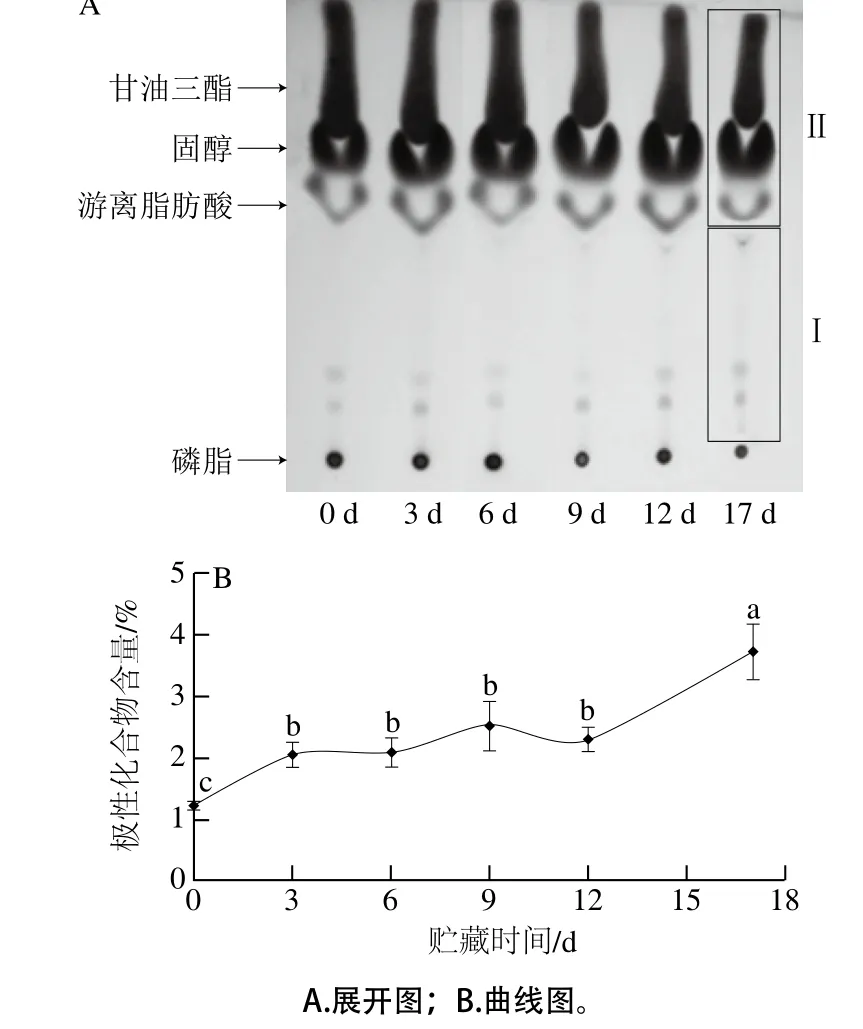
圖4 遠東多線咸魚貯藏過程中極性化合物含量的變化Fig. 4 Temporal changes in the amount of polar compounds in salted Pleurogrammus azonus during storage
咸魚由于風味獨特、易于貯存,且魚肉中含有豐富的多不飽和脂肪酸,一直深受消費者的喜愛[15]。遠東多線魚主要分布于日本北海道周圍水域[16],其含油量約為10%,多以腌制品形式銷售。但其鹽干品在加工及貯存過程中,脂肪容易氧化變質,導致產品發黃出油,造成不愉快的嗅感和味感[17-18]。遠東多線咸魚在4 ℃貯藏過程中極性化合物含量的變化如圖4A所示。第0天的展開圖譜可以看出,遠東多線咸魚的脂質主要以甘油三酯和固醇的含量較高,也有少量的游離脂肪酸和磷脂。在貯藏第3~12天時,圖中Ⅰ部分的顏色較第0天有加深的趨勢,但不明顯,貯存第17天后,圖中Ⅰ部分的顏色較第0天明顯加深,說明此時遠東多線咸魚已經發生了氧化且產生了極性化合物。利用面積分析軟件計算得到的極性化合物含量的結果如圖4B所示,遠東多線咸魚在貯藏3 d后的極性化合物含量較第0天顯著增加(P<0.05),之后沒有太大波動(P>0.05),直到第17天后極性化合物含量顯著上升(P<0.05),該結果與圖4A中觀察到的Ⅰ部分顏色的變化趨勢基本一致。
2.5 遠東多線咸魚的POV變化
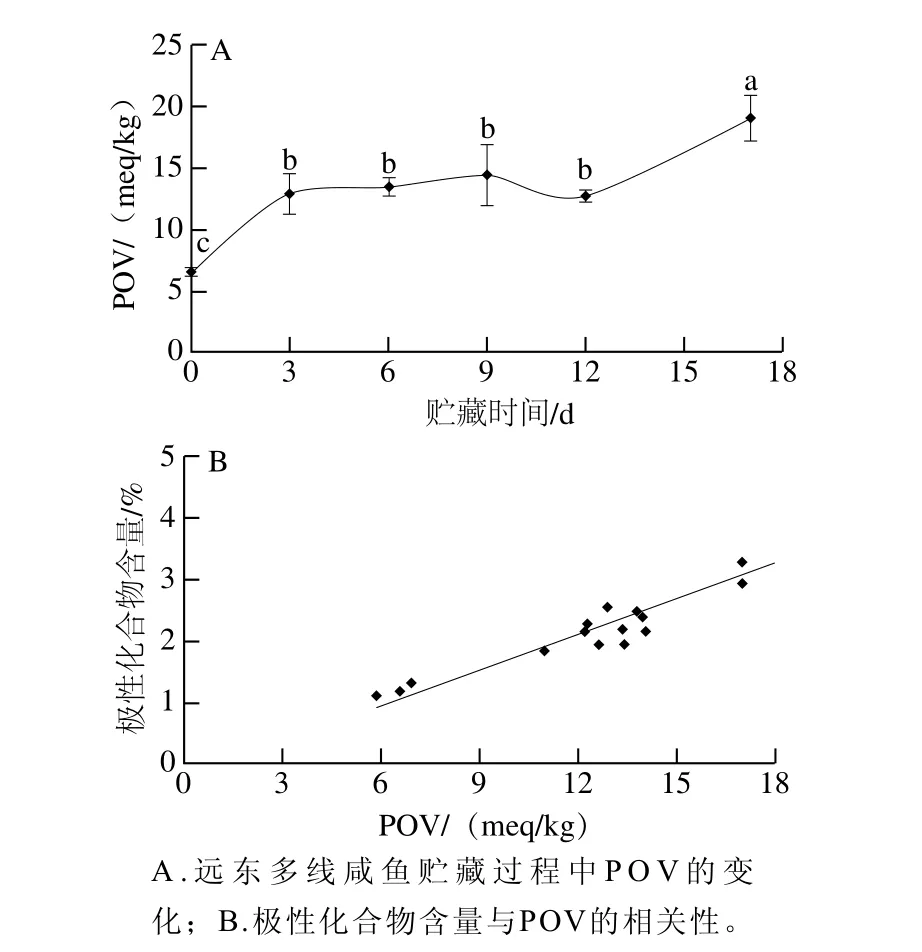
圖5 極性化合物含量與POV的相關性Fig. 5 Correlation between the amount of polar compounds and POV
如圖5A所示,隨著貯藏時間的延長,曲線呈一定的上升趨勢,在第0天的POV較低,僅為6.46 meq/kg,在貯藏第3~12天期間,POV雖有所上升,但均小于15 meq/kg,直到第17天后,POV達到19.07 meq/kg,說明此時魚肉開始發生氧化。該曲線的變化趨勢與圖4B中極性化合物曲線的上升趨勢較為接近,比較2 種方法測定結果的相關性,發現它們也具有較好的正相關性(R=0.962 5)(圖5B)。說明利用TLC-i解析法測定遠東多線咸魚的脂質氧化度是可行的。
2.6 鹽漬紅鮭極性化合物含量的測定
紅鮭,又名紅大馬哈魚,廣泛分布于從日本北部及俄羅斯至美國華盛頓州的北太平洋水域,是世界著名經濟魚種之一[19]。因其亮麗的紅色肉質和平均高達9%的含油量而深受消費者的喜愛[20]。在日本,紅鮭去頭去臟后常被切成魚段,經鹽漬后冷凍銷售。由于不飽和脂肪酸含量較高,在低溫貯藏過程中,魚肉逐步發生氧化酸敗,品質逐漸降低[21]。鹽漬紅鮭在-5 ℃貯藏過程中極性化合物含量的變化如圖6A所示。氧氣組第0天的展開圖譜可以看出,鹽漬紅鮭脂質中主要以甘油三酯和固醇的含量較高,也有少量的游離脂肪酸、甘油二酯和磷脂。伴隨貯藏時間的延長,圖中Ⅰ部分的顏色逐漸加深,說明鹽漬紅鮭發生了氧化酸敗且產生了極性化合物。而對照組在-5 ℃貯藏過程中Ⅰ部分的顏色也有加深的趨勢,但不如氧氣組圖譜變化顯著。利用面積分析軟件計算得到的極性化合物含量如圖6B所示,隨著貯藏時間的延長,氧氣組和對照組的極性化合物含量均呈現逐漸增加的趨勢,說明紅鮭都發生了不同程度的氧化酸敗。其中,氧氣組的曲線上升速率快于對照組,在第3周極性化合物的含量已達到8.83%,顯著高于對照組(P<0.05)。
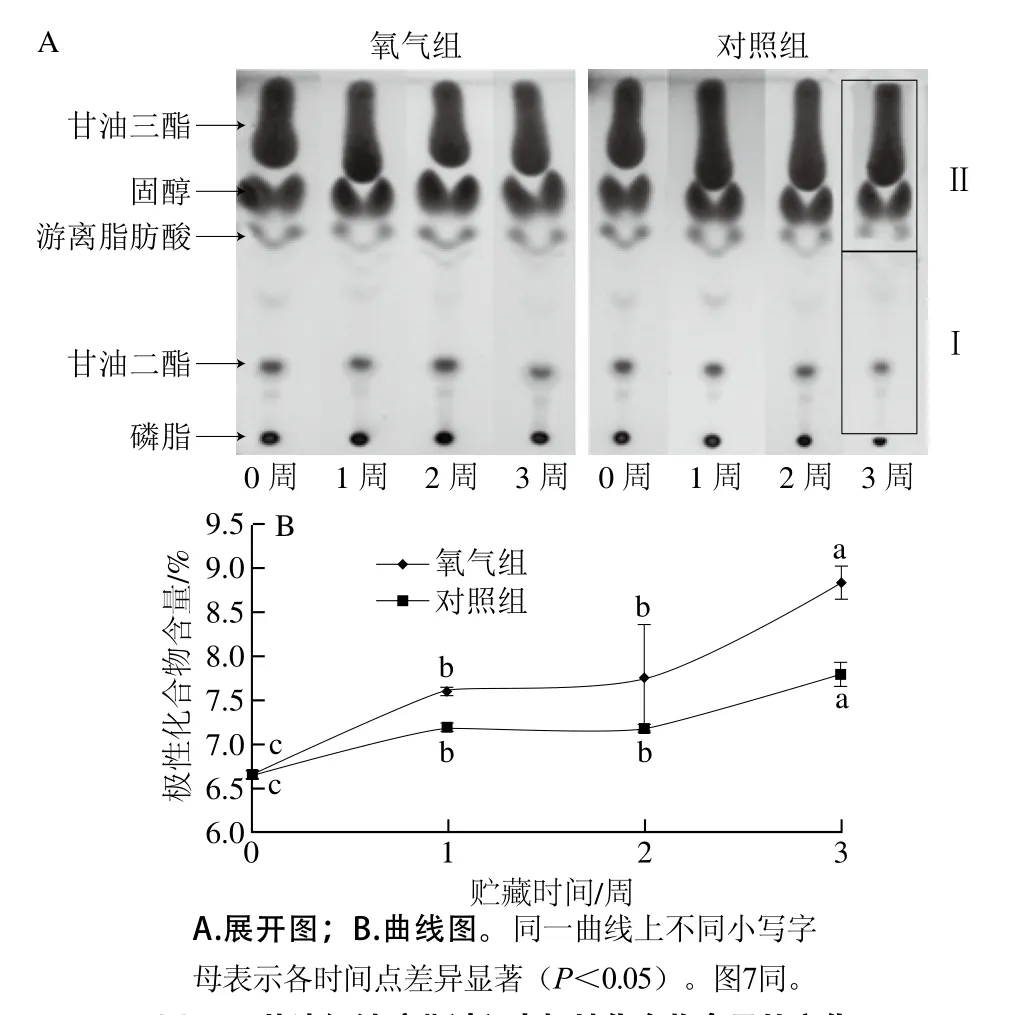
圖6 鹽漬紅鮭貯藏過程中極性化合物含量的變化Fig. 6 Temporal changes in the amount of polar compounds in salted Oncorhynchus nerka during storage
2.7 鹽漬紅鮭a*值的變化
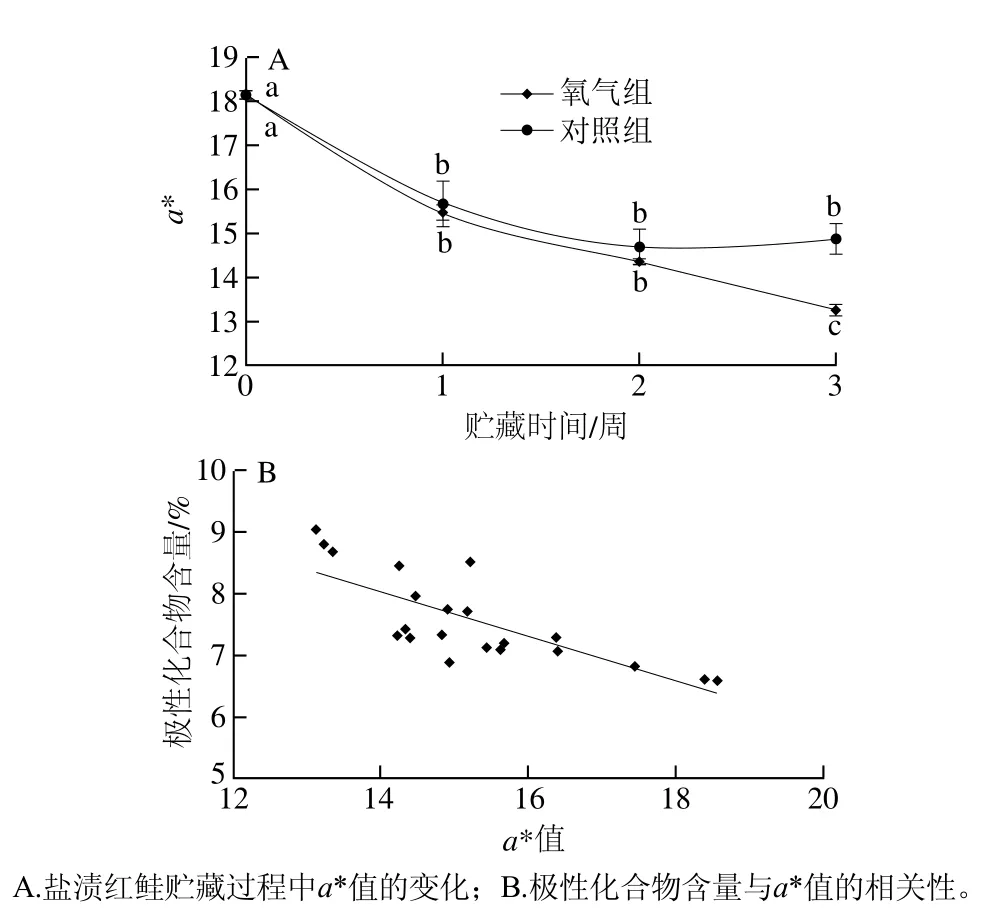
圖7 極性化合物含量與a*值的相關性Fig. 7 Correlation between the amount of polar compounds and a*
由于紅鮭體表顏色鮮艷,會對常規POV、TBARS等方法的測定造成干擾,本實驗選用a*值來評價鹽漬紅鮭在-5 ℃貯藏期間體表顏色的變化。如圖7A所示,隨著貯藏時間的延長,氧氣組和對照組的a*值呈一定的下降趨勢,在第3周氧氣組的a*值顯著低于對照組(P<0.05),說明鹽漬紅鮭在冷凍過程中橙色的顯色物質蝦青素等類胡蘿卜素物質因氧化而被破壞[21]。該曲線的下降趨勢與圖6B中極性化合物曲線的上升趨勢較為類似,比較2 種方法測定結果的相關性,發現它們具有較好的負相關性(R=-0.822 9)(圖7B)。同時,有文獻[22]報道三文魚的a*值與TBARS值有很強的相關性,這些說明了在難以用常規的POV、TBARS等方法測定鹽漬紅鮭的脂質氧化度中,利用TLC-i解析法測定具有潛在的價值。
3 討 論
魚類在貯藏過程中,由于受到酶、微生物、氧等內外因素的影響,極易腐敗變質。其中脂肪氧化是導致魚體腐敗變質的主要原因。多不飽和脂肪酸的存在使魚體即使在低溫貯藏過程中易發生脂肪氧化,生成醛、酮、醇等化合物,不僅引起魚肉質地、風味變差,還縮短了保存期[23-24]。目前大部分的測定方法存在測定程序繁瑣、所需化學試劑多、時間長等問題,只適應于實驗室檢測,難以滿足現代社會對食品安全檢測技術簡便、快速、準確及現場化測定的要求[2]。
以甘油三酯為主成分的脂質在氧化過程中,比甘油三酯極性較強的化合物在逐步形成[25]。食用油在高溫煎炸過程中,由于光、熱、水及微生物等作用,甘油三酯中不飽和脂肪酸的不飽和鍵發生氧化、裂解、聚合等一系列反應,生成比甘油三酯極性大的一些化合物[26]。這些極性化合物的含量通常使用傳統方法層析柱分離法進行測定,近年來也有運用薄層色譜法通過特定指示劑在各種高溫氧化油中的比移值與極性化合物含量的線性關系來進行測定[27]。該指標的檢測目前在歐洲已成為煎炸油的管理指標[28]。Kaitaranta等[25]曾利用棒狀薄層色譜-氫火焰離子化檢測器(thin layer chromatography flame ionization detector,TLC-FID)定量測定在加速氧化過程中魚油所產生的極性脂質含量,發現極性脂質含量的增多與魚油質量的增加具有直接的線性關系。木村友紀等[29]也曾利用TLC-FID來測定沙丁魚油在氧化過程中生成的氫過氧化物及極性更強的二次氧化產物。TLC-FID是將樣品液點在專用的色譜棒上,經溶劑展開后,將此色譜棒通過適當的機械傳動裝置,水平地穿過檢測氫火焰的中心,使化合物燃燒裂解,形成離子碎片和自由電子,再由電極收集它們并產生與化合物量呈正比的電流信號而測出各物質的含量[30]。該方法雖然分離效果好,分析精度高,可快速簡便地進行脂質成分分析,但需要昂貴的設備來實現操作。本實驗以黃鰭金槍魚油為例建立了TLC-i解析法,魚油經薄層色譜分離后,將氧化生成的比甘油三酯極性強的化合物利用面積分析軟件進行半定量,其結果與POV、CV法相比具有較好的正相關性。同時,利用該法評價了遠東多線咸魚在4 ℃貯藏過程中的脂質氧化度,其結果與POV具有較好的正相關性。評價了鹽漬紅鮭在-5 ℃貯藏過程中的脂質氧化度,其結果與a*值具有較好的負相關性。說明利用TLC-i解析法評價魚肉的脂質氧化度是可行的。
該方法與目前常用的脂質氧化評價方法POV相比,魚油所需量大幅降低,食品安全國家標準食品中POV的滴定法[31]規定每測定一個樣品需要魚油2~3 g,Bilinski等[13]的解析法中魚油的需要量為50 mg,本實驗所開發的TLC-i解析法魚油需要量僅為0.5 μL,約是國家標準中魚油需要量的1/4~1/6。同時,該方法所需溶劑量較少,操作簡單,多個樣品可同時分析,測定時間大大縮短,脂質的氧化情況可從TLC圖譜中直觀看出。具有簡單化、快速化、微量化、可視化的特點。
4 結 論
本實驗采用TLC分離、顯色、半定量分析處理方法,建立了TLC-i解析法快速測定魚類氧化生成的極性化合物含量的方法以評價魚肉的脂質氧化度。取魚油0.5 μL點樣于硅膠板上,用正己烷-乙醚-醋酸(30∶70∶1,V/V)的混合液展開12 min后,3%醋酸銅磷酸溶液噴霧顯色,150 ℃加熱15 min后,將氧化生成的極性化合物通過面積分析軟件進行半定量分析。其結果分別與POV、CV具有較好的相關性,相關系數分別為0.993 8和0.972 5,且具有較好的重復性和穩定性。將此方法用于判定遠東多線咸魚在4 ℃貯藏期間的脂質氧化情況,發現極性化合物含量與POV具有較好的正相關性(R=0.962 5)。將此方法用于判定鹽漬紅鮭在-5 ℃貯藏期間的脂質氧化情況,發現極性化合物含量與a*值具有較好的負相關性(R= -0.822 9)。這些結果表明,該方法具有簡單化、快速化、微量化、可視化的優點,且不需要昂貴的設備,適合魚肉脂質氧化度的快速評價。
[1] 米紅波, 劉爽, 李學鵬, 等. 天然抗氧化劑在抑制水產品貯藏過程中脂質氧化的研究進展[J]. 食品工業科技, 2016, 37(8): 364-368; 373. DOI:10.13386/j.issn1002-0306.2016.08.068.
[2] 孫月娥, 王衛東. 國內外脂質氧化檢測方法研究進展[J]. 中國糧油學報, 2010, 25(9): 123-128.
[3] 藤本健四郎. 魚の脂質の特徴と食品機能[J]. 日本調理科學會誌, 2006, 39(5): 271-276.
[4] LI H T, ZHOU X Q, GAO P, et al. Inhibition of lipid oxidation in foods and feeds and hydroxyl radical-treated fish erythrocytes: a comparative study of Ginkgo biloba leaves extracts and synthetic antioxidants[J]. Animal Nutrition, 2016, 2(3): 234-241. DOI:10.1016/ j.aninu.2016.04.007.
[5] 齋藤洋昭. 水産脂質劣化の機構と評価法の開発[J]. 中央水產研究所研究報告, 1996(8): 61-76.
[6] 李春煥, 王曉琴, 曾秋梅. 植物油脂氧化過程及機理、檢測技術以及影響因素研究進展[J]. 食品與發酵工業, 2016, 42(9): 277-284. DOI:10.13995/j.cnki.11-1802/ts.201609046.
[7] 曹文明, 王鑫, 包杰, 等. 油脂氧化評價研究進展[J]. 糧食與油脂, 2013, 26(4): 1-5.
[8] 張榮華, 陳瑤. 食用油脂過氧化值檢測方法的研究[J]. 糧食與食品工業, 2012, 19(6): 97-100. DOI:10.3969/j.issn.1672-5026.2012.06.039.
[9] 王建輝, 劉永樂, 劉冬敏, 等. 凍藏期間草魚魚片脂肪氧化變化規律研究[J]. 食品科學, 2013, 34(6): 243-246.
[10] 陳蕾, 鮑俊杰, 王灼琛, 等. 偽劣油脂極性物質的快速檢測研究[J].農產品加工(學刊), 2014(1): 59-61. DOI:10.3969/jissn.1671-9646(X).2014.01.020.
[11] 李啟艷, 謝強勝, 刁飛燕, 等. 魚油的化學成分及其藥理活性研究進展[J]. 藥物分析雜志, 2016, 36(7): 1157-1161. DOI:10.16155/j.0254-1793.2016.07.03.
[12] FOLCH J, LEES M, STANLEY G H S. A simple method for the isolation and purification of total lipids from animal tissues[J]. Journal of Biological Chemistry, 1957, 226(1): 497-509.
[13] BILINSKI E, JONAS R E E, LAU Y C. Chill storage and development of rancidity in frozen Pacific herring, Clupea harengus pallasi[J]. Journal of the Fisheries Research Board of Canada, 1978, 35: 473-477.
[14] ENDO Y, TOMINAGA M, MISAKO T E, et al. A modified method to estimate total carbonyl compounds in frying oils using 1-butanol as a solvent[J]. Journal of Oleo Science, 2003, 52(7): 353-358.
[15] 李君珂, 劉森軒, 劉世欣, 等. 花椒葉多酚提取物對白鰱咸魚脂肪氧化及脂肪酸組成的影響[J]. 食品工業科技, 2015, 36(15): 109-113. DOI:10.13386/j.issn1002-0306.2015.15.015.
[16] 龐景貴. 日本北海道周圍水域遠東多線魚(Pleurogrammus azonus)資源開發現狀[J]. 現代漁業信息, 1990(4): 13-14.
[17] LI J K, WANG F L, LI S, et al. Effects of pepper (Zanthoxylum bungeanum Maxim.) leaf extract on the antioxidant enzyme activities of salted silver carp (Hypophthalmichthys molitrix) during processing[J]. Journal of Functional Foods, 2015, 18: 1179-1190. DOI:10.1016/j.jff.2014.07.018.
[18] LI J K, HUI T, WANG F L, et al. Chinese red pepper (Zanthoxylum bungeanum Maxim.) leaf extract as natural antioxidants in salted silver carp (Hypophthalmichthys molitrix) in dorsal and ventral muscles during processing[J]. Food Control, 2015, 56: 9-17. DOI:10.1016/ j.foodcont.2015.03.001.
[19] 王尊, 謝晶. 不同保鮮方法對三文魚品質影響的研究進展[J]. 包裝工程, 2016, 37(9): 80-85; 119.
[20] 張寧, 謝晶. 三文魚的保鮮方法及研究進展[J]. 食品與機械, 2015, 31(3): 256-259. DOI:10.13652/j.issn.1003-5788.2015.03.057.
[21] 張新林, 謝晶, 郝楷, 等. 不同低溫條件下三文魚的品質變化[J]. 食品工業科技, 2016, 37(17): 316-321. DOI:10.13386/ j.issn1002-0306.2016.17.053.
[22] 吳行印, 謝晶, 張新林, 等. 動力學模型預測三文魚在不同溫度的貨架期[J]. 包裝工程, 2017, 38(3): 1-6.
[23] 王亞青, 程裕東, 袁春紅. 凍藏過程中魚類脂肪氧化的研究現狀[J]. 中國食品學報, 2003, 3(1): 97-101. DOI:10.3969/ j.issn.1009-7848.2003.01.018.
[24] 吳娜, 王錫昌, 陶寧萍, 等. 動物源食品中脂質氧化降解產物檢測的研究進展[J]. 食品安全質量檢測學報, 2014, 5(10): 3042-3046.
[25] KAITARANTA J K, KE P J. TLC-FID assessment of lipid oxidation as applied to fish lipids rich in triglycerides[J]. Journal of the American Oil Chemists’ Society, 1981, 58(6): 710-713.
[26] 康雪梅. 煎炸油中極性成分測定方法的研究[D]. 鄭州: 河南工業大學, 2015.
[27] 李昌模. 薄層色譜法測定油脂中極性化合物含量[J]. 中國油脂, 2007, 32(11): 77-79. DOI:10.3321/j.issn:1003-7969.2007.11.022.
[28] HARA S, OGAWA E, TOTANI Y. Evaluation of heat-deteriorated oils. Ⅰ. TLC-FID method for determining polar compounds content[J]. Journal of Oleo Science, 2006, 55(4): 167-172.
[29] 木村友紀, 宮下和夫. イワシ油の酸化により生成する過酸化物とアルデヒド含量の関係[J]. 北海道大學水産科學研究彙報, 2003, 54(3): 53-57.
[30] 彭元懷, 楊國龍, 畢艷蘭, 等. 棒狀薄層色譜/氫火焰離子化檢測器(TLC/FID)在脂質分析中的應用[J]. 糧油加工, 2007(1): 49-51.
[31] 國家衛生和計劃生育委員會.食品中過氧化值的測定: GB 5009.227—2016[S]. 北京: 中國標準出版社, 2016: 1-3.
Rapid Identification of Lipid Oxidation Levels in Fish by Thin Layer Chromatography Image Analysis Technique
YU Hui1, SATO Minoru2, YAMAGUCHI Toshiyasu2, NAKANO Toshiki2
(1. School of Food Engineering, Ludong University, Yantai 264025, China; 2. Graduate School of Agricultural Science, Tohoku University, Sendai 981-8555, Japan)
In this study, we developed a rapid method to determine the amount of polar compounds generated from lipid oxidation in fish based on thin layer chromatography (TLC) and image analysis in order to identify the extent of lipid oxidation in fish. The chromatographic separation of yellowfin tuna (Thunnus albacores) oil (0.5 μL) was performed on TLC plates using hexane-diethyl ether-acetic acid (30:70:1, V/V) as a mobile phase for 12 min. Color development was carried out by spaying the plates with 3% copper acetate in phosphoric acid and heating them at 150 ℃ for 15 min. The polar compounds derived from lipid oxidation during the heating process were semiquantitatively determined by area calculation with a special software. It was indicated that the amount of polar compounds measured by TLC was highly correlated with two common lipid oxidation parameters of peroxide value (POV) and carbonyl value (CV) with a correlation coefficient (R2) of 0.993 8 and 0.972 5, respectively. Furthermore, a good positive correlation between the measured amount of polar compounds and POV with a correlation coefficient of 0.962 5 was observed for salted Pleurogrammus azonus stored at 4 ℃, while salted sockeye salmon (Oncorhynchus nerka) stored at ?5 ℃ showed a good negative correlation between this measured parameter and color parameter a* value with a correlation coefficient of ?0.822 9. These results strongly suggest that TLC image analysis has the advantages of simplicity, rapidity, microscale quantitation and easy visualization without the need for expensive equipment.
TLC-i analysis; lipid oxidation; polar compounds; rapid detection
10.7506/spkx1002-6630-201714047
TS207.7
A
1002-6630(2017)14-0304-06
于慧, 佐藤實, 山口敏康, 等. 薄層色譜畫像解析法快速判定魚肉的脂質氧化度[J]. 食品科學, 2017, 38(14): 304-309.
DOI:10.7506/spkx1002-6630-201714047. http://www.spkx.net.cn
YU Hui, SATO Minoru, YAMAGUCHI Toshiyasu, et al. Rapid identification of lipid oxidation levels in fish by thin layer chromatography image analysis technique[J]. Food Science, 2017, 38(14): 304-309. (in Chinese with English abstract)
DOI:10.7506/spkx1002-6630-201714047. http://www.spkx.net.cn
2017-02-04
教育部留學回國人員科研啟動基金項目(第49批);魯東大學引進人才項目(LY2013022)
于慧(1982—),女,講師,博士,研究方向為水產品加工與貯藏。E-mail:zoehuihui@hotmail.com

