HPLC-ELSD法同時測定鮮棗果實中不同種類可溶性糖含量
蒲小秋,白紅進,馬倩倩,吳翠云,*
(1.塔里木大學植物科學學院,新疆生產建設兵團南疆特色果樹生產工程實驗室,新疆 阿拉爾 843300;2.塔里木大學 新疆生產建設兵團塔里木盆地生物資源保護利用重點實驗室,新疆 阿拉爾 843300)
HPLC-ELSD法同時測定鮮棗果實中不同種類可溶性糖含量
蒲小秋1,白紅進2,馬倩倩2,吳翠云1,*
(1.塔里木大學植物科學學院,新疆生產建設兵團南疆特色果樹生產工程實驗室,新疆 阿拉爾 843300;2.塔里木大學 新疆生產建設兵團塔里木盆地生物資源保護利用重點實驗室,新疆 阿拉爾 843300)
采用高效液相色譜-蒸發光散射檢測器建立鮮棗果實中不同種類可溶性糖含量的測定方法。結果表明:適宜分離條件為Waters XBridgeTMAmide色譜柱(4.6 mm×250 mm,5 μm),流動相A為0.2%三乙胺的超純水溶液,流動相B為0.2%三乙胺-乙腈溶液,兩相體積比為24∶76,柱溫30 ℃,霧化管溫度60 ℃,漂移管溫度60℃,氣流量1.6 L/min,增益值1.0。在該條件下鼠李糖、阿拉伯糖、果糖、甘露糖、葡萄糖、蔗糖、麥芽糖和乳糖均能得到較好分離(分離度≥1.5),在0.099~1.040 ng/μL范圍內呈良好線性關系,8 種糖的加標回收率在93.1%~111.2%之間,相對標準偏差均小于5%;檢出限(RSN=3)在0.008~0.03 ng/μL之間。該方法具有操作簡便、分離效果好、分離時間短等特點,可用于鮮棗果實中不同種類可溶性糖含量的測定,與傳統方法相比較更加靈敏準確,有利于品質鑒定。
鮮棗;高效液相色譜-蒸發光散射檢測器;水溶性糖;單糖;低聚糖
棗(Ziziphus jujube Mill.)為鼠李科棗屬植物,在我國栽培面積僅次于蘋果和柑橘,產量(占世界99%)居干果中第1位[1]。新疆位于我國西北部,地域遼闊,土地資源豐富,屬溫帶大陸性氣候,日照時間長、晝夜溫差大,其優越的地理環境促使新疆棗產業發展迅速,截止到2012年9月,新疆全區紅棗面積已達675萬 畝[2],研究認為新疆產棗果的品質優于內地,遠超過其原產地[3-5]。棗果實主要營養成分有糖類、蛋白質、脂肪、無機元素、維生素及其他活性物質,是深受人們喜愛的藥食兼用品種[6-8],其中棗果實糖分的種類、含量及比率對果實風味、色澤和其他營養成分有重要影響,是決定棗果實品質和商品價值的主要因素[9]。
王永康[10]制定的優異種質資源判定標準指出,可溶性固形物含量、可溶性糖含量等指標是棗果品質評價的重要指標。果實中可溶性糖分的測定方法有分光光度法、氣色相色譜法、高效毛細管電泳法和高效液相色譜(high performance liquid chromatography,HPLC)法等[11]。HPLC法測定果實中可溶性糖含量時步驟相對簡單,對單糖和低聚糖的分析效果較好,被廣泛應用于糖類的檢測[12-15]。目前利用HPLC法測定棗果實糖含量已有報道,孫濤等[12]利用HPLC和示差檢測器檢測山西交城縣的駿棗、河南新鄭的灰棗及南疆部分地區的駿棗糖組分,測得4 種糖組分分別為果糖、葡萄糖、蔗糖和麥芽糖;趙仁邦[16]利用利用HPLC和示差檢測器檢測出阜平大棗中存在鼠李糖、阿拉伯糖、果糖、葡萄糖、半乳糖和蔗糖,多糖酸解液中檢測出鼠李糖、阿拉伯糖、果糖、葡萄糖、半乳糖和甘露糖組分;吉爽爽[17]利用HPLC和紫外檢測器測定了8 種棗品種多糖組成,結果表明8 個品種棗多糖中均含有甘露糖、鼠李糖、半乳糖醛酸、葡萄糖、半乳糖和阿拉伯糖等單糖,但其單糖組成比例差異較大。不同測定方法的結果往往差異較大,同一種方法應用于不同的植物多糖其差異也較大。利用HPLC和蒸發光散射檢測器(evaporative light-scattering detector,ELSD)同時測定不同鮮棗品種中鼠李糖、阿拉伯糖、果糖、甘露糖、葡萄糖、蔗糖、麥芽糖和乳糖含量鮮有報道。
本研究旨在利用HPLC和ELSD聯用技術,建立同時測定鮮棗果實中葡萄糖、果糖、蔗糖、麥芽糖、乳糖、鼠李糖、阿拉伯糖和甘露糖含量的方法,并與分光光度法進行比較,旨在找出快捷、準確測定鮮棗果實中多種糖組分及準確判斷棗品質的方法,以期對果實品質鑒定和資源開發提供理論依據。
1 材料與方法
1.1 材料與試劑
2015年9月下旬到10月上旬采集于塔里木大學棗種質資源圃的成熟棗果。品種分別為:京39、新鄭紅1號、金絲小棗、樂金3號、滕州躺棗、灰棗、駿棗、觀音棗、金絲蜜和冬棗。在品種資源圃中選擇樹體、樹齡(6~8 a生)基本一致的棗樹,根據棗成熟果實的取樣標準在每個品種樹冠外圍中上部相同方位分別隨機采摘20 個果實,液氮速凍后-80 ℃保存。為保證不同品種之間果實成熟度的一致性,成熟果實的取樣標準為果實充分著色后5 d進行采樣。
可溶性糖標準品 中國食品檢驗所;乙腈和三乙胺(triethylamine,TEA)均為色譜純,其他試劑均為國產分析純。
1.2 儀器與設備
1260型HPLC儀(配有G1311C型四元泵、G1329B自動控溫自動進樣器、G1316A柱溫箱、G4260B ELSD、OpenLAB CDS色譜工作站) 美國Agilent公司;FA1104N電子分析天平 上海菁海儀器有限公司;HH-S6數顯恒溫水浴鍋 金壇市醫療儀器廠;H2100R高速冷凍離心機 湖南湘儀實驗室儀器開發有限公司;RV-10控制型旋轉蒸發儀 廣州儀科實驗室技術有限公司。
1.3 方法
1.3.1 色譜條件
Waters XBridgeTMAmide色譜柱(4.6 mm×250 mm, 5 μm);流動相A為含0.2% TEA的超純水溶液,流動相B為0.2% TEA-乙腈溶液,兩相體積比為24∶76;流速1.0 mL/min;柱溫30 ℃;進樣量10 μL。
ELSD參數:霧化管溫度60 ℃;漂移管溫度60 ℃;增益值1.0;載氣為氮氣;流速1.6 L/min。
1.3.2 標準溶液的配制
分別精密稱取L-鼠李糖、D-阿拉伯糖、D-木糖、D-果糖、L-甘露糖、D-葡萄糖、D-蔗糖、D-麥芽糖標準品0.010 0 g(精確至0.000 1 g),用超純水溶解并定容至2 mL,搖勻,此溶液質量濃度均為5 ng/μL,過0.45 μm微孔濾膜,4 ℃冰箱保存備用。使用時,將糖混合標準溶液用超純水稀釋配制成1、0.8、0.6、0.4、0.2、
0.1 ng/μL 6 個不同質量濃度的標準液。
1.3.3 供試樣品的制備
精密稱取1.000 g速凍果肉,低溫冷凍研磨儀研磨,加10 mL 80%乙醇溶液,80 ℃水浴30 min,4 000 r/min離心10 min取上清液,殘渣用80%乙醇溶液重復提取2 次,合并濾液,減壓蒸餾除去乙醇,用超純水定容至25 mL,過0.45 μm微孔濾膜,濾液用于測定棗果中的可溶性糖含量。
1.3.4 分光光度分析法
還原糖、蔗糖和總糖含量的測定參照張友杰[18]的方法,可溶性固形物的測定參照趙志華等[19]的方法。
2 結果與分析
2.1 色譜條件的選擇
2.1.1 流動相和色譜柱溫度的選擇
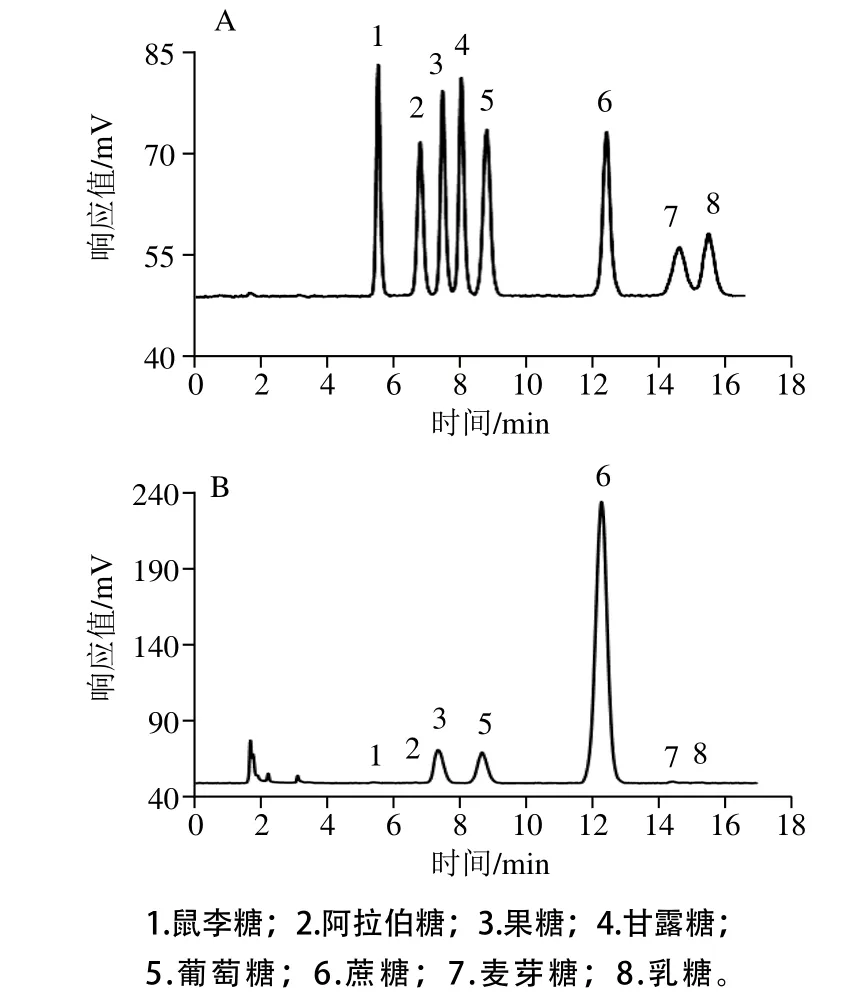
圖1 標準品(A)和冬棗樣品(B)HPLC譜圖Fig. 1 Chromatograms of mixed sugar standards (A) and watersoluble sugars from Dongzao jujube (B) by HPLC analysis
本實驗選擇Waters XBridgeTMAmide(4.6 mm×250 mm,5 μm)色譜柱,考察糖類化合物在該色譜柱上的分離情況。結果表明,在流動相中加入TEA時可以防止待測糖分同分異構體的出現,使峰形尖銳,但信噪比增加,且TEA含量過高會造成色譜柱損傷;提高流動相中水的比例可縮短分離時間,但分離效果變差峰重疊,特別是麥芽糖和乳糖,降低流動相中水的比例可增加分離度,但分離時間延長、峰展寬嚴重;升高柱溫可使峰形變得尖銳,信噪比降低,但分離度下降。綜合考慮以上因素,以含0.2% TEA的超純水溶液作為A相,以0.2% TEA-乙腈溶液作為B相,兩相體積比為24∶76,流速1.0 mL/min,柱溫為30 ℃時可以實現基線分離(分離度≥1.5),如圖1所示。
2.1.2 ELSD條件的選擇
漂移管溫度和載氣流速是ELSD的2 個重要參數,漂移管溫度影響檢測器的響應,溫度升高,流動相蒸發趨于完全,信噪比上升,但溫度過高,可能導致分析物部分汽化,信號響應值變小。霧化載氣流速影響霧化器中液滴的形成,從而影響檢測器的響應,信噪比隨載氣流速的增加而升高,但當霧化氣流量過大時,氣溶膠液滴的變小會造成待測成分響應信號較大程度的降低,增益值越高信號響應值越大,但信噪比增加,一般選用1.0,增益值的高低取決于樣品含糖量。因此,綜合考慮本實驗選擇霧化器溫度60 ℃,漂移管溫度60 ℃,增益值1.0,氮氣為載氣,流速1.6 L/min,可達到最小的噪聲信號,色譜圖基線平穩。
2.2 線性回歸方程及相關系數
分別吸取標準混合溶液10 μL進樣分析,以峰面積為縱坐標,以質量濃度為橫坐標繪制標準曲線,在0.099~1.040 ng/μL之間呈良好的線性關系;將最小質量濃度的標準溶液逐級稀釋,依次進樣10 μL,以信噪比為3時的質量濃度作為檢出限(detection of limit,LOD),LOD在0.008~0.03 ng/μL之間,表明該方法的靈敏性良好,如表1所示。

表1 混合標準樣品可溶性糖含量線性關系、相關系數、LODTable 1 Linear equation, correlation coefficient (r2) and limit of detection LOD of water-soluble sugars in mixed standard solution determined by HPLC-ELSD
2.3 精密度和重復性結果
取標準混合溶液,重復進樣5 次,每次10 μL,記錄峰面積,得到8 種可溶性糖的相對標準偏差(relative standard deviation,RSD)分別為鼠李糖0.73%、阿拉伯糖1.95%、果糖0.88%、甘露糖0.41%、葡萄糖0.30%、蔗糖0.81%、麥芽糖0.62%、乳糖0.58%,在0.30%~2.00%范圍內,表明該方法的精密度良好。
取一批鮮棗果樣5 份,按照1.3.3節方法制備5 份供試品溶液,在選定色譜條件下各進樣10 μL,以峰面積為指標,其RSD分別為鼠李糖1.41%、果糖1.60%、葡萄糖0.95%、蔗糖1.80%、麥芽糖1.50%、乳糖1.80%,表明該方法的重復性良好。
2.4 回收率實驗結果
已知糖含量的棗果實樣品中分別取5 份,準確加入1 ng/μL混合標準溶液1 mL后,按照1.3.3節制備供試品溶液,在相同色譜條件下進行測定,計算其平均回收率,各可溶性糖平均回收率在93.1%~111.2%之間,表明該方法準確率較高,如表2所示。

表2 8 種糖的回收率Table 2 Recoveries of eight sugars
2.5 10 個棗品種脆熟期果實糖組分含量的比較
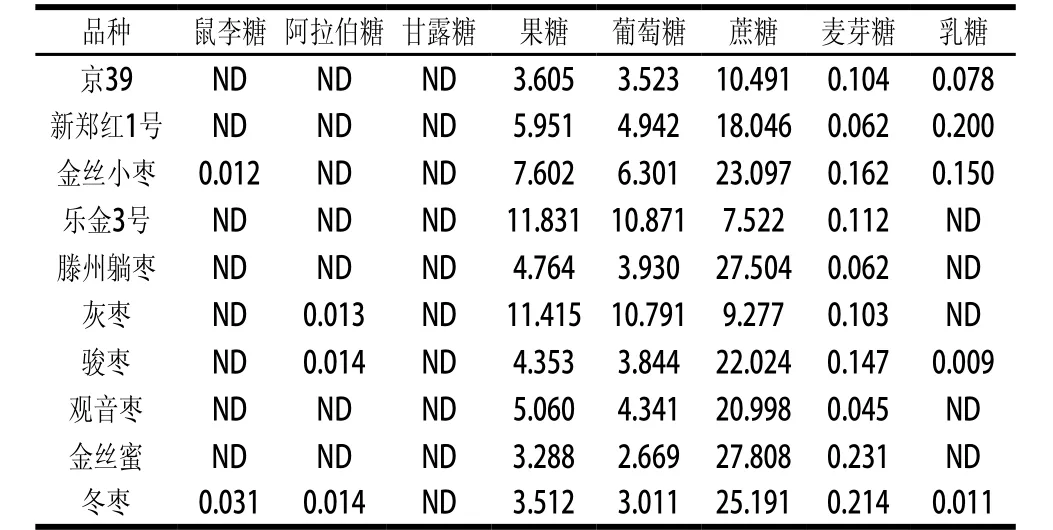
表3 HPLC-ELSD法測定鮮棗果實中不同種類可溶性糖含量Table 3 Contents of water-soluble sugars in fresh jujube determined by HPLC-ELSD
從表3可以看出,不同棗品種脆熟期果實的可溶性糖種類和含量存在一定差異。在所有參試品種中都檢測到了果糖、葡萄糖、蔗糖和麥芽糖,鼠李糖僅在金絲小棗和冬棗中被檢測到,阿拉伯糖僅在灰棗、駿棗和冬棗中檢測到,乳糖僅在京39、新鄭紅1號、金絲小棗、駿棗和冬棗中被檢測到,甘露糖在所有參試品種中都未檢測到,這與相關研究[20-22]結果一致,被檢測到的鼠李糖、阿拉伯糖、麥芽糖和乳糖含量都很低;游離的單糖和雙糖主要是果糖、葡萄糖和蔗糖,占總糖的98.9%~99.8%。在所有參試品種中果糖含量高于葡萄糖,其中,樂金3號果糖和葡萄糖含量均高于其他品種,分別為11.831%、10.871%;金絲蜜果糖和葡萄糖的含量均低于其他品種,分別為3.288%、2.669%;除灰棗和樂金3號外其他供試品種蔗糖>果糖>葡萄糖,金絲蜜蔗糖含量最高,樂京3號蔗糖含量最低,分別為27.808%、7.522%。
2.6 HPLC-ELSD法與分光光度法的比較

表4 分光光度法與HPLC-ELSD分別測定棗果實中還原糖、蔗糖和可溶性總糖含量Table 4 Contents of reducing sugar, sucrose and total soluble sugars in fresh jujube determined by spectrophotometry and HPLC-ELSD
由表4可以看出,分光光度法和HPLC-ELSD法測定還原糖、蔗糖和可溶性總糖基本一致,均為金絲蜜還原糖含量最低,京39可溶性總糖含量最低;樂京3號蔗糖含量最低,還原糖含量最高;金絲小棗可溶性總糖含量最高;但就RSD而言分光光度分析法明顯高于HPLC-ELSD法,因此判斷測定鮮棗果實還原糖、蔗糖和可溶性總糖HPLC-ELSD法優于分光光度分析法。
利用SSPS對表4進行相關性分析得到:分光光度分析法測得的還原糖、蔗糖和可溶性總糖與HPLC-ELSD測得結果呈極顯著正相關r2分別為0.985、0.907和0.961,說明本實驗的HPLC-ELSD測定結果與分光光度分析法測定的結果基本一致。可溶性固形物與HPLC-ELSD測得總糖和分光光度分析法測得的總糖呈極顯著關系,r2分別為1.00和0.908,說明本實驗建立的HPLC-ELSD法測定棗果實糖含量比分光光度分析法更接近真實值,判斷一個品種的總糖含量高低采用本實驗建立的HPLC-ELSD法更加科學可靠;甜度與HPLC-ELSD測得的總糖和可溶性固形物含量呈極顯著正相關,r2分別為0.804和0.802,而與分光光度分析法測得的總糖無顯著關系,表明利用HPLC-ELSD測定棗果實總糖含量或測定可溶性固形物可以直接判斷品種的甜度,有利于品質鑒定。
3 討 論
本實驗使用的分光光度法測定還原糖、蔗糖和可溶性總糖不需要昂貴的儀器,簡便快捷,但該方法干擾因素較多,如顯色試劑用量、顯色反應時間、冷卻時間及沸水浴時間都影響其顯色,操作條件控制不好易引起誤差,如王宏軍等[24]研究發現顯色試劑用量過多或過少都會使結果偏小;崔宏春[25]研究發現待測液冷卻時間不夠,測定時反應還未終止,使測定結果不準確,穩定性也較差,冷卻時間過長,將使絡合反應過度,生成的化合物會發生進一步聚合,產生其他物質,造成結果偏小;位杰等[26]研究發現顯色時間與糖含量之間呈負相關,隨著顯色時間的延長,可溶性糖含量逐漸下降。
利用分光光度法只能測定還原糖總量,對還原糖的種類沒有選擇;測定出的蔗糖結果常比實際值偏高,實際是以蔗糖表示的一類糖的集合,這個集合體中很可能含有非蔗糖成分,使用分光光度法對蔗糖未知物的鑒定將顯示出盲目性。
利用HPLC-ELSD法測定鮮棗果實可溶性糖含量時步驟相對簡單,無需衍生化,可溶性糖的分析效果較好,ELSD是基于色譜柱流出物霧化后的不揮發性溶質顆粒的光散射電信號對樣品的定性定量測定分析,對物質的響應不依賴于樣品的光學特性,靈敏度高、無溶劑峰干擾,有利于檢測較低含量的蔗糖,被廣泛應用于糖類的檢[27-30]。
本實驗建立了鮮棗果實中鼠李糖、阿拉伯糖、甘露糖、果糖、葡萄糖、蔗糖、麥芽糖、乳糖8 種單糖和雙糖的同時分離檢測的HPLC-ELSD方法。研究結果表明,該檢測方法樣品前處理簡便,檢測靈敏度較高,分析時間短,實際樣品檢測結果與分光光度法結果相比較表明,采用HPLC-ELSD法判斷棗品質更加科學可靠。
[1] 劉孟軍, 王玖瑞, 劉平, 等. 中國棗生產與科研成就及前沿進展[J].園藝學報, 2015, 42(9): 1683-1698. DOI:10.16420/j.issn.0513-353x.2015-0538.
[2] 張昭豹. 新疆紅棗消費市場調查研究[D]. 烏魯木齊: 新疆農業大學, 2014: 7-12.
[3] 朱銳. 新疆棗樹栽培適宜品種及關鍵技術的調查研究[D]. 北京:北京林業大學, 2010: 24-26.
[4] 馬元忠. 淺談新疆棗產業發展狀況[C]//第五屆全國干果生產、科研進展學術研討會論文集. 北京: 中國農業科學技術出版社, 2007: 52-54.
[5] 李占林. 新疆棗樹栽培與氣候因子的關系[C]//第五屆全國干果生產、科研進展學術研討會論文集. 北京: 中國農業科學技術出版社, 2007: 305-307.
[6] 魯周民, 劉坤, 閆忠心, 等. 棗果實營養成分及保健作用研究進展[J].園藝學報, 2010, 37(12): 2017-2024. DOI:10.16420/j.issn.0513-353x.2010.12.006.
[7] 畢金峰, 于靜靜, 白沙沙. 國內外棗加工技術研究現狀[J].新疆農機化, 2010, 199(3): 34-36. DOI:10.13620/j.cnki.issn1007-7782.2010.03.001.
[8] 劉世軍, 唐志書, 崔春利, 等. 大棗化學成分的研究進展[J]. 云南中醫學院學報, 2015(3): 96-100.
[9] 秦巧平, 張上隆, 謝鳴, 等. 果實糖含量及成分調控的分子生物學研究進展[J]. 果樹學報, 2005, 22(5): 519-525. DOI:10.13925/j.cnki. gsxb.2005.05.019.
[10] 王永康. 棗優異種質資源評價標準規范探討[C]//第八屆全國干果生產, 科研進展學術研討會論文集. 北京: 中國林業出版社, 2013: 73-79.
[11] 孫艷濤, 由欣. 植物組織中糖化合物測定方法的研究進展[J]. 科教文匯: 上旬刊, 2011(10): 134-136.
[12] 孫濤, 趙子剛, 劉圣紅, 等. 高效液相色譜法測定鮮棗中糖的組成[J].分析儀器, 2015(1): 38-41.
[13] MA C, SUN Z, CHEN C, et al. Simultaneous separation and determination of fructose, sorbitol, glucose and sucrose in fruits by HPLC-ELSD[J]. Food Chemistry, 2014, 145: 784-788. DOI:10.1016/ j.foodchem.2013.08.135.
[14] 宋曉暉, 謝凱, 李艷麗, 等. HPLC-ELSD法測定梨果實中不同種類可溶性糖含量[J]. 南京農業大學學報, 2012, 35(2): 87-91.
[15] KOLA O, SIMSEK M, DURAN H, et al. HPLC determination of carotenoid, organic acid, and sugar content in pepino (Solanum muricatum) fruit during the ripening period[J]. Chemistry of Natural Compounds, 2015, 51(1): 132-136. DOI:10.1007/s10600-015-1219-6.
[16] 趙仁邦. 高效液相色譜法測定棗中糖類物質[D]. 保定: 河北農業大學, 2003: 23-25.
[17] 吉爽爽. 棗中功能性糖的研究[D]. 保定: 河北農業大學, 2012: 25-30.
[18] 張友杰. 以蒽酮分光光度法測定果蔬中的葡萄糖、果糖、蔗糖和淀粉[J]. 分析化學, 1977, 5(3): 167-171.
[19] 趙志華, 李建明, 張大龍, 等. 水鉀耦合對大棚厚皮甜瓜產量和可溶性固形物含量的影響[J]. 西北農林科技大學學報(自然科學版), 2013, 41(8): 161-167. DOI:10.13207/j.cnki.jnwafu.2013.08.026. [20] 彭艷芳, 李潔, 趙仁邦, 等. 金絲小棗和冬棗果實發育過程中低聚糖和多糖含量的動態研究[J]. 果樹學報, 2008, 25(6): 846-850. DOI:10.13925/j.cnki.gsxb.2008.06.016.
[21] 趙愛玲, 薛曉芳, 王永康, 等. 棗果實糖酸組分特點及不同發育階段含量的變化[J]. 園藝學報, 2016, 43(6): 1175-1185. DOI:10.16420/ j.issn.0513-353x.2015-0856.
[22] 趙仁邦, 劉孟軍, 葛微, 等. 高效液相色譜法測定棗中的糖類物質[J].食品科學, 2004, 25(8): 138-142.
[23] 魏天軍, 竇云萍, 張勤. 中寧圓棗果實發育成熟期生理生化變化[J].中國農學通報, 2007, 23(3): 324-327.
[24] 王宏軍, 鄧旭明, 蔣紅, 等. 蒽酮-硫酸比色法檢測多糖條件的優化[J]. 中國飼料, 2011(4): 39-41. DOI:10.15906/j.cnki.cn11-2975/ s.2011.04.011.
[25] 崔宏春. 綠茶水溶性多糖含量測定方法研究[D]. 北京: 中國農業科學院, 2009: 33-34.
[26] 位杰, 吳翠云, 蔣媛, 等. 蒽酮法測定紅棗可溶性糖含量條件的優化[J].食品科學, 2014, 35(24): 136-140.
[27] 劉燕, 伊偉貞, 焦連魁, 等. 高效液相色譜法測定地黃蔗糖合成酶、蔗糖磷酸合成酶活性[J]. 中國農學通報, 2011, 27(15): 245-248.
[28] 魏鑫, 魏永祥, 劉成, 等. 高效液相色譜法測定4 個藍莓品種果實中糖酸組分及含量[J]. 中國果樹, 2013(3): 64-67. DOI:10.16626/j.cnki. issn1000-8047.2013.03.029.
[29] 付盡國, 袁龍, 樓宏銘, 等. HPLC-ELSD法測定低聚木糖中的木糖和木二糖[J]. 廣東化工, 2015, 42(11): 220-221; 219.
[30] SHANMUGAVELAN P, KIM S Y, KIM J B, et al. Evaluation of sugar content and composition in commonly consumed Korean vegetables, fruits, cereals, seed plants, and leaves by HPLCELSD[J]. Carbohydrate Research, 2013, 380: 112-117. DOI:10.1016/ j.carres.2013.06.024.
Simultaneous Determination of Water-Soluble Sugars in Fresh Jujube by High Performance Liquid Chromatography with Evaporative Light-Scattering Detector (HPLC-ELSD)
PU Xiaoqiu1, BAI Hongjin2, MA Qianqian2, WU Cuiyun1,*
(1. Engineering Laboratory of Characteristic Fruit Tree Production in Southern Xinjiang of Xinjiang Production and Construction Corps, College of Plant Science, Tarim University, Alar 843300, China; 2. Xinjiang Production and Construction Corps Key Laboratory of Protection and Utilization of Biological Resources in Tarim Basin, Tarim University, Alar 843300, China)
A method for the simultaneous determination of water-soluble sugars in fresh jujubes by high performance liquid chromatography with evaporative light-scattering detector (HPLC-ELSD) was established. The carbohydrates were separated on a chromatographic column of Waters XBridgeTMAmide (4.6 mm × 250 mm, 5 μm) with a mobile phase consisting of A (0.2% triethylamine aqueous solution) and B (0.2% triethylamine in acetonitrile) (A:B = 24:76, V/V). The column temperature was 30 ℃ and the atomization temperature was 60 ℃. The drift tube temperature of ELSD was 60 ℃. Nitrogen was used as the carried gas with a flow rate of 1.6 L/min and a gain value of 1.0. These experimental conditions allowed good separation of water-soluble sugars, such as rhamnose, arabinose, glucose, mannose, glucose, sucrose, maltose and lactose with a resolution of 1.5 or above. Good linearity was observed for the analytes in the concentration range of 0.099–1.040 ng/μL. The recoveries of spiked real samples ranged from 93.1% to 111.2%, with relative standard deviation (RSD) values below 5%. The limits of detection (RSN= 3) were in the range of 0.008–0.03 ng/μL. This method had a lot of advantages including simple operation, effective separation and time saving, and could be used to determine water-soluble sugars in fresh jujube. Compared with the traditional spectrophotometric method, HPLC-ELSD was more sensitive and accurate making it more suitable for quality identification of fresh jujube.
jujube fruit; high performance liquid chromatography with evaporative light-scattering detector (HPLC-ELSD); water-soluble sugar; monosaccharide; oligosaccharide
10.7506/spkx1002-6630-201714026
中圖分類號:S665.1 文獻標志碼:A 文章編號:1002-6630(2017)14-0170-05
蒲小秋, 白紅進, 馬倩倩, 等. HPLC-ELSD法同時測定鮮棗果實中不同種類可溶性糖含量[J]. 食品科學, 2017, 38(14): 170-174.
10.7506/spkx1002-6630-201714026. http://www.spkx.net.cn
PU Xiaoqiu, BAI Hongjin, MA Qianqian, et al. Simultaneous determination of water-soluble sugars in fresh jujube by high performance liquid chromatography with evaporative light-scattering detector (HPLC-ELSD)[J]. Food Science, 2017, 38(14): 170-174. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201714026. http://www.spkx.net.cn
2016-09-25
浙江大學馥莉食品研究院基金項目(KY201004);兵團科技創新團隊建設項目(2014CC006);
新疆研究生科研創新項目(XJGRI2016128)
蒲小秋(1989—),女,碩士研究生,研究方向為果樹遺傳育種。E-mail:504797210@qq.com
*通信作者:吳翠云(1968—),女,教授,博士,研究方向為果樹種質資源與品種選育。E-mail:wcyby@163.com

