微生物甾醇酯酶的研究進展
任楠楠,王曉輝,遲乃玉,喬慧,張慶芳*
(1.大連大學生命科學與技術學院,遼寧大連116622;2.遼寧省海洋微生物工程技術研究中心,遼寧大連116622)
微生物甾醇酯酶的研究進展
任楠楠1,2,王曉輝1,2,遲乃玉1,2,喬慧1,2,張慶芳1,2*
(1.大連大學生命科學與技術學院,遼寧大連116622;2.遼寧省海洋微生物工程技術研究中心,遼寧大連116622)
甾醇酯酶(EC 3.1.1.13)作為一種高活性的生物催化劑,在醫療檢測、食品、造紙工業及環保等領域具有極其廣泛的應用價值。該文綜述了甾醇酯酶的微生物來源、分離純化、克隆表達、三維結構與應用方面的研究進展,以期為甾醇酯酶的研究開發及產業化應用奠定基礎。
甾醇酯酶;微生物;克隆表達;分離純化;應用
甾醇酯酶(EC 3.1.1.13)又稱為膽固醇酯酶,廣泛存在于生物體內(包括人在內的高等動物與微生物)[1]。甾醇酯酶可在水相條件下催化甾醇酯水解生成甾醇和脂肪酸,在有機溶劑中通過酯化或酯交換進行催化酯合成反應[2]。甾醇酯酶作為一種重要的酶制劑,可幫助機體消化吸收油脂類營養物質,因其與人體脂質代謝及膽固醇吸收有關,甾醇酯酶是檢測血液中總膽固醇含量的重要酶制劑之一[3]。還有解決機械制漿造紙工藝中樹脂障礙問題的潛力[4],由于其廣泛的底物特異性和穩定性,在食品、醫藥、紙漿工業及化工行業等領域發揮重要作用[5]。自然界中,微生物生產的甾醇酯酶具有生產成本低、工藝簡單、不易污染、不受季節影響及易形成規模化生產等優點,已成為目前研究熱點[6]。本文概述了甾醇酯酶的微生物來源,介紹了酶制劑的分離純化、基因的克隆表達和蛋白的三維結構方面的研究進展,并對其應用前景進行了展望,旨在全面深入地了解甾醇酯酶,為其理論研究與產業化應用提供參考。
1 甾醇酯酶的微生物來源
對微生物甾醇酯酶的首次報道來自UWAJIMA T等[7]的研究,之后陸續有科研人員在微生物中檢測到甾醇酯酶活性。據報道[6],多種微生物都能分泌甾醇酯酶:在細菌中約幾十種菌能產生甾醇酯酶,有假單胞菌屬(Pseudomonas sp.)、不動桿菌屬(Acinetobactersp.)、金黃桿菌屬(Chryseobacteriumsp.)、蠟樣芽孢桿菌屬(Bacillussp.)、紅球菌屬(Rhodococcussp.)和伯克霍爾德氏菌屬(Burkholderia sp.)等;放線菌的鏈霉菌屬(Streptomycessp.)的菌株也能分泌甾醇酯酶;沙眼衣原體(Chlamydia trachomatis)CT149分泌的甾醇酯酶專一水解膽固醇亞油酸酯并在Hela細胞中成功表達[8];真菌中的鐮刀菌屬(Fusariumsp.)、木霉屬(Trichodermasp.)和線嘴殼菌屬(Ophiostomasp.)等的菌株均可產甾醇酯酶。不同的微生物甾醇酯酶都易形成多聚體,但其結構特點及底物特異性等差異較大。目前,對產甾醇酯酶菌株的篩選主要采用以甾醇酯為唯一碳源的方法,同時以產物中的酸為依據添加指示劑進行篩選。研究表明,微生物源的甾醇酯酶底物范圍廣,穩定性較好,且能通過誘導提高酶產量,純化工藝也相對簡單[9],所以目前主要針對各種微生物來源的甾醇酯酶進行研究和利用[10]。
1.1 細菌來源的甾醇酯酶
UWAJIMA T等[7]于1975年首次報道的具有水解甾醇酯活性的酶,由熒光假單胞菌(P.fluorescens)KY395分泌,分子質量為129 ku,該酶也具有脂肪酶活性,但對長鏈甾醇酯有顯著的偏好性;最適溫度55℃,在pH 5~12范圍內均有活性。1976年,在相同菌種的菌株ATCC 21156中分離純化出兩種甾醇酯酶,這兩種酶不具有脂肪酶活性,對甾醇酯具有絕對特異性,最適底物為膽固醇亞油酸酯。來自該菌株的酶產品由于其高產量,已獲得專利保護并實現商品化。1994年,NISHIMURA M等[11]在門多薩假單胞菌(P.mendocina)3121分泌的脂肪酶中檢測到了甾醇酯酶活性,酶分子質量為30 ku;2002年,SUGIHARA A等[12]描述了來自銅綠假單胞菌(P.aeruginosa)菌株的甾醇酯酶,等電點(isoelectric point,pI)為3.2,分子質量約為53 ku,其熱穩定性和pH穩定性范圍與來自熒光假單胞菌(P.fluorescens)的甾醇酯酶相同。
從系統發育上看,伯克霍爾德氏菌(Burkholderiasp.)與假單胞菌(Pseudomonassp.)進化關系最近,但是直到2006年,TAKEDA Y等[13]才首次從洋蔥伯克霍爾德氏菌(B.cepacia)ST200中篩選出真正意義上的甾醇酯酶,該酶不具有脂肪酶活性,僅具有芳香酯酶活性。其分子質量約為37 ku,有較好的溫度耐受性(4~65℃)和pH穩定性(5.5~12.0)。
國內對產甾醇酯酶微生物的研究始于20世紀80年代。楊光禮等[14]從實驗室保藏的菌株中篩選出一株產甾醇酯酶能力較強的菌株,經鑒定為假單胞菌屬(Pseudomonassp.),命名為SIPI-215,并對菌株發酵條件和酶學性質進行了研究;黃武華等[15]從土壤中分離出一株產甾醇酯酶能力較強的假單胞菌(Pseudomonassp.),得到菌株最適產酶條件;譚曉晶[16]首次從馬紅球菌(Rhodococcussp.)中分離得到甾醇酯酶,對粗酶液進行了一系列純化,純化后的酶分子質量58.0 ku,樣品純度達到94%,酶活10.56 U/mg,分別以膽固醇亞油酸酯和膽固醇油酸酯為底物時,酶的米氏常數(Km)值分別為2.2×105mol/L和3.1×105mol/L。曾誠等[17]以植物甾醇酯為底物,首次采用熒光透明圈法從金黃桿菌屬(Chryseobacteriumsp.)中篩選出產甾醇酯酶菌株,通過分離純化最終得到分子質量大小為39.0 ku的蛋白。該酶比酶活為2.443IU/mg,最適pH值為7.5,最適作用溫度40℃,在45℃以下,pH 5.0~9.0的范圍內穩定性較好。
1.2 放線菌來源的甾醇酯酶
KAMEIT等[18]報道了來自淡紫灰鏈霉菌(Streptomyces lavendulae)H-646-SY的甾醇酯酶,首次設計纖維素親和層析的純化方法,分離出具有甾醇酯酶活性的蛋白,分子質量為12.0 ku,這與NISHIMURA M等[11]由其核苷酸序列推導的結果類似。之后又從鏈霉菌屬的不同菌株中分離出三種新的甾醇酯酶,這三種酶的底物特異性范圍廣,水解不同長度的甾醇酯,優選膽固醇亞油酸酯、對硝基苯基酯和甘油三酯。
1.3 真菌來源的甾醇酯酶
真菌來源的甾醇酯酶研究起步較晚。目前,研究較熱門的是從線嘴殼菌(O.piceae)的甾醇酯酶。CALERO-RUEDAO等[19]首次在從線嘴殼菌(O.piceae)CECT 20416菌株中通過疏水層析的單一步驟純化得到分子質量為56.5ku的甾醇酯酶,該酶底物特異性范圍廣,除了水解甾醇酯外,還能水解不同長度的脂肪酸酯,在酸性條件下24 h仍能保持50%的活性,但當pH>8或溫度>60℃時穩定性較差。該酶催化效率遠高于目前商業用的真菌甾醇酯酶(來自皺褶假絲酵母(C.rugosa)家族),其商業化應用目前正在開發中。CEDILLO V B等[20]將其在畢赤酵母(P.pastoris)中重組表達,因在重組蛋白的N-末端摻入了額外的6~8個氨基酸,蛋白的聚集性降低,酶活顯著提高。VAQUERO M E等[21]將從線嘴殼菌(O.piceae)甾醇酯酶在釀酒酵母(S.cerevisiae)中重組表達,其催化效率介于畢赤酵母(P.pastoris)中表達的重組蛋白和天然蛋白之間。目前已經評估了該酶的粗制備物在行業應用中的效率,在畢赤酵母中產生的重組O.piceae甾醇酯酶在實驗室條件下結果最好[22],有望用于生產應用。圖1顯示了對不同來源的甾醇酯酶的系統發育分析。
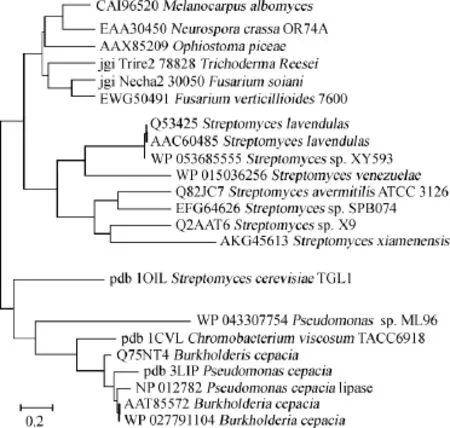
圖1 不同微生物來源的甾醇酯酶的系統發育分析Fig.1 Phylogenetic analysis of sterol esterase from different microorganism's origin
2 甾醇酯酶的分離純化及結構
2.1 甾醇酯酶的分離純化
酶的分離純化是研究酶的分子結構、生理功能以及應用的基礎。至今國內使用的甾醇酯酶主要依賴進口,價格昂貴。究其原因,除了酶源問題外,酶的分離純化也未從根本上得到解決。甾醇酯酶是一種疏水性較強的蛋白,容易形成聚集體,不利于酶純化。添加表面活性劑能減輕蛋白之間的聚集作用,有助于甾醇酯酶的純化,一般多采用膽汁酸鹽或TritonX-100作為活化劑。根據文獻報導[23],在以往的純化研究中,超濾、透析、萃取、離子交換層析、凝膠層析、疏水層析、親和層析等常規技術相繼得到應用。其中,疏水層析技術顯示出了極大的優越性,尤其是對于工程菌產甾醇酯酶的純化。VAQUERO M E等[24]對在畢赤酵母(P.pastoris)中重組表達的甾醇酯酶采取單一的疏水層析(Octyl-Sepharose柱)進行純化并取得理想的結果。不同來源的甾醇酯酶純化步驟及相關數據見表1,目前這方面研究仍是一大熱點。

表1 幾種甾醇酯酶純化步驟Table 1 Purification steps of several kinds of sterol esterase
2.2 甾醇酯酶的結構
與大部分酯水解酶一樣,甾醇酯酶在結構上屬于α/β水解酶家族,具有構成酶活性中心的催化三聯體結構(絲氨酸Ser、組氨酸His和天冬氨酸Asp/谷氨酸Glu)[25]。在一級結構上,甾醇酯酶除了三聯體氨基酸序列和“GXSXG”的五肽保守序列外,不同微生物的甾醇酯酶氨基酸序列同源性較低[26];在二級結構上,α/β水解酶折疊結構為酶的活性位點提供了一個穩定的支架,不同甾醇酯酶的二級結構的差異體現在α-螺旋和β-折疊數量、β-折疊扭曲的角度、α-螺旋的空間分布位置等;在三級結構上,脂肪酶分子在酶催化活性中心的上方,有一個α-螺旋形成的蓋子(lid)結構,而酯酶分子的α-螺旋遠離活性中心的上方。這一結構差異正好與“脂肪酶具有界面激活而酯酶卻不具界面激活”的催化性質相吻合。JAEGER K E等[27]詳細闡述了酶催化酯鍵斷裂的過程,將其分為4個階段:結合底物,形成瞬間的中間態,形成共價中間體以及酰基釋放。因此,催化膽固醇酯水解的機制類似于胰凝乳蛋白酶那樣的絲氨酸蛋白酶,這是典型的酯酶的特點。
XIANG H等[28]研究發現,來自鏈霉菌的甾醇酯酶缺失了“GXSXG”的保守五肽序列,催化活性中心的三聯體結構中缺乏保守的組氨酸(His),但是存在兩個保守的半胱氨酸(Cys)殘基,可形成二硫橋以穩定三級結構。同時它也不受絲氨酸蛋白酶抑制劑苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)的影響。由此推斷,放線菌的甾醇酯酶與已知的酯酶相關性很小,可能存在不同的催化水解機制。
3 甾醇酯酶的克隆表達
隨著分子生物學的發展,不同來源的微生物甾醇酯酶相繼被克隆,并在大腸桿菌(E.coli)、畢赤酵母(P.pastoris)、克魯維酵母(Kluyveromyces lactis)、曲霉(Aspergillussp.)等宿主中表達[21]。
XIANG H等[28]利用反轉錄聚合酶鏈反應(reverse tran scriptase-polymerase chain reaction,RT-PCR)技術克隆了來自鏈霉菌(Streptomycessp.)X9的完整的甾醇酯酶基因片段,共1 336 bp,其中開放閱讀框(open reading frame,ORF)包括654 bp,編碼217個氨基酸殘基,分子質量為18.8 ku。在起始密碼子上游5 bp處有Shine-Dalgarno序列(AAGGAGG),前38個氨基酸為信號肽部分,與來自阿維鏈霉菌(S.avermitilis)JCM5070的甾醇酯酶基因有64%的同源性。CALERO-RUEDA O等[19]將從線嘴殼菌O.piceaeCECT 20416的甾醇酯酶基因克隆并在畢赤酵母(P.pastoris)GS115中進行異源表達,分別以pGEM-T Easy和pPIC9質粒(Invitrogen TM AOX 1啟動子)作為克隆載體和表達載體,獲得具有較高甾醇酯酶活性的重組蛋白。該酯酶基因的DNA序列和推導的氨基酸序列在GenBank/EBI數據庫中的編號為AY899847。該基因的ORF為1647bp,不含內含子序列,編碼549個氨基酸,分子質量為58.2 ku,前12個氨基酸為信號肽部分,其N末端的氨基酸序列與之前從野生菌株中純化獲得的蛋白質的氨基酸序列一致。
KONTKANEN H等[29]將嗜熱真菌Melanocarpus albomycesVTTD-96490的甾醇酯酶STE1轉入pHAK4/77,在里氏木霉(T.reesei)中進行表達(纖維二糖水解酶啟動子),通過凝膠過濾層析,測得其分子質量為120 ku,以二聚體形式存在,而野生菌株中的甾醇酯酶以四聚體形式存在,雖然兩者都有5%的N連接的糖基化,但是兩者的糖基化模式可能有輕微不同。氨基酸序列顯示其重組SET1疏水性氨基酸殘基達41.1%。推測重組STE1內部隱藏的C端His標簽能降低疏水性,導致二聚體結構的形成。
4 微生物甾醇酯酶的應用
4.1 臨床上測定膽固醇含量
心腦血管疾病是危害人類健康的一種常見疾病[30],而膽固醇含量是診斷和預防心腦血管疾病的重要指標。目前,臨床上已經形成了多種血液膽固醇的檢測方法(化學法、酶法、同位素稀釋法、質譜分析法等)[31],其中,膽固醇的酶法檢測是一種重要的方法。
自ALLAIN C C等[32]于1974年首次提出膽固醇的的酶法檢測后,膽固醇酯酶的實際應用正式被開創。檢測原理是:膽固醇酯依次在膽固醇酯酶(cholesterol esterase,COE)和膽固醇氧化酶(cholesteroloxidase,COD)的作用下生成脂肪酸,△4-膽甾烯(cholest-4-en-3-one)和H2O2。常規酶法檢測是通過用Tninder顯色系統檢測終點產物H2O2含量(波長500 nm處用比色法檢測所得的吸光度值與樣品中的總膽固醇濃度對應的線性關系,可以通過預先制作的標準曲線求出對應的總膽固醇濃度)來計算膽固醇酯含量。具體反應如下:
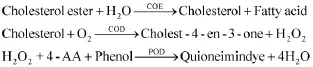
隨著科學的發展,對常規酶法檢測不斷改進,出現了許多新方法(如膽固醇脫氫酶法、熒光法、電極法、熱敏電阻法等)[33]。雖然方法不斷改進,但基本原理不變,反應第一步都需要膽固醇酯酶的參與,這使膽固醇酯酶在測定膽固醇含量上起著不可替代的作用。因此研發高質量的膽固醇酯酶制劑具有重要意義。
4.2 酶法合成植物甾醇酯
植物甾醇是一類普遍存在于植物體中的微量活性成分,具有降低血液中膽固醇、防治心血管疾病、抗氧化等功效,被譽為“生命的鑰匙”[34-35]。2010年,我國衛生部批準植物甾醇和甾烷醇作為新資源食品[36],植物甾醇成為功能性食品研發的熱點。但是,植物甾醇在油相中溶解度低,在食品體系中添加時經常會出現結晶現象,穩定性也不及甾醇酯,因此考慮用將植物甾醇改性轉變成甾醇酯的方式添加到食品中,制成功能性食品。其主要合成方法有化學法和酶法,酶法具有合成條件溫和、副產物少、安全性高等優點,因此具有很好的應用前景。羅日明[37]通過酶法催化合成的甾醇酯(肉豆蔻酸植物甾醇酯和月桂酸植物甾醇酯)在油脂中的溶解度比植物甾醇提高了3~7倍。且有研究顯示各類甾醇酯均具有良好的降膽固醇功能[36]。
4.3 制漿造紙工業,解決樹脂障礙
造紙工業術語“樹脂障礙”中的樹脂主要指木材原料中各種天然的疏水性有機物質,包括甘油三酯、甾醇酯、樹脂酸等[38]。在造紙生產過程中,這些化合物可以單獨或者與不溶性填料、無機鹽和涂布劑等作用產生沉積,嚴重影響造紙產品的質量及產量,被統稱為“樹脂障礙”。早在20世紀90年代初,日本Juji公司率先提出用酶法水解甘油三酯減少樹脂障礙。目前已將一些商業化的酶制劑(如resinase)用于解決這一問題,但是這些酶制劑缺乏甾醇酯酶活性,不能水解木材甾醇酯。因此,提出將甾醇酯酶與脂肪酶結合使用的設想,共同解決樹脂障礙問題,以期生產出穩定性和韌性更好的紙張。CALERO-RUEDA O等[19]最先使用由從線嘴殼菌(O.piceae)分泌的甾醇酯酶降解木漿中的甾醇酯,并取得理想效果。葉聿程等[39]以天然樹脂為唯一碳源篩選出一株降解樹脂能力較強的粉塵腸桿菌(Enterobacter pulveris)Z57,降解率為6%。ZENG C[40]以植物甾醇酯為唯一碳源,從土壤中篩選出一株高產甾醇酯酶的金黃桿菌(Chryseobacteriumsp.)jx-39,其甾醇酯酶對不同碳鏈長度的脂肪酸膽固醇酯和對硝基苯酚酯具有廣泛的底物特異性,顯示該酶具有解決樹脂障礙的潛力。
除此之外,甾醇酯酶也可作為清潔催化劑應用于化工、紡織等行業,具有很大的應用潛力,因此挖掘穩定的、催化效率高的甾醇酯酶在實際的工業化生產中尤其重要。
5展望
目前研究報道的甾醇酯酶活力較低,底物專一性范圍較寬,它們中的大多數也可以同時水解不同長度的脂肪酸鏈,這并不利于專一性地水解甾醇酯,因此限制了該酶的廣泛應用。科研工作者不斷努力篩選底物特異性強的高產甾醇酯酶菌株、優化提高甾醇酯酶的生產水平且降低生產成本。除此之外,隨著分子生物學、基因組學、蛋白質組學等學科的發展,提高甾醇酯酶的異源表達水平,改善甾醇酯酶的酶學性質,研究甾醇酯酶與底物的作用機理將是今后的科研熱點和趨勢。這將為甾醇酯酶在不同領域的開發應用奠定基礎。
[1]熊纓,李伯良.人細胞內膽固醇酯化酶ACAT[J].生命的化學,2014,34(3):337-345.
[2]徐毅,陳晨,吳小梅.立體選擇性羧酸酯酶產生菌的篩選及發酵優化[J].上海應用技術學院學報:自然科學版,2016,16(2):112-116.
[3]黃泓軻,羅健瑋.膽固醇測定生物傳感器研究進展[J].科技資訊,2015,13(3):234-234.
[4]李云澤.生物酶控制樹脂技術在木片磨木漿車間的應用[J].華東紙業,2014,45(3):11-14.
[5]HASAN F,SHAH A A,HAMEED A.Industrial applications of microbial lipases[J].Enzyme Microb Tech,2006,39(2):235-251.
[6]VAQUERO M E,BARRIUSO J,MARTíNEZ M J,et al.Properties, structure,and applications of microbial sterol esterases[J].Appl Microbiol Biotechnol,2016,100(5):2047-2061.
[7]UWAJIMA T,TERADA O.Studies on sterol metabolism by microorganisms.III.Purification and properties of extracellular cholesterol ester hydrolase ofPseudomonas fluorescens[J].Agr Biol Chem,1975,39(7): 1511-1512.
[8]PETERS J,ONGURI V,NISHIMOTO S K,et al.TheChlamydia trachomatisCT149 protein exhibits esterase activityin vitroand catalyzes cholesteryl ester hydrolysis when expressed in HeLa cells[J].Microbes Infect,2012,14(13):1196-1204.
[9]S?E J B,J?RGENSEN T L.Method for producing phytosterol/phy-tostanol phospholipid esters:EP20100713521[P].2012-02-01.
[10]BROWN A W,HANG J L,DUSSAULT P H,et al.Plant sterol and stanol substrate specificity of pancreatic cholesterol esterase[J].J Nutr Biochem,2010,21(8):736-740.
[11]NISHIMURA M,SUGIYAMA M.Cloning and sequence analysis of a Streptomyces cholesterolesterase gene[J].Appl Microbiol Biotechnol, 1994,41(4):419-424.
[12]SUGIHARA A,SHIMADA Y,NOMURA A,et al.Purification and characterization of a novel cholesterol esterase fromPseudomonas aeruginosa,with its application to cleaning lipid-stained contact lenses [J].Biosci Biotechnol Biochem,2014,66(11):2347-2355.
[13]TAKEDA Y,AONO R,DOUKYU N.Purification,characterization,and molecular cloning of organic-solvent-tolerant cholesterol esterase from cyclohexane-tolerantBurkholderia cepaciastrain ST-200[J].Extremophiles,2006,10(4):269-277.
[14]楊光禮,陳壁佩,張一閔,等.假單胞菌膽固醇酯酶的生產Ⅰ.菌種篩選和發酵條件的研究[J].中國醫藥工業雜志,1987,18(3):17-20.
[15]黃武華,方定一.假單胞菌1299產膽固醇酯酶的研究I.適宜的產酶條件[J].微生物學通報,1990,1(5):274-277.
[16]譚曉晶.Rhodococcussp.膽固醇酯酶分離純化與基本性質研究[D].成都:四川大學,2006.
[17]曾誠,范遠鑫,丁少軍.甾醇酯酶菌株Chryseobacteriumsp.的篩選及酶學性質研究[J].林產化學與工業,2013,33(3):43-49.
[18]KAMEI T,SUZUKI H,MATSUZAKI M,et al.Cholesterol esterase produced byStreptomyces lavendulae[J].Chem Pharm Bull,1978,25 (12):3190-3197.
[19]CALERO-RUEDA O,PLOU F J,BALLESTEROS A,et al.Production, isolationandcharacterizationofasterolesterasefromOphiostomapiceae [J].Biochim Et Bioph Acta,2002,1599(1-2):28-35.
[20]CEDILLOVB,PLOUFJ,MARTíNEZMJ.Recombinant sterol esterase fromOphiostoma piceae:an improved biocatalyst expressed inPichia pastoris[J].Microb Cell Factories,2012,11(1):73-86.
[21]VAQUERO M E,BARRIUSO J,MEDRANO F J,et al.Heterologous expression of a fungal sterol esterase/lipase in different hosts:Effect on solubility,glycosylation and production[J].J Biosci Bioeng,2015,120 (6):637-643.
[22]SALAS F D,BARRIUSO J.Quorum-sensing mechanisms mediated by farnesol inOphiostoma piceae:effect on secretion of sterol esterase[J]. Appl Environ Microbiol,2015,81(13):4351-4357.
[23]劉祥義,賈宇,王雪.疏水層析技術及應用[J].煤炭與化工,2012,35(9):68-69.
[24]VAQUERO M E,PRIETO A,BARRIUSO J,et al.Expression and properties of three novel fungal lipases/sterol esterases predicted in silico:comparison with other enzymes of theCandida rugosa-like family [J].Appl Microbiol Biotechnol,2015,99(23):10057-10067.
[25]何勇錦,周有彩,季瀟煒,等.脂肪酶A的研究進展[J].食品與發酵工業,2016,42(11):255-261.
[26]VíCTOR B C,ALICI A P,JES U′S M M.Potential ofOphiostoma piceaesterolesterase for biotechnologically relevant hydrolysis reactions[J].Bioengineered,2013,4(4):249-253.
[27]JAEGER K E,REETZ M T.Microbial lipases form versatile tools for biotechnology[J].Trends Biotechnol,1998,16(9):396-403.
[28]XIANG H Y,MASUO S,HOSHINO T,et al.Novel family of cholesterolesterasesproducedbyactinomycetesbacteria[J].Biochim Et Bioph Acta,2007,1774(1):112-120.
[29]KONTKANEN H,TENKANEN M,REINIKAINEN T.Purification and characterisation of a novel steryl esterase fromMelanocarpus albomyces [J].Enzyme Microb Tech,2006,39(2):265-273.
[30]孟磊,譚艷美,袁中華.中性膽固醇酯水解酶與動脈粥樣硬化[J].中南醫學科學雜志,2015,43(2):217-221.
[31]郭瑋,陳方俊,潘柏申.膽固醇檢測方法的發展歷史及標準化[J].檢驗醫學,2013,28(11):970-974.
[32]ALLAIN C C,POON L S,CHAN C S,et al.Enzymatic determination of total serum cholesterol[J].Clin Chem,1974,20(4):470-475.
[33]武翠玲,譚曉晶,姚明明,等.膽固醇酯酶高產菌株的篩選及動力學性質研究[J].中國釀造,2006,25(12):36-39.
[34]張蕾.植物甾醇及制品降心腦血管疾病風險的功能性評價[D].天津:天津商業大學,2014.
[35]朱婧,史云潔,王顏,等.含植物甾醇酯牛奶對高膽固醇血癥患者血脂水平影響的隨機對照研究[J].衛生研究,2016,49(5):718-724.
[36]程謙偉,孟陸麗,馮禮,等.響應面法優化植物甾醇硬脂酸酯制備工藝[J].食品研究與開發,2016,37(6):128-131.
[37]羅日明.脂肪酶催化合成植物甾醇酯的研究[D].廣州:華南理工大學,2013.
[38]王恒,葉聿程,李祖巍,等.微生物法控制馬尾松樹脂障礙[J].華東紙業,2014,45(1):28-31.
[39]葉聿程,李祖巍,張向明,等.一株降解樹脂細菌的鑒定及發酵條件的優化[J].華東紙業,2013,44(1):36-44.
[40]ZENG C,FAN Y X,DING S J.Screening of sterol esterase-producing strainChryseobacteriumsp.and its emzymatic properties[J].Chem Ind Forest Prod,2013,33(3):43-49.
Research advance in sterol esterase from microorganisms
REN Nannan1,2,WANG Xiaohui1,2,CHI Naiyu1,2,QIAO Hui1,2,ZHANG Qingfang1,2*
(1.College of Life Science and Biotechnology,Dalian University,Dalian 116622,China;
2
.Liaoning Technology of Marine Microbiological Engineering Research Center,Dalian 116622,China)
Sterol esterase(EC 3.1.1.13),as a high activity biocatalyst,has extremely broad application value in medical detection,food,paper industry and environmental protection,etc.The research advance of microorganism's origin,separation and purification,cloning and expression,three-dimensional structure and application of sterol esterase were summarized,which might lay foundation for research,development and industrialization application of sterol esterase.
sterol esterase;microorganism;cloning and expression;separation and purification;application
Q556.1
0254-5071(2017)06-0009-05
10.11882/j.issn.0254-5071.2017.06.002
2017-05-12
國家高技術研究發展計劃‘863計劃’項目(2007AA021306)
任楠楠(1992-),女,碩士研究生,研究方向為微生物與酶工程。
*通訊作者:張慶芳(1965-),女,教授,博士,研究方向為微生物與酶工程。

