心脈隆注射液對酒精性心肌病大鼠心肌纖維化的影響
劉國紅,黃 潔,劉玉雙
心脈隆注射液對酒精性心肌病大鼠心肌纖維化的影響
劉國紅,黃 潔,劉玉雙
目的 探討心脈隆注射液對酒精性心肌病大鼠心肌纖維化的影響。觀察在心脈隆治療的不同階段,結締組織生長因子(CTGF)在心肌的表達情況。方法 雄性健康SD大鼠50只,隨機分為模型組和對照組,模型組酒精濃度從5%、10%、20%、30%各自由飲1周,然后濃度遞增到36%后以該濃度維持飼養,對照組每日飲用與酒精同等熱量的葡萄糖水,6個月后判斷心力衰竭模型是否成功。將模型大鼠隨機分為3組:心脈隆治療1 d組、心脈隆治療5 d組、心脈隆治療10 d組。予以心脈隆注射液5 mg/kg腹腔注射,用免疫組化的方法對結締組織生長因子在3組大鼠的左室心肌的分布及表達進行半定量分析。用Masson染色法觀察3組大鼠左室心肌的膠原沉積情況。結果 隨著治療時間的延長,大鼠的心肌結締組織生長因子表達明顯減少(P<0.05);大鼠心肌的膠原沉積明顯減少。結論 心脈隆注射液可以延緩酒精性心肌病心肌纖維化的過程。
酒精性心肌病;心脈隆注射液;心肌纖維化;結締組織生長因子
酒精性心肌病(alcoholic Cardiomyopathy,ACM)是指長期飲酒導致心肌變性、心臟擴大和心力衰竭的一種繼發性心肌病[1]在西方,ACM是繼發性心肌病的主要類型。我國近年來發展有增加的趨勢。一般來說,每天飲酒80 g以上,連續10年以上,有20%~36%的人可發生酒精性心肌病。酒精性心肌病病理學特征類似于原發性擴張型心肌病,常見的心肌組織改變為心肌細胞肥大,空泡變性和間質水腫。變性心肌細胞內膠原纖維減少,胞漿變稀疏,胞漿內含大小不等的空泡,嚴重者空泡逐漸融合增大,細胞中的有形成分被溶解而留下肌膜空腔,最終形成彌漫性纖維化。
1 材料與方法
1.1 實驗分組 健康雄性SD大鼠50只,隨機分為正常對照組(5只)、模型組(45只)。
1.2 酒精性心肌病動物模型的建立[2]模型組依次給予質量濃度為5%、10%、20%、30%食用酒精自由飲各1周之后,第5周開始36%濃度酒精(滅菌水52 mL∶95%食用酒精48 mL)持續飼喂至6個月末(含酒精的飲水為唯一水源)。對照組每天給予與酒精同等熱量的葡萄糖水飲用,顆粒飼料量依據實驗組每日食用量給予對照組相同劑量。
1.3 模型判定 在模型制作期間,每天觀察大鼠精神狀況,活動情況,飲酒量,進食量,大小便情況,毛色改變情況,每周稱重一次,觀察體重變化。
1.3.1 心臟超聲心動圖檢查 超聲心動圖檢測各組大鼠心臟形態學指標及功能學指標,計量資料連續測量3個心動周期取其平均值,用以分析。形態學指標包括:左心室收縮末期內徑(LVDS)、左心室舒張末期內徑(LVDD)、室間隔厚度(IVS)、左心室后壁收縮期厚度(LVPWTs)左心室后壁舒張期厚度(LVPWTd)。功能學指標包括:左室射血分數(LVEF)、左室短軸縮短率(FS)。將LVEF≤45%確定為心力衰竭模型成功。
1.3.2 HE染色組織學評價慢性心力衰竭模型是否成功 4%多聚甲醛固定48 h后,脫水,透明,浸蠟,包埋,制成4 μm的石蠟切片,行HE染色,光鏡下觀察病理學變化,判定慢性心力衰竭模型是否成功。
1.3.3 免疫組織化學檢測(采用ABC法) 4 μm石蠟切片脫蠟至水,滴加3%過氧化氫,以滅活內源性過氧化物酶。滴加打孔液,以充分暴露抗原。以微波修復抗原。滴加5%BSA封閉液,37 ℃孵育40 min。滴加一抗,4 ℃冰箱過夜。37 ℃復溫40 min,滴加二抗,37 ℃復溫40 min。滴加鏈酶親和素-生物素-過氧化物復合物,37 ℃孵育50 min。DAB顯色,顯微鏡下控制顯色時間,最后以蘇木素復染,鹽酸酒精分化,脫水,透明,封片。實驗同時以PBS替代一抗作陰性對照,用計算機圖像分析系統軟件進行分析,鏡下隨機選取5個視野,計數陽性細胞數,取其平均數,進行半定量分析。
2 結 果
2.1 HE染色光鏡下觀察 正常對照組心肌細胞排列整齊,形態正常,胞漿紋理清晰。模型組心肌細胞排列紊亂,可見心肌纖維排列紊亂,炎細胞增多,有明顯出血壞死,心肌纖維排列呈波浪狀,甚至斷裂,炎性細胞明顯增多,出血壞死明顯。
2.2 心肌組織超微結構改變 透射電鏡下觀察可見,對照組大鼠心肌纖維走行規則,Z線清晰可見,線粒體結構清晰,血管內皮細胞結構正常。模型組大鼠心肌細胞核膜明顯不規則,核仁裂解;染色質邊集;線粒體數量增多、大小不等、腫脹、有空泡變性、可見巨線粒體、線粒體嵴融合消失,并向細胞核附近聚集;M線消失;肌原纖維溶解、斷裂;間質膠原纖維增生明顯。
2.3 多普勒超聲評估(見表1) 與對照組相比,心衰組LVDD、LVDS顯著增加, FS、LVEF顯著減小,差異有統計學意義(P<0.05)。
表1 兩組左室結構和功能的多普勒超聲檢查結果(±s)
2.4 組織學檢查 對照組心肌細胞排列齊,形態正常,胞漿紋理清晰。隨著治療時間的延長,心肌纖維排列較前整齊,出血壞死較前減少。詳見圖1~圖4。
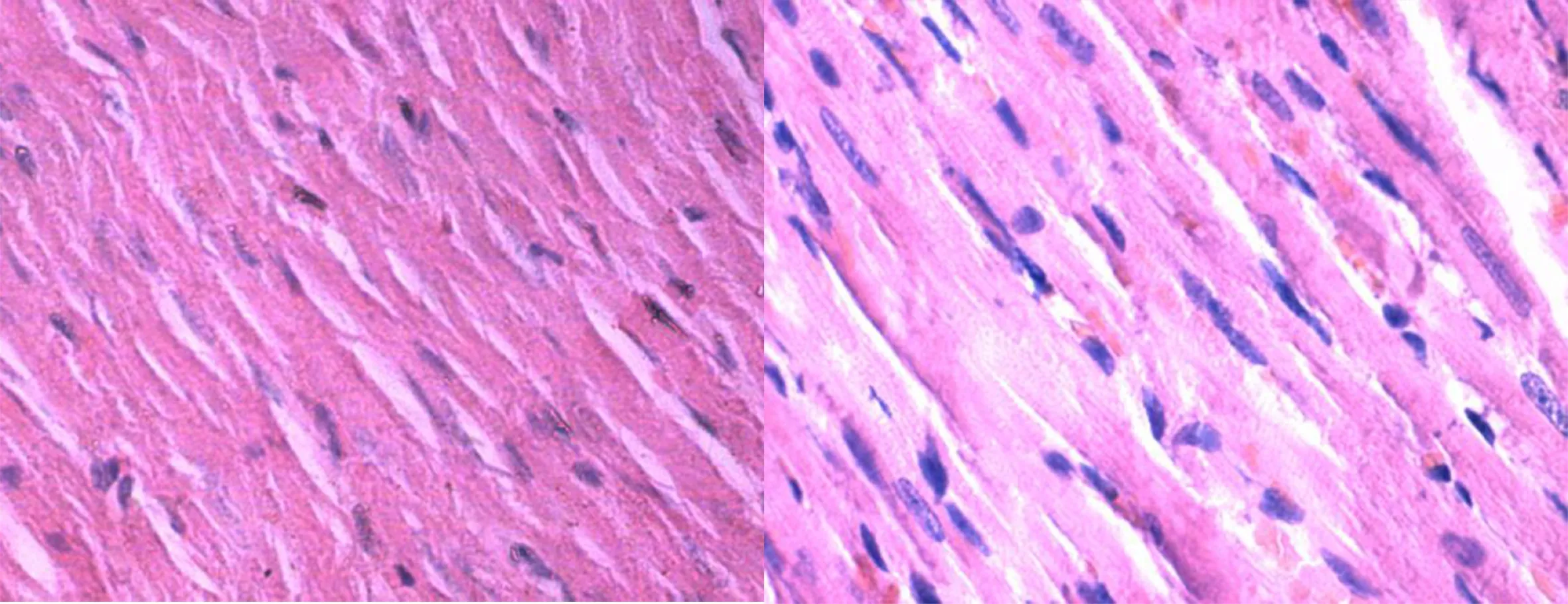
圖1 正常心肌HE染色(×400) 圖2 治療10 d HE染色(×400)
圖3 治療5 d HE染色(×400) 圖4 治療1 d HE染色(×400)
2.5 MASSON染色結果 對照組心肌無明顯膠原沉積。隨著治療時間的延長,心肌膠原沉積逐漸減少。詳見圖5~圖8。
圖5 正常心肌 Masson染色(×200) 圖6 治療 10 d Masson染色(×200)
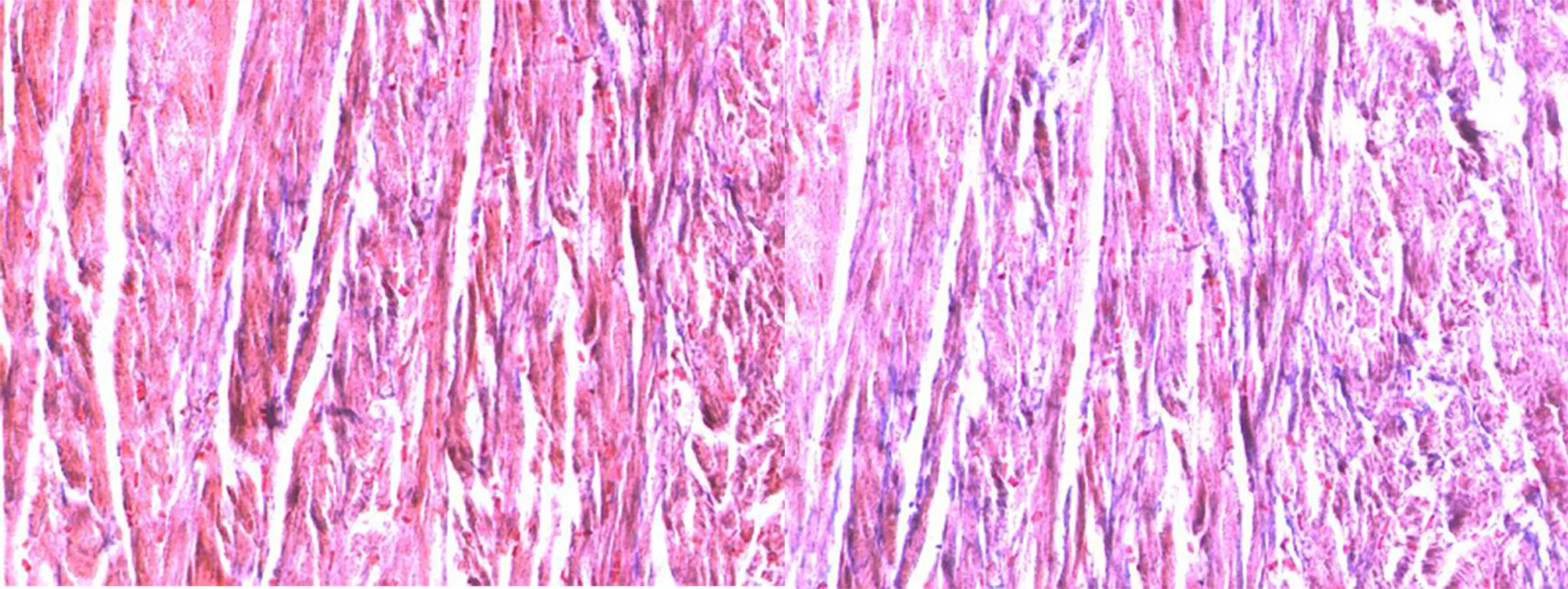
圖7 治療5 d Masson染色(×200) 圖8 治療1 d Masson染色(×200)
2.6 免疫組化指標測定 結締組織生長因子(CTGF)在假手術組幾乎不表達,在心衰組,隨著治療時間的延長,CTGF表達逐漸減少。詳見表2。
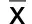
表2 CTGF的半定量分析(±s) 個/HP
3 討 論
CTGF是新近發現的細胞因子[3],它能夠促進細胞外基質及細胞外基質成分的產生。可作為促纖維化的共同下游介導因子,在器官纖維化的發生中起著重要的作用。并通過蛋白激酶C(Protein kinase C)途徑誘導心肌纖維化,心力衰竭時,CTGF表達增加,CTGF扮演了一個獨立的因素,或和其他細胞因子一起誘導心肌纖維化和功能障礙。轉化生長因子β1(TGF-β1)是啟動纖維化的必須因子,而不依賴于TGF-β1的CTGF持續升高是纖維化進展的特征性表現[4]。血管緊張素Ⅱ(angiotensin Ⅱ)促進膠原合成和降解,并通過血壓和神經依賴性鈣調蛋白的途徑調節心肌纖維化[5]。并且CTGF能夠介導轉化生長因子β1誘導的膠原合成[6]。
本實驗采用飼喂酒精的方法,制備了發病情況與病理表現與人類相似的酒精性心肌病早期心肌損傷的動物模型,主要根據是由于乙醇及其代謝產物乙醛對心肌細胞和生物膜的毒性效應,導致心臟擴大,負荷增加,最終導致全心衰竭,來模擬酒精性心肌病的病理改變。在心力衰竭的發病機制中,心室重構是最重要的病理基礎,而心肌纖維化是心肌損傷及心室重構的終末病理過程[7]。本實驗發現,隨著治療時間的延長,心肌纖維化得到了明顯的改善。CTGF的發現,為控制心肌纖維化提供了一個新的治療靶點。拮抗CTGF可以更專一的拮抗細胞增殖肥大和細胞外基質的進行性積聚[8]。同時,實驗發現,CTGF的表達比對照組明顯升高,說明CTGF可能參與了心肌纖維化的發生。
心脈隆注射液是由美洲大蠊干品經過浸漬、減壓、濃縮、分離后得到的,有效成分為多肽、核苷及復合氨基酸,復合氨基酸起著主要的作用。核苷通過水解途徑起著輔助作用,二者缺一不可,具有利尿、增強心肌收縮力、減輕心臟負荷、改善心功能的作用。研究表明[9],心脈隆注射液能有效降低老年人心衰患者的BNP水平從而改善心功能。
綜上所述,心脈隆注射液能有效地抑制心力衰竭大鼠的心肌纖維化,從而改善心室重構,改善心功能,并且不良反應少,是治療慢性心力衰竭的良好藥物。
[1] 李為民,井玲,劉怡希. 酒精性心肌病[J].中國實用內科雜志,2012,3(7):508-510.
[2] 程燕,孫堯,張浩良,等.慢性大鼠酒精性心肌病氧化應激的影響[J].華西醫學,2010,25(4):664-666.
[3] 閆慧明,丁利芳,劉媛,等.轉化生長因子-β1與結締組織生長因子在類風濕性關節炎合并肺間質病變患者血清中的表達水平及臨床意義[J].中國全科醫學,2012,10(15):3268-3270.
[4] 周飛,李裕舒,楊俊,等.TGFβ1/CTGF動態變化與心房顫動患者進展的相關研究[J].臨床血管病雜志,2011,27(1):49-51.
[5] 張為澤,宋振華,陳永清,等.阿托伐他汀抑制心房肌細胞CTGF及CX43的表達[J].第三軍醫大學學報,2011, 3(7):735-737.
[6] 符麗娟,王洪新,包翠芬,等.貝那普利對糖尿病大鼠心肌細胞外基質重塑中基質金屬蛋白酶及轉化生長因子的表達[J].中國藥理學與毒理學雜志,2011,25(3):229-234.
[7] 孔宏亮,宋麗潔,李占全,等.人參皂甙Rb1對阿霉素心力衰竭大鼠心臟纖維化因子表達的影響[J].南京醫科大學學報,2012,32(1):26-29.
[8] 王瑋,李魯楊,孟曉慧.甘草酸二胺聯合前列地爾對大鼠腎間質纖維化的影響[J].山東大學學報,2012,50(9):29-32.
[9] 楊靜,陳光輝,蔣博,等.心脈隆注射液治療110例老年慢性心力衰竭患者的療效觀察[J].藥物與臨床,2012,9(14):93-94.
(本文編輯郭懷印)
河北唐山豐潤區人民醫院(河北唐山064000),E-mail:luckguohong@163.com.cn
信息:劉國紅,黃潔,劉玉雙.心脈隆注射液對酒精性心肌病大鼠心肌纖維化的影響[J].中西醫結合心腦血管病雜志,2017,15(10):1177-1180.
R542.2 R285.5
A
10.3969/j.issn.1672-1349.2017.10.008
1672-1349(2017)10-1177-04
2016-12-05)

