多種病理亞型腎癌的多排螺旋CT、MRI表現
孫曉忠 ,劉彩云
(1.徐州市第六人民醫院,江蘇 徐州 221000;2.徐州醫科大學附屬第三醫院,江蘇 徐州 221000)
隨著基礎和臨床研究的深入,增加了人們對腎細胞癌(renal cell carcinoma,RCC)的深入了解,2004年WHO對腎癌組織病理學進行了新的分類,即透明細胞癌(clear cell renal cell carcinoma),乳頭狀腎細胞癌(apillary renal cell carcinoma),嫌色細胞癌(chromophobe renal cell carcinoma),多房性囊性腎細胞癌(ultilocular cystic renalcell carcinoma),Bellini集合管癌(carcinoma of the collectingducts of Bellin),腎髓質癌(renal medullary carcinoma),Xp11.2易位性/TFE3基因融合相關性腎癌(renal carcinoma associated withXp11.2 translocations/TFE3 gene fusions),神經母細胞瘤相關性腎細胞癌(renal cell carcinoma associated with neuroblastom),黏液樣小管狀和梭形細胞癌(mucinous tubularandspindle cell carcinoma)。隨著影像學的快速發展,多排螺旋CT(MSCT)和MRI 已經廣泛應用于腎癌評價,通過綜合分析腫瘤的影像學特征,鑒別不同病理亞型的腎細胞癌,為臨床制定合理有效的治療方案提供幫助。
1 資料與方法
搜集本院及協作醫院2009-10—2016-06間臨床資料完整、經手術切除、病理檢查證實為腎細胞癌者81例。年齡4~75歲 ,平均年齡48歲,其中男55例,女26例,所有病例均為單側單發病灶,右腎53例,左腎28例。臨床主要表現為腰痛、無痛性血尿、下腹疼痛、腹部腫塊等。81例患者術前經多層螺旋CT(Siemens Sensation 16層螺旋CT機)掃描,掃描層厚5~8 mm,間隔5~8 mm,螺距1。所有患者均行平掃、皮髓交界期(30 s)和實質期(60 s)、排泄期(210~240 s)掃描。對比劑為碘海醇(Iohexol Injection ),于肘前靜脈注射,劑量1.5~2.0 mL/kg,注射流率3 mL/s。20例行MR(GESigna 1.5T MR機)掃描,掃描層厚為6~8 mm,采用體表線圈,平掃呼吸觸發橫斷面T2FSE脂肪抑制掃描、呼吸門控橫斷面彌散加權成像(diffusion-weighted imaging,DWI)、屏氣橫斷面三維同反相位雙回波、增強采用屏氣LAVA-XV橫斷面三期動態增強,對比劑為馬根維顯(GadopentetateDimeglumine,Magnevist),于肘前靜脈注射,劑量0.1 mmoL/kg在以2.5~3.0mL/s的速度注入對比劑后約10~15 s開始掃描。兩名高年資影像醫師于PACS系統回顧性評價所有腎癌。評價內容包括:瘤體在平掃、增強掃描皮髓質期、實質期及排泄期的CT強化程度根據在腫瘤的感興趣區和鄰近正常腎皮質區測量CT值進行判斷;MRI強化程度,根據腫瘤實體部強化最明顯處與鄰近腎皮質相比,分為明顯強化、中度強化和輕度強化3級,即強化程度強于腎皮質或與腎皮質相仿的為明顯強化、明顯弱于腎皮質的為輕度強化、介于兩者之間者為中度強化,方式(如均勻強化、較均勻強化、不均勻強化),感興趣區(ROI)的放置避開瘤體的明顯壞死、鈣化及出血。
2 結果
2.1 5種腎癌亞型的CT、MRI平掃表現
81例腫瘤病灶大小不一,直徑2.0~11.5 cm,平均約4.1 cm;其中透明細胞癌67例,乳頭狀腎細胞癌6例,嫌色細胞癌4例,多房囊性腎細胞癌3例,Xp11.2易位性/TFE3基因融合相關性腎癌1例。67例腎透明細胞癌表現為圓形、橢圓形,少數為不規則形,直徑<3 cm腫瘤呈均勻稍低或等密度影,直徑>3 cm 腫瘤呈等/稍低密度為主的混雜密度腫塊影,其中60例有不同程度的出血、壞死、囊變,5例有鈣化灶,6例有高密度出血灶;其中17例透明細胞癌行MRI檢查,其信號變化(見表1)。6例乳頭狀腎細胞癌境界清楚,其中5例呈圓形或橢圓形等密度或稍高密度影,1例呈不規則形等密度影,2例密度均勻,4例密度不均勻,瘤內出血2例,囊變2例;其中2例行MRI檢查,T1WI呈低、中等信號影,T2脂肪抑制序列等、低信號影,DWI呈不均勻的高信號影。4例腎嫌色細胞癌平掃表現為位于腎髓質的邊界清楚的類圓形軟組織腫塊影,2例可見鈣化灶,1例見疤痕伴鈣化灶;其中1例行MRI檢查,T1WI呈稍低信號,T2脂肪抑制序列呈稍高信號影,DWI呈高信號影,中心放射狀瘢痕T1WI呈低信號影,T2FS呈明顯高信號影。3例多房囊性腎細胞癌表現為橢圓形囊性腫塊影,2例內見少量的實性部分和厚薄不一的分隔影,1例內見厚薄不均的分隔影。1例Xp11.2易位性/TFE3基因融合相關性腎癌表現為境界清楚的等密度影為主的腫塊影,邊緣區域見多發斑片狀稍低密度影。

表1 17例腎透明細胞癌SE-T1WI、FSE-T2WI及DWI序列信號改變
2.2 5種腎癌亞型的CT、MRI增強程度、方式
透明細胞癌強化幅度明顯高于乳頭狀腎細胞癌、嫌色細胞癌,多房囊性腎細胞癌實性部明顯強化,Xp11.2易位性/TFE3基因融合相關性腎癌呈明顯強化。透明細胞癌呈速升速降型強化,皮髓質期明顯不均勻強化,強化程度等或高于腎皮質,實質期強化程度下降, 排泄期強化程度明顯降低;MRI增強后與CT強化表現一致。乳頭狀腎細胞癌呈延遲持續性強化,皮髓質期呈輕中度較均勻或不均勻強化,強化程度低于腎皮質,實質期及排泄期強化程度增加。腎嫌色細胞癌呈輕到中度均勻或不均勻強化,皮髓質期密度低于腎皮質,3例可見輻射狀強化,其中2例侵犯腎周脂肪和腎靜脈內癌栓形成。MRI增強后與CT強化效應相仿。多房囊性腎細胞癌皮髓質期、實質期、排泄期實性部分強化與腎皮質等同,間隔呈中度漸進性延遲強化。1例Xp11.2易位性/TFE3基因融合相關性腎癌皮髓質期實質成分明顯強化,實質期持續強化,排泄期強化程度下降,周邊壞死區強化不明顯。
對81例腎細胞癌行MSCT檢查和20例同時行MRI檢查者統計后發現,CT、MRI增強掃描后強化強化均勻度基本相同,故將CT、MRI強化均勻度的資料一并統計,統計結果,見表2。
MRI增強后強化程度的統計結果,見表3。

表2 81例腎癌CT、MRI增強掃描腫瘤強化均勻度
因CT強化程度和MRI判斷方法有差異,故分別統計,CT增強后的強化程度統計結果,見表4。
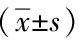
表3 81例腎癌與正常腎皮質各期增強掃描CT值

表4 20例腎癌MRI增強掃描強化程度
2.3 案例
女,12歲,右下腹痛1 d。右腎透明細胞癌,圖1A-D分別為CT平掃/皮髓質期/實質期/排泄期,圖1E-G分別為MRI同反相位/增強掃描,腫瘤呈類圓形,密度不均,內見鈣化灶和出血灶,有包膜,皮髓質期輕度強化,實質期強化幅度下降,排泄期強化幅度進一步減低,反相位示腫瘤內片狀密度減低區(說明內含脂肪),增強后輕度強化。男,49歲,體檢發現。右腎嫌色細胞癌,圖2A-C分別為平掃、皮髓質期,排泄期,腫瘤呈橢圓形,密度均勻,邊界清晰,皮髓質期輕度不均勻強化,排泄期強化幅度略增加。男,72歲,體檢發現。右腎多房囊性腎癌,圖3A-C分別為平掃、皮髓質期,排泄期,腫瘤呈類圓形囊實性密度影,密度不均,內見實性部分及分隔影,皮髓質期實性部分明顯強化,分割呈輕度強化,排泄期實性部分及分隔強化幅度增加。男,4歲,無痛性肉眼血尿3 d,右腎Xp11.2易位/TFE3基因融合相關性腎癌,圖4A-C分別為皮髓質期,排泄期軸位,排泄期冠狀位,腫瘤呈橢圓形,境界清楚,密度不均,內見壞死區,皮髓質期明顯不均勻強化,排泄期強化幅度下降。見圖1-圖4。

注:圖1-A:CT平掃,右腎透明細胞癌;圖1-B:皮髓質期;圖1-C:實質期;圖1-D:排泄期;圖1-E:MRI同相位;圖1-F:反相位;圖1-G:增強掃描圖1 患者女,右腎透明細胞癌

注:圖2-A:平掃;圖2-B:皮髓質期;圖2-C:排泄期圖2 患者男,右腎嫌色細胞癌

注:圖3-A:平掃;圖3-B:皮髓質期;圖3-C:排泄期圖3 患者男,右腎多房囊性胃癌

注:圖4-A:皮髓質期;圖4-B:排泄期軸位;圖4-C:排泄期冠狀位圖4 患者男,右腎Xp11.2易位/TFE3基因融合相關性腎癌
3 討論
腎癌發病率呈逐年上升趨勢,至2008年已經成為我國男性惡性腫瘤發病率第10位,而且大多數腎癌患者是由于健康查體時發現的無癥狀腎癌。腎癌約占成人惡性腫瘤的2%~3%,占成人腎臟惡性腫瘤的80%~90%。世界范圍內不同地區的發病率各不相同,總體上發達國家發病率高于發展中國家,城市地區高于農村地區,男性多于女性,男女患者比例約為2∶1,發病年齡可見于各年齡段,高發年齡50~70歲,本文統計數據與此基本一致。不同病理類型的腎癌強化模式不同,機制與其病理組織學表現有關。
腎透明細胞癌因鏡下顯示癌細胞胞漿透明空亮而得名,約占腎細胞癌的60%~85%,大部分散發性腎透明細胞癌是單側單病灶.約2%~5%的患者同時或相繼發生雙側腎臟或單側多中心病灶,而遺傳性腎透明細胞癌多為雙側多病灶[1]。透明細胞癌質地不均勻,鏡下顯示為密集的腺泡及管狀、囊狀結構,易發生出血、壞死和囊變,少數病灶內見鈣化灶,因此在CT檢查中顯示為以等、稍低密度為主的混雜密度腫塊影,若發生出血、鈣化,內可見弧形、斑點狀、斑片狀、沙粒狀或無定形的高密度影;因癌腫內有纖細的血管網,在CT、MRI增強掃描中絕大多數顯示為皮髓質期明顯不均勻強化,實質期、排泄期強化效應迅速下降,符合“快進快出”的強化特點,這些都表明透明細胞癌大部分為富血供腫瘤。其惡性程度高,預后差,總的5年生存率約為55%~60%,但又因其組織成分不同,預后有差異,如癌組織內有囊性變的患者預后好于實性透明細胞癌患者[2-4],約2%~5%的癌組織中含有肉瘤樣結構,常常提示預后不良[5-6]。
乳頭狀腎細胞癌約占腎細胞癌的7%~14%。病變累及雙側腎臟和多灶性者相對多見。但本組病例均為單側單發,與病例數較少有關。其男女發病率、發病年齡均與腎透明細胞癌相類似,但乳頭狀腎細胞癌為乏血供腫瘤,因此皮髓質期表現為輕中度強化,強化程度明顯低于透明細胞癌,這可用于兩者初步鑒別診斷,但透明細胞癌也有少數含有較少血管,所以應結合臨床癥狀、體征、實驗室檢查綜合分析,以免增加誤診率。早期的某些研究結果顯示乳頭狀腎細胞癌預后比腎透明細胞癌好,5年生存率約為80%~90%,但也有報道分級較高以及晚期乳頭狀腎細胞癌因其生長速度和轉移發生率差異大,預后也不完全相同。
嫌色細胞癌約占腎細胞癌的4%~10%,男女發病率無明顯差異,臨床癥狀、體征也無特殊表現。嫌色細胞癌多為單發性實體腫瘤,無包膜但邊界清楚,部分病例有壞死,但出血灶極少見,其為少血供腫瘤,因此皮髓質期腫瘤強化程度明顯低于同期腎皮質,實質期強化程度略有增加,但仍呈相對低密度,排泄期強化效應下降,本組有75%出現輪輻狀強化,明顯超過近30%嫌色細胞癌出現輪輻狀強化[7-8], 這可能與本組病例較少有關。有研究顯示嫌色細胞癌預后較好,術后5年生存率78%~100%。死亡率不到10%。本組有一半病例出現轉移,但與Renshaw等[9]報道存在差異,25例嫌色細胞癌中有7例最終出現遠處轉移。
多房性囊性腎細胞癌約占腎癌的1%~2%,男女發病率約為3:1,通常無臨床癥狀,且多為意外發現。因腫瘤具有低分期、低分級的特點,所以發展緩慢,預后良好,5年生存率幾乎達100%。腫瘤境界清楚,有大小不等的囊腔組成,其內充以漿液性或成分復雜的液體,CT平掃密度高于水,腫瘤實質成分小于25%,鏡下腫瘤呈多房囊性,囊壁、間隔及實性成分內有透明細胞癌成分聚集,因此增強后腫瘤實性成分強化模式與透明細胞癌相類似,間隔呈中度漸進性強化。
Xp11.2易位性/TFE3基因融合相關性腎癌罕見,主要見于兒童和年輕人,年長者更加少見,而且多數發現時已經是腫瘤進展期。遺傳學檢查均有染色體Xp11.2不同的易位,所有的易位都導致TFE3基因融合。因由透明細胞構成的乳頭狀結構為特點,增強后具有透明細胞癌的強化特點,皮髓質期實性部分明顯強化,實質期、排泄期強化效應明顯減低,但位于病灶邊緣的壞死成分未見明顯強化。由于本組只有1例病例不具有代表性,有待進一步完善。
目前外科手術治療仍然是腎癌主要的治療方法,包括根治性腎切除術、部分切除術、腹腔鏡下手術。對于可以手術切除的腫瘤,根治性腎切除術仍是標準的治療方法,雖然手術技術和方法做了很大的改進,術后死亡率依然很高,而且增加患者的痛苦,如果術前CT、MRI檢查能夠準確判定腎癌病理類型,對于確定手術治療方案能夠提供很大幫助,對于那些復發或轉移率較低、預后很好的腎癌類型,可以采取部分切除術或腹腔鏡下手術,避免不必要的廣泛切除,從而降低術后風險、死亡率,減少患者痛苦。總之,雖然不同病理類型的腎細胞癌具有各自的影像特征,對于診斷腎癌的病理類型具有重要價值但鑒于CT、MRI平掃、強化特征在各種類型的腎癌中仍有重疊,因此在臨床實踐中,應密切結合檢驗室檢查、臨床癥狀、體征綜合分析,盡可能減少誤診率。
[1] 馬建輝,關有彥,鄭閃,等.腎細胞癌病理分類的新進展[J].腫瘤學雜志,2008,14(5):334-336.
[2] ONISHI T’OISHI Y,GOTO H,etal.Cyst-associated renal cell carcinoma:clinicopathologic characteristics and eval uation of prognosis in 27 cases[J].Int J Urol,2001,8(6):268-274.
[3] COFICA F A,ICZKOWSKI K A,CHENG L,etal.Cystic renal cell carcinoma is cured by resection:a study of 24 cases with long-term follow-up[J].J Uroi,1999,161(2):408-411.
[4] KOGA S,NISHIKIDO M,HAYASHI T,etal.Outcome of surgery incystic renal cellcarcinoma[J].J Urol,2000,56 (1):67-70.
[5] 陸敏,鄒萬忠,腎臟腫瘤[A].馮曉莉.泌尿系統及男性生殖器官腫瘤病理學和遺傳學(澤著)[M].北京:人民衛生199出版社.2006:1-37.
[6] EBELE J N,SAUTER G,EPSTEIN J I,etal.Pathology and ge-netics of tumours ofthe urinary system and male genital organs[M].Lyon:IARC,2004:12-43.
[7] KONDO T,NAKAZAWA H,SAKAI F,etal.Spoke-wheel-like enhance-ment asan impotant imaging finding ofchromophobe cell renalcarcinoma:a retrospective analysis on computed tomography and magnetic resonance image studies[J].Int J Urol,2004,11(10):817-824.
[8] 周建軍,丁建國,周康榮.腎嫌色細胞癌:動態增強影像學表現 [J].放射學實踐,2008,23(2):161-164.
[9] RENSHAW A A,HENSKE E P,LOUGHLIN K R,etal.Aggressive variants of chromophobe renal cellcarcinoma[J].Cancer,1996,78(8):1756-1761.

