腹腔鏡肝切除術治療小肝癌臨床分析
宋舉賢 陳健 李建偉 范毓東 王小軍 鄭樹國
·論著·
腹腔鏡肝切除術治療小肝癌臨床分析
宋舉賢 陳健 李建偉 范毓東 王小軍 鄭樹國
目的 探討腹腔鏡肝切除術(LH)治療小肝癌的臨床療效。方法 回顧分析2007年1月~2013年12月第三軍醫大學西南醫院102例行LH治療小肝癌患者的臨床資料。結果 102例患者中中轉開腹4例,中轉開腹率為 3.9%,并發癥發生率為29.4%,手術時間(189.6±76.9)分鐘,術中失血量(284.6±278.6)ml,術中輸血率為3.9%,全腸外營養使用率為6.9%,住院時間為(16.1±5.5)天。中位隨訪時間為44.5個月,1年、3年總體生存率為95.3%、82.6%,相應的總體無瘤生存率為80.4%、58.2%。亞組分析中肝前下段組和肝后上段組在圍手術期數據和隨訪結果比較,差異均無統計學意義(P>0.05)。結論 LH創傷小,恢復快,并發癥發生率低,腹腔鏡肝切除術在肝前下段和肝后上段切除具有相同的近期和遠期效果。
腹腔鏡肝切除術; 小肝癌; 微創
肝切除術一直被推薦為治療小肝癌(hepatocellular carcinoma,HCC)的一線選擇。傳統開腹肝切除創傷大,出血多,并發癥發生率和手術死亡率均較高[1]。腹腔鏡手術的近期效果優于開腹手術,遠期效果與開腹手術一致[2-3],肝癌的微創治療優勢明顯。目前國內腹腔鏡肝切除手術(laproscopic hepatectomy,LH)的文獻雖多,但樣本量較少且大多集中于肝前下段(Ⅱ、Ⅲ、Ⅳb、Ⅵ段)的病灶局部切除、楔形切除或者半肝切除,對于肝后上段(Ⅰ、Ⅳa、Ⅶ、Ⅷ段)的腹腔鏡手術鮮有報道[4]。我們2007年開展腹腔鏡手術以來,順利完成學習曲線,逐漸發展至全肝段的精細解剖性切除。現對2007年1月~2013年12月102例行LH治療小肝癌患者的臨床資料進行回顧性分析。
對象與方法
一、對象
HCC患者102例,男87例,女15例,年齡22~74歲,平均年齡49歲。所有患者均無特異性臨床癥狀,僅有5例因肝硬化進展及乙肝病毒復制增高出現明顯乏力、納差,其余為乙肝復診或體檢時發現。診斷依據:術前明確的肝病史、實驗室檢驗結果及相關影像學資料,包括上腹部增強CT、超聲造影或肝腫瘤特異性磁共振,并經過術后病理檢查確診。乙肝病毒感染100例,病理證實的肝硬化91例。巴塞羅那臨床肝癌分期:0期42例,A期60例。Child-Pugh分級:A級99例,B級3例。東部腫瘤協作組評分標準:0分83例,1分17例,2分2例。腫瘤數量:單發96例,2個6例。根據肝臟的Couinaud分段法,結合術前CT檢查及術中確認統計每個腫瘤的位置,當腫瘤位于肝段之間時以占有體積較大的計算:Ⅰ段2例,Ⅱ段10例,Ⅲ段16例,Ⅳ段17例,Ⅴ段13例,Ⅵ段29例,Ⅶ段8例,Ⅷ段13例。
在亞組分析中按腫瘤切除部位分為肝前下段組和肝后上段組。肝后上段組是在完成LH學習曲線后開展,病例數少,為保證基線資料的方差齊性(P>0.05),兩組根據年齡(5年內),肝癌確診日期(同年內),手術治療日期(同年內)和BCLC分期(相同或相似)進行了1∶1匹配,最終完成配對46例,其中肝前下段組(23例)和肝后上段組(23例)。
納入組標準:(1)年齡18~75歲;(2)原發性肝癌診斷明確;(3)肝內單發腫瘤,最大直徑≤3 cm,未侵犯門靜脈、肝動靜脈及下腔靜脈,無淋巴結或肝外轉;(4)肝功能(Child-Pugh分級A或B,ICG-R15<30%,無凝血功能障礙,血小板計數>50×109/L和凝血酶原時間延長<5 s);(5)之前未進行肝動脈化療栓塞、射頻消融、無水酒精注射手術、索菲拉尼、化療等抗腫瘤治療;(6)ECOG評分≤2分。
排除標準:(1)重度門脈高壓征(有胃底或食管靜脈曲張破裂出血史、嚴重脾功能亢進或難治性腹水);(2)病理學檢查證實為膽管細胞性、混合細胞性肝癌、切緣陽性者及非肝臟原發性腫瘤。
二、方法
1.手術方法:患者常規取仰臥位,氣管插管,靜脈復合全身麻醉。根據腫瘤的位置適當墊高右側背部、懸吊右臂,必要時整體向左或向右傾斜15~45°。穿刺針建立12~14 mmHg氣腹,于臍周刺入腹腔鏡孔,然后依次完成其他操作孔。探查腹腔臟器,檢查有無腫瘤轉移或侵犯,使用術中超聲進一步明確肝臟情況及腫瘤部位,結合影像資料及術中探查結果決定手術方式。原則上盡量行解剖性肝段切除,對于無法行解剖性肝段切除者,切緣至少距離腫瘤邊緣1 cm。預置腹腔鏡下全肝血流阻斷帶,離斷預切除肝臟周圍的韌帶。超聲刀離斷肝實質,鈦夾或者hem-o-lok夾閉直徑>3 mm的管道,單極、雙極電凝處理肝斷面,必要時血管縫線縫扎止血,如涉及較大肝蒂或肝靜脈則使用腔內直線切割閉合器。切除后檢查標本確認腫瘤完整切除后患者繼續接受治療直到復查正常后出院。
2.隨訪:以治療時間為0點,術后每3個月隨訪1次,內容包括增強CT檢查、肝功能、甲胎蛋白(AFP)、相關病毒定量、胸片及臨床評估。當肝內復發難以鑒定時增加超聲造影或磁共振肝腫瘤特異性檢測。懷疑肝外轉移時,將進行進一步全身檢查。一旦確認復發或轉移,將由主管醫生、病理科醫生和影像學醫生根據患者的臨床表現和實際情況提出建議,予以肝切除術、再次LH或射頻消融、肝動脈化療栓塞等,最終治療由患者作出決定。所有檢查和治療均在我院完成。隨訪時間截至2016年12月31日。
三、統計學處理
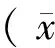
結 果
1.圍手術期結果:102例患者中4例(Ⅴ段1例,Ⅲ段、Ⅵ段各1個病灶1例、Ⅷ段1例, Ⅴ段、Ⅷ段肝蒂之間1例)因腫瘤位置特殊、肝硬化程度重而中轉開腹行傳統肝切除術,總體中轉開腹發生率為 3.9%。9例患者因腫瘤緊貼肝蒂或兩個病灶位于不同肝段行半肝切除(左半肝7例,右半肝2例)。39例患者行解剖性肝段切除,63例患者行腫瘤局部切除。按腫瘤切除部位劃分肝前下段組70例,肝后上段組23例。術后病理檢查均顯示腫瘤包膜完整且切緣為陰性無腫瘤殘留,其中高分化11例,中度分化82例,低分化9例。術后總體不良事件如下:肝功能不全1例,頑固性腹水3例,胸腔積液16例,肺部感染5例,肝斷面積液并感染2例,術后出血3例,總體并發癥發生率為29.4%。右側胸腔積液是最常見的術后并發癥,其中7例患者經保守治療無效后行胸腔穿刺引流術后治愈;1例患者右半肝切除術后出現肝功能不全,經保守治療無效再次行肝移植術治愈;3例頑固性腹水患者經補充血漿白蛋白、利尿及腹腔穿刺引流術后治愈,3例患者出現術后出血,予以保守治療后治愈。住院期間均無死亡病例。
總體手術時間為(189.6±76.9)分鐘,術中失血量(284.6±278.6)ml,術中輸血率為3.9%(4/102),全腸外營養使用率為6.9%,住院時間(16.1±5.5)天。亞組分析中,肝前下段組并發癥發生率為13.0%(3/23),肝后上段組并發癥發生率為21.3%(5/23),兩組比較差異無統計學意義(P>0.05);兩組手術時間、術中失血量、術中輸血率、全腸外營養使用率、住院時間分別為(189.7±76.0)、(198.2±69.9)分鐘,(279.1±209.8)、(243.9±162.2)ml,4.3%、 0,4.3%、8.7%,(14.8±3.0)天、(19.1±8.9)天,差異均無統計學意義(P>0.05)。
2.隨訪結果:隨訪時間34.5~63.0個月,中位隨訪時間44.5個月。46例患者隨訪期內出現復發,其中43例出現肝內復發,2例患者出現肝外臟器轉移(骨轉移和腹壁轉移),無肝內轉移病灶,1例患者出現肝外臟器的轉移(腹腔多發轉移)同時合并肝內轉移。死亡33例,其中肝癌復發和肝外轉移死亡32例,術后2年死于心肌梗塞1例。1年、3年總體生存率為95.3%、82.6%,相應的總體無瘤生存率為80.4%、58.2%。肝前下段組和肝后上段組1年、3年生存率和無瘤生存率比較,差異均無統計學意義(P>0.05)。
討 論
原發性肝癌是全球最常見的惡性腫瘤之一,其發病原因主要與乙肝病毒感染和肝硬化相關[5-6]。對于小肝癌的治療國際上尚無統一標準,由于入選標準和技術的差異,其治療方式仍有爭議,國際上得到普遍認可的是巴塞羅那臨床肝癌系統[7-8],主張對于0期和A1期的患者使用肝切除術,而對于A2-A4期行肝移植術、無水酒精注射術和射頻消融術。對于A2-A4期使用射頻消融術或者無水酒精注射術代替肝切除術的基本原理是減少圍手術期死亡率和保護肝硬化患者的肝功能。有效的抗病毒治療已成為可能[9],手術創傷導致肝功能衰竭死亡的肝硬化并發癥已大幅下降。肝切除術對腫瘤的大小、數目或大血管侵犯沒有限制,使其具有更廣泛地適用性。LH是我國目前小肝癌治療最有效、最具可行性的治療手段之一[10]。
肝切除的手術方式有傳統開腹手術和腹腔鏡肝癌切除術。LH相對于傳統開腹手術,創傷小,恢復快,并發癥發生率低[11],與射頻消融術比較,具有更長的無瘤生存時間[12]。亞組分析中經過配對研究,對比分析前下段組和后上段組并發癥發生率、手術時間、術中失血量、術中輸血率、全腸外營養使用率、住院時間、術后1、3年生存率和相應無瘤生存率的差異,均無統計學意義。相對于解剖更困難的后上段,腹腔鏡肝切除術同樣安全有效。
腹腔鏡肝切除術是在傳統肝切除術基礎上發展而來,已由當初的僅適用于左肝外葉或部分肝段表淺組織的不規則切除,拓展應用于更為復雜、疑難的解剖性肝段切除。主要體現在穿刺孔的建立布局、入肝血流的阻斷以及腔鏡下縫合技術。
穿刺孔的建立需要個體化設計[13]。在此過程中一般需要5個穿刺孔,其中包括1個10 mm鏡孔、2個12 mm主操作孔和2個5 mm輔助孔。鏡孔應遵循充分暴露切緣和不妨礙操作者的原則,例如左半肝手術選擇肚臍左側,對于特殊肝段如Ⅳa、Ⅶ、Ⅷ段或需要解剖第二肝門的應向頭側調整,2個12 mm主操作孔根據術者和助手習慣位于鏡孔兩側,5 mm輔助孔位于最遠端,其設置的基本要點是沿預切除區域呈扇形展開。在實際操作中隨著腫瘤部位、手術入路、技術積累和操作習慣等因素影響,穿刺孔的數量可能有所增減,位置也會互相替換或改變,如進行頭側入路解剖第二肝門時,會選擇劍突下作為主操作孔以方便縫合和器械的進出。同時我們時常會再設置一個5 mm的穿刺孔,用于預置肝門阻斷帶控制入肝血流。腹腔鏡手術的微創性,還應考慮穿刺孔用于術后放置引流管或者互相連接擴大作為出標本口,使其更加美觀。
由于復雜的結構及豐富的血液供應,失血量的控制成為肝切除術中的嚴重問題[14]。Pringle手法簡單、安全。在腹腔鏡手術中,有學者根據其特點改進了這一經典的手法[15],具體為分離出第一肝門后放置肝門阻斷帶,并于另外的5 mm穿刺孔中引出備用,當需要阻斷肝門時收緊阻斷帶以控制入肝血流,阻斷時間同常規開腹手術。腹腔鏡下Pringle手法的廣泛應用,使其突破了關鍵的技術瓶頸,操作者可以進行復雜肝部分的切除,手術方式由前下段切除向后上段突破,甚至進行解剖性肝段切除。
隨著技術的進步,超聲刀、超聲吸引裝置、多功能手術解剖器、微波刀、射頻輔助肝切除等器械的應用使得肝臟解剖更加精細化,而單雙極電凝、連發鈦夾、Hem-o-lock、生物夾、腔內切割閉合器等簡化了肝臟內管道的處理,減少了出血。由于肝臟特殊的解剖結構,在切除的過程中仍不可避免會遇到出血不止的情況,因此,對于管道特別是血管的縫扎和修補十分重要。腹腔鏡的特殊環境要求操作者改變傳統的縫合方式,由于腹腔鏡器械較長、Trocar孔固定使得腔鏡下的穿刺與打結不如開腹狀態下流暢,同時由于顯微視野下需要在一些相對狹小的空間或者特殊角度縫合更增加了腔鏡環境下縫合技術的難度。在腔鏡開展的初期,大部分中轉開腹的原因均是由于無法控制的出血,縫合技術在其中具有關鍵作用。
[1] Katz SC,Shia J,Liau KH,et al.Operative blood loss independently predicts recurrence and survival after resection of hepatocellular carcinoma[J].Ann Surg,2009,249(4):617-623.
[2] Ishizawa T,Gumbs AA,Kokudo N,et al.Laparoscopic segmentectomy of the liver:from segment I to VIII[J].Ann Surg,2012,256(6):959-964.
[3] Cheung TT,Poon RT,Yuen WK,et al.Long-term survival analysis of pure laparoscopic versus open hepatectomy for hepatocellular carcinoma in patients with cirrhosis:a single-center experience[J].Ann Surg,2013,257(3):506-511.
[4] Buell JF,Cherqui D,Geller DA,et al.The international position on laparoscopic liver surgery:The Louisville Statement,2008[J].Ann Surg,2009,250(5):825-830.
[5] Ferlay J,Soerjomataram I,Dikshit R,et al.Cancer incidence and mortality worldwide:sources,methods and major patterns in GLOBOCAN 2012[J].Int J Cancer,2015,136(5):E359-386.
[6] Wang X,Lin SX,Tao J,et al.Study of liver cirrhosis over ten consecutive years in Southern China[J].World J Gastroenterol,2014,20(37):13546-13555.
[7] Huang J,Yan L,Cheng Z,et al.A randomized trial comparing radiofrequency ablation and surgical resection for HCC conforming to the Milan criteria[J].Ann Surg,2010,252(6):903-912.
[8] Bruix J,Sherman M.American Association for the Study of Liver D.Management of hepatocellular carcinoma:an update[J].Hepatology,2011,53(3):1020-1022.
[9] Papatheodoridis GV,Chan HL,Hansen BE,et al.Risk of hepatocellular carcinoma in chronic hepatitis B: assessment and modification with current antiviral therapy[J].J Hepatol,2015,62(4):956-967.
[10]吳孟超.肝癌外科治療的近期進展[J].中國普外基礎與臨床雜志,2006,13(2):125-128.
[11]Nguyen KT,Marsh JW,Tsung A,et al.Comparative benefits of laparoscopic vs open hepatic resection:a critical appraisal[J].Arch Surg,2011,146(3):348-356.
[12]Song J,Wang Y,Ma K,et al.Laparoscopic hepatectomy versus radiofrequency ablation for minimally invasive treatment of single,small hepatocellular carcinomas[J].Surg Endosc,2016,30(10):4249-4257.
[13]Martin RC,Scoggins CR,McMasters KM.Laparoscopic hepatic lobectomy:advantages of a minimally invasive approach[J].J Am Coll Surg,2010,210(5):627-634,634-636.
[14]Couinaud C.[Liver lobes and segments:notes on the anatomical architecture and surgery of the liver ][J].Presse Med,1954,62(33):709-712.
[15]Rotellar F,Pardo F,Bueno A,et al.Extracorporeal tourniquet method for intermittent hepatic pedicle clamping during laparoscopic liver surgery:an easy,cheap,and effective technique[J].Langenbecks Arch Surg,2012,397(3):481-485.
(本文編輯:楊澤平)
Clinical analysis of laparoscopic hepatectomy for small hepatocellular carcinoma
SONGJuxian,CHENJian,LIJianwei,etal.
(DepartmentofHepatobiliarySurgery,theforty-fourthHospitalofPLA,Guiyang550000,China)
Objective To evaluate the clinical effect of laparoscopic hepatectomy for small hepatocellular carcinoma.Methods We retrospectively analyzed the medical records of 102 patients undergoing laparoscopic hepatectomy for small hepatocellular carcinoma from January 1,2007 to December 31,2013 at the Southwest Hospital Affiliated to the Third Military Medical University.Results Four patients were converted to laparotomy,and the rate of conversion to laparotomy was 3.9%.The overall complication rate was 29.4%.The total operative time was(189.6±76.9)min,intraoperative blood loss(284.6±278.6)ml,intraoperative blood transfusion rate was 3.9%(4/102),total parenteral nutrition utilization rate was 6.9%(7/102)d and hospital stay was(16.1±5.5)d.The median follow-up time was 44.5 months,1-,and 3-year overall survival rate were 95.3% and 82.6%.The corresponding overall disease-free survival rate:80.4%,58.2%.In the subgroup analysis,there was no statistically significant difference between the anterolateral liver segment group(Ⅱ,Ⅲ,Ⅳb,Ⅴ,and Ⅵ)and the posterosuperior liver segment group(Ⅰ,Ⅳa,Ⅶ,and Ⅷ)in the perioperative data and follow-up results(P>0.05).Conclusion
Laparoscopic hepatectomy had the advantages of small trauma,quick recovery and low incidence of complications.Laparoscopic hepatectomy had the same short-term and long-term effects in the anterolateral liver segment and posterosuperior liver segment resection.
laparoscopic hepatectomy; small hepatocellular carcinoma; minimally invasive treatment
10.3969/j.issn.1005-6483.2017.03.005
550000 貴陽,解放軍第44醫院肝膽外科(宋舉賢); 第三軍醫大學西南醫院全軍肝膽外科研究所(陳健、李建偉、范毓東、王小軍、 鄭樹國)
鄭樹國,Emai:Shuguozh@163.com
2017-02-25)

