目標導向液體治療單肺通氣肺癌根治術患者術中肺功能及中心靜脈血炎癥因子水平觀察
許輝,疏樹華,王迪,章敏,柴小青
(安徽醫科大學附屬省立臨床學院,合肥230001)
目標導向液體治療單肺通氣肺癌根治術患者術中肺功能及中心靜脈血炎癥因子水平觀察
許輝,疏樹華,王迪,章敏,柴小青
(安徽醫科大學附屬省立臨床學院,合肥230001)
目的 觀察目標導向液體治療(GDFT)單肺通氣肺癌根治術患者術中的肺功能及中心靜脈血炎癥因子水平。方法 60例擬行肺癌根治術的患者,隨機分為觀察組和對照組各30例,觀察組、對照組術中分別采用GDFT、傳統液體療法補液。分別于單肺通氣前(T1)、單肺通氣30 min(T2)、單肺通氣1 h(T3)、恢復雙肺通氣10 min(T4)及術畢(T5)時抽取兩組橈動脈血,測定兩組氧分壓(PaO2)及二氧化碳分壓(PaCO2),計算并記錄氧合指數(OI)及呼吸指數(RI)。分別于T1、T5及術后24 h(T6)時采集兩組中心靜脈血,采用ELISA法測定血清腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)、IL-10。結果 觀察組T1、T2、T3、T4及T5時OI分別為431±59、284±38、276±31、325±42、384±56,對照組分別為425±53、246±32、239±26、284±33、316±45;觀察組T1、T2、T3、T4及T5時RI分別為0.38±0.16、2.28±0.52、2.46±0.45、1.72±0.43、1.35±0.48,對照組分別為0.36±0.15、1.82±0.46、1.88±0.42、1.14±0.38、0.84±0.35。與對照組比較,觀察組T2~T5時OI升高,RI降低(P均<0.05)。觀察組T1、T5、T6血清TNF-α分別為16.2±2.8、67.9±10.1、143.7±31.6,對照組分別為15.6±2.5、98.4±9.6、214.5±38.2;觀察組T1、T5、T6血清IL-6分別為8.4±1.3、56.3±9.8、49.5±8.2,對照組分別為8.2±1.3、71.4±12.5、68.3±11.4;觀察組T1、T5、T6血清IL-10分別為92.2±14.3、77.1±10.4、92.2±14.3,對照組18.4±4.6、69.5±11.7、42.8±8.3。與對照組比較,T5、T6時觀察組血清TNF-α,IL-6水平降低(P均<0.05)。結論 GDFT可減輕肺癌根治術患者OLV后肺臟彌散及氧合功能的損害,減輕體內炎癥反應的發生。
目標導向液體治療;肺癌根治術;單肺通氣;每搏量變異度
單肺通氣(OLV)是胸外科手術常用的一種非生理性通氣策略。OLV期間,通氣側肺受大潮氣量和高氣道壓刺激可使肺泡過度萎陷、膨脹等,而非通氣側肺受到缺氧/再灌注損傷及手術牽拉、擠壓等操作刺激,均可導致肺組織炎性反應,誘發急性肺損傷(ALI),嚴重影響患者預后[1]。限制性液體療法補液是以往臨床常用的OLV補液方法,但研究[2]發現限制性液體療法OLV時ALI發生率普遍較高。目標導向液體治療(GDFT)是根據動態血流動力學參數進行圍術期液體治療的新理念,可滿足個體化容量管理需要。研究[3]表明,GDFT可改善微循環灌注及組織氧供,提高患者動脈氧合,減輕局部組織炎癥反應。目前關于GDFT對肺癌根治術患者OLV后肺功能損傷的作用相關報道較少。我們觀察了GDFT對肺癌根治術患者OLV時術中肺功能及中心靜脈血炎癥因子水平變化。現將結果報告如下。
1 資料與方法
1.1 臨床資料 選擇2016年2~11月間安徽醫科大學附屬省立臨床學院胸外科行擇期肺癌根治術的肺癌患者60例。納入標準:年齡35~60歲,ASA分級Ⅰ~Ⅱ級,心功能Ⅰ~Ⅱ級,BMI 18.5~25.0 kg/m2。排除標準:OLV時間<45 min,一周內發生過肺部感染,存在阿片類藥物過敏以及嚴重肝、腎、肺疾病病史。60例患者采用隨機數字表法分為觀察組和對照組各30例。觀察組中男22例、女8例,年齡(51±6)歲,ASA分級為Ⅰ級4例、Ⅱ級26例,BMI(22.1±2.6) kg/m2,術前血紅蛋白Hb(132±17)g/L。對照組中男21例、女9例,年齡(52±4)歲,ASA分級為Ⅰ級5例、Ⅱ級25例,BMI(21.7±2.4) kg/m2,術前血紅蛋白Hb(125±14)g/L。兩組性別比例、年齡、BMI、ASA分級、術前Hb水平等臨床資料具有可比性。本研究已獲得我院倫理委員會批準。所有患者或其委托人均知情同意并簽署知情同意書。
1.2 麻醉方法 兩組均行肺癌根治術。術前常規禁飲禁食,觀察組連接Narcotrend麻醉/腦電意識監測系統(MT公司,德國),對照組橈動脈連接FloTrac/Vigileo監測系統(Edwards公司,美國)。麻醉誘導方法:靜脈注射咪達唑侖0.02 mg/kg、依托咪酯0.6 mg/kg、舒芬太尼0.4 μg/kg、羅庫溴銨0.8 mg/kg,纖維支氣管鏡引導下行雙腔支氣管插管,確認導管位置后連接呼吸機行正壓機械通氣,設定雙肺通氣時VT 8~10 mL/kg,呼吸頻率(RR)10~12次/分,I∶E為1∶2,FiO2=100%,設定呼吸末正壓PEEP為5 cm H20,單肺通氣時調節VT 6~8 mL/kg,RR 10~16次/分。調節呼吸機參數維持PETCO2在30~40 mmHg,SpO2>90%。麻醉誘導完成后靜脈泵注丙泊酚4~8 mg/(kg·h)、瑞芬太尼0.05~0.2 μg/(kg·h),吸入1%~2% 七氟醚維持NTI值37~46(常規麻醉狀態),隨后行頸內靜脈穿刺置管,持續監測CVP。術中間斷予以順式阿曲庫銨維持肌肉松弛度,維持患者鼻咽溫>35.5 ℃。
1.3 GDFT治療方法 觀察組參照文獻[4]根據每博量變異度(SVV)及CI進行指導補液:麻醉誘導前靜脈輸注6%羥乙基淀粉溶液(130/0.4)5~7 mL/kg補充代償性血管擴張量,隨后以8 mL/(kg·h)持續輸注復方乳酸鈉林格液,排除手術壓迫心臟的影響后,若SVV<11%,CI>2.5 L/(min·m2),則繼續按照原方案繼續補液;若出現SVV>11%,則靜脈輸注6%羥乙基淀粉溶液(130/0.4)50 mL/min直至SVV<11%持續2 min以上,若SVV<9%,則暫緩補液,補液時注意維持CI>2.5 L/(min·m2);若5min后SVV仍>11%或者CI<2.5 L/(min·m2),則考慮靜脈應用小劑量3~5 μg/(kg·h)多巴胺丁酚;對照組采用經典液體療法進行容量管理,于麻醉誘導前靜脈輸注6%羥乙基淀粉溶液(130/0.4)5~7 mL/kg補充代償性血管擴張量,在排除手術壓迫心臟的影響后,調節補液量以維持MAP 65~110 mmHg,HR60~100 bpm,CVP 6~12 mmH2O,尿量>0.5mL/(kg·h)。若兩組術中出現Hb<80 g/L,則輸注紅細胞懸液,維持Hb>80 g/L。若術中出現MAP<基礎值20%,持續1 min以上,且調節補液量無效時,則考慮靜脈給予去氧腎上腺素20~40 μg或麻黃堿6 mg。
1.4 觀察指標及方法 分別于單肺通氣前(T1)、單肺通氣30 min(T2)、單肺通氣1 h(T3)、恢復雙肺通氣10 min(T4)及術畢(T5)時抽取兩組橈動脈血,測定兩組氧分壓(PaO2)及二氧化碳分壓(PaCO2),計算并記錄氧合指數(OI)及呼吸指數(RI)。OI=PaO2/FiO2;RI=P(A-a)DO2/PaO2;P(A-a)DO2=(PB-PH2O)×(FiO2-PaO2-PaCO2)/RQ(其中PB=760 mmHg;PH2O=47 mmHg;RQ=0.8)。分別于T1、T5及術后24 h(T6)時采集兩組中心靜脈血,采用ELISA法測定血清腫瘤壞死因子α(TNF-α)、白細胞介素6(IL-6)、IL-10。觀察并記錄兩組術中OLV時間、術中晶體液和膠體液用量、總輸液量、出血量、尿量以及血管活性藥物使用情況。記錄兩組術后72 h內肺部并發癥(包括急性肺損傷、肺部感染、肺水腫、肺不張等)發生情況。
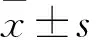
2 結果
不同時間點兩組OI、RI比較見表1。

表1 不同時間點兩組OI、RI比較
注:與本組T1時間點比較,aP<0.05;與對照組比較,bP<0.05。
不同時點兩組血清TNF-α、IL-6及IL-10水平比較見表2。

表2 不同時點兩組血清TNF-α、IL-6及IL-10水平比較
注:與本組T1比較,aP<0.05;與對照組比較,bP<0.05。
觀察組和對照組單肺通氣時間分別為(109±22)、(113±18)min,二者比較,P>0.05。兩組術中晶體液和膠體液用量、總輸液量、出血量、尿量比較見表3。觀察組、對照組血管活性藥物使用率分別為10%、37%,二者比較,P>0.05。
觀察組1例發生肺部感染,對照組3例發生急性肺損傷、4例肺部感染。觀察組肺部并發癥發生情況明顯優于對照組,P<0.05。

表3 兩組術中晶體液和膠體液用量、總輸液量、出血量、尿量比較
注:與對照組比較,aP<0.05。
3 討論
ALI是胸外科手術后常見的并發癥,發生率2%~12%,OLV被認為是導致以及加重ALI的主要因素之一[5]。研究表明,OLV期間,過度容量負荷不僅會導致第三間隙液體儲留,影響臟器功能恢復,增加術后肺水腫的發生率[6]。因此,傳統的觀點主張在肺部手術時通過限制性輸液以避免肺水腫的發生,但常規的血流動力學參數存在靜態性及滯后性,難以及時準確地估計患者的容量狀態,容易導致組織灌注不足,影響組織愈合,增加術后肺部感染和肺不張等肺部并發癥的發生率[7]。SVV是一種功能性血流動力學監測參數,Suehiro[8]研究證實通過FloTrac/Vigileo監測系統得到的SVV可準確反映單肺通氣患者的容量狀態。
OI常用于評價肺換氣及氧合功能,正常值為400~500 mmHg,與患者肺損傷程度呈正相關,在肺功能障礙或通氣/血流比值失調時明顯下降[9]。RI是反映肺臟彌散功能的重要指標,與肺功能狀態呈負相關,其水平越高表示患者肺損傷越嚴重[10]。本研究結果顯示,與T1比較,觀察組、對照組T2~T5時OI降低,RI升高。兩組患者OLV后OI及RI降低,提示兩組患者OLV后肺功能受到損傷。與對照組比較,觀察組T2~T5時OI升高,RI降低,提示GDFT可減輕OLV后肺臟彌散及氧合功能的損害,但并不能完全避免肺組織的損傷。
TNF-α 和IL-6是炎癥反應過程中的主要促炎因子,在OLV所致肺損傷中發揮著重要的作用[11]。而IL-10是由M2型巨噬細胞分泌的一種重要的抗炎細胞因子,可以抑制炎癥反應的發生,其水平高低與機體炎癥反應強度成反比[12]。本研究結果發現,與T1比較,T5、T6時觀察組、對照組血清TNF-α、IL-6及IL-10水平升高,提示OLV所致的肺組織缺氧/再灌注損傷可同時激活患者體內促炎反應及抗炎反應,。與對照組比較,T5、T6時觀察組血清TNF-α、IL-6水平降低,提示GDFT可有效抑制體內炎癥反應的發生,從而在OLV時發揮肺保護效應。同時,觀察組1例發生肺部感染,對照組3例發生急性肺損傷、4例肺部感染。觀察組肺部并發癥發生情況明顯優于對照組,說明GDFT伴OLV患者術后肺功能的恢復更佳。但由于術后肺功能恢復的影響因素較多,本研究不能排除其余因素對結果的影響,因此本結果具有一定局限性,還需進一步擴大樣本量、評估患者術后長期肺功能,來明確GDFT對肺癌根治術患者OLV后肺功能的影響。
綜上所述,GDFT可減輕肺癌根治術患者OLV后肺臟彌散及氧合功能的損害,減輕體內炎癥反應的發生。
[1] Dulu A, Pastores SM, Park B,et al. Prevalence and mortality of acute lung injury and ARDS after lung resection[J]. Chest, 2006,130(1):73-78.
[2] Cabrera-Benitez NE, Laffey JG, Parotto M,et al. Mechanical ventilation-associated lung fibrosis in acute respiratory distress syndrome: a significant contributor to poor outcome[J]. Anesthesiology, 2014,121(1):189-198.
[3] 呂雪彩,曹江北,潘偉,等.不同每搏量變異度指導下的目標導向液體治療對老年患者術后認知功能的影響[J].臨床麻醉學雜志,2016,32(7):629-632.
[4] Zhang J, Chen CQ, Lei XZ,et al. Goal-directed fluid optimization based on stroke volume variation and cardiac index during one-lung ventilation in patients undergoing thoracoscopy lobectomy operations: a pilot study[J]. Clinics, 2013,68(7):1065-1070.
[5] Licker M, Fauconnet P, Villiger Y. Acute lung injury and outcomes after thoracic surgery[J]. Curr Opin Anaesthesiol ,2009,22(1):61-67.
[6] Haas S, Kiefmann R, Eichhorn V,et al. Hemodynamic monitoring in one-lung ventilation[J]. Anaesthesist, 2009,58(11):1085-1096.
[7] Futier E, Constantin JM, Petit A,et al. Conservative vs restrictive individualized goal-directed fluid replacement strategy in major abdominal surgery: A prospective randomized trial[J]. Arch Surg, 2010,145(12):1193-1200.
[8] Suehiro K. Stroke volume variation as a predictor of fluid responsiveness in patients undergoing one-lung ventilation[J]. J Cardiothorac Vasc Anesth, 2010,24(5):772-775.
[9] 王東昕,闞紅莉,于曉東,等.右美托咪定對肺癌根治術患者單肺通氣時的肺保護作用[J].中華麻醉學雜志,2014,34(6):674-677.
[10] 游露,陳松,張紅.缺血后處理對CPB犬肺缺血再灌注損傷時NF-κB及ICAM-1表達的影響[J].中華麻醉學雜志,2015,35(7):868-871.
[11] Schilling T, Kozian A, Senturk M,et al. Effects of volatile and intravenous anesthesia on the alveolar and systemic inflammatory response in thoracic surgical patients[J]. Anesthesiology, 2011,115(1):65-74.
[12] Gao W,Liu DD, Li D. Effect of Therapeutic Hypercapnia on Inflammatory Responses to One-lung Ventilation in Lobectomy Patients[J]. Anesthesiology, 2015,122(6):1235-1252.
安徽省自然科學基金資助項目(1608085QH210)。
10.3969/j.issn.1002-266X.2017.19.030
R782.5
B
1002-266X(2017)19-0094-03
2017-02-08)

