Toll樣受體4特異性拮抗劑TAK-242對人卵巢癌細胞株SKOV-3增殖、凋亡的影響及其機制
魏蔚,劉玉華,劉守燕
(1平頂山學院醫學院,河南平頂山467000;2平頂山市第一人民醫院)
Toll樣受體4特異性拮抗劑TAK-242對人卵巢癌細胞株SKOV-3增殖、凋亡的影響及其機制
魏蔚1,劉玉華1,劉守燕2
(1平頂山學院醫學院,河南平頂山467000;2平頂山市第一人民醫院)
目的 觀察Toll樣受體4(TLR4)特異性拮抗劑TAK-242對人卵巢癌細胞株SKOV-3增殖、凋亡的影響,并探討其可能作用機制。方法 取對數生長期人卵巢癌SKOV-3 細胞分為A組、B組、對照組及空白組, A、B組分別加入終濃度為20、40 nmol/L的 TAK-242培養,對照組加入1% DMSO,空白組不做任何處理。采用MTT比色法觀察給藥24、48、72 h時各組細胞增殖情況,采用Annexin-V/PI觀察給藥24、48、72 h時各組凋亡細胞。采用Western blotting法檢測給藥48 h時各組細胞核因子-κB (NF-κB )p65、總蛋白細胞周期蛋白D1(CyclinD1)、裂解的半胱氨酸天冬氨酸特異性蛋白酶-3(cleaved-caspse 3)。結果 給藥24、48、72 h時,A、B組細胞增殖抑制率均高于對照組、空白組(P均<0.05);給藥24、48、72 h時, B組細胞增殖抑制率均高于A組(P均<0.05);隨給藥時間延長,B組細胞增值抑制率升高(P均<0.05)。給藥24、48、72 h時,A、B組細胞凋亡率均高于對照組、空白組(P均<0.05);TAK-242濃度升高,細胞凋亡率升高,隨給藥時間延長,細胞凋亡率升高(P均<0.05);隨給藥時間增加,B組細胞增值抑制率升高(P均<0.05)。給藥48 h時,細胞NF-κB p65、Cyclin D1蛋白相對表達量低于空白組和對照組,cleaved-caspase 3相對表達量高于空白組和對照組(P均<0.05)。結論 TAK-242可抑制人卵巢癌細胞的增殖、促進細胞凋亡,其機制可能為NF-κB信號通路功能被抑制。
卵巢腫瘤;卵巢癌;Toll樣受體4;細胞增殖;細胞凋亡
卵巢癌是我國常見的婦科腫瘤,發病率和病死率均較高[1, 2]。化療是卵巢癌的常用治療方法[3, 4]。但化療藥物可導致患者出現耐藥性,不良反應較多,因此開發出新型、高效的化療藥物對改善卵巢癌患者的預后具有重要臨床意義[5, 6]。Toll樣受體4(TLR4)屬于Ⅰ型跨膜蛋白,分布于多種組織細胞中,可通過NF-κB信號通路或JNK/SAPK激活途徑激發人體抗感染過程[3, 7]。核因子-κB (NF-κB )p65、總蛋白細胞周期蛋白D1(CyclinD1)、裂解的半胱氨酸天冬氨酸特異性蛋白酶-3(cleaved-caspse 3)是常用的NF-κB信號通路檢測指標。既往研究發現,TLR4在卵巢癌的發生、發展中可能發揮重要作用[7],但其具體機制目前尚不明確。我們觀察了TLR4新型特異性選擇性拮抗劑TAK-242[8]對人卵巢癌細胞株SKOV-3增殖、凋亡的影響,并探討其可能作用機制。
1 材料與方法
1.1 細胞、試劑及儀器 人卵巢癌SKOV-3 細胞株購自中科院上海細胞所,RPMI1640培養基購自美國Gibco公司,MTT試劑盒購自美國Sigma公司,cleaved-caspase 3、H3、CyclinD1、p65和H3,β-actin的抗體均購自美國cell signaling公司。免疫印跡電泳裝置、凝膠成像儀均購自中國天能公司。
1.2 SKOV-3 細胞分組及TAK-242給藥方法 取人卵巢癌SKOV-3 細胞株,復蘇后接種于培養瓶中,培養基為含10%胎牛血清的RPMI1640培養液, 37 ℃飽和濕度、5% CO2的孵箱中培養, 24~48 h換液一次。取處于對數生長期SKOV-3細胞,按照5×105/100 μL的密度接種于96孔板中。培養24 h時將細胞分為A、B組、對照組及空白組,每組9個復孔,A、B組分別加入終濃度為20、40 nmol/L的 TAK-242培養(劑量選擇參照文獻[9]),對照組加入1% DMSO,空白組不做任何處理,將各組細胞置于37 ℃飽和濕度、5% CO2培養箱中培養,備用。
1.3 各組細胞增殖情況觀察 采用MTT比色法。分別取給藥24、48、72 h時各組細胞,PBS洗滌2次,接種于96孔板中,每組9個復孔。每孔加入50 mL 0.5 mg/mL MTT溶液,持續孵育4 h,吸除上清液,然后每孔加入150 μL的DMSO,在振蕩器上震蕩10 min。采用自動酶標儀檢測各組細胞在490 nm波長處的光密度值(OD),取9個復孔的平均值。采用GraphPad Prism軟件計算各組細胞增殖抑制率。細胞增殖抑制率=(1-OD實驗組/OD空白組)×100%。
1.4 各組細胞凋亡情況觀察 采用Annexin-V/PI檢測各組細胞凋亡情況。分別取給藥24、48、72 h時各組細胞,PBS洗滌2次,不含有EDTA胰酶消化,冷PBS洗滌,收集細胞,加入100 μL的結合緩沖液懸浮細胞,5 μL的Annexin V-FITC并充分混勻,再加入5 μL的PI并混勻,室溫、避光條件下反應10 min后,用流式檢測專用的試管收集標本并上機檢測, 最后置于熒光顯微鏡下觀察各組細胞形態學變化:早期凋亡細胞呈現核濃縮伴隨染色加深,或核染色質呈新月形聚集于核膜一邊;晚期的凋亡細胞則表現為核碎裂成大小不等的圓形小體,并被細胞膜所包繞,即凋亡小體。凋亡率計算方法:在200×視野下隨機找5個視野觀測,每個視野計數200個細胞,以計算平均凋亡細胞數所占百分比作為細胞凋亡率,實驗重復5次,取平均值。
1.5 各組細胞NF-κB p65、總蛋白cyclin D1、cleaved-caspse 3蛋白檢測 采用Western blotting法。取給藥48 h對數生長期B組、對照組及空白組細胞,4 ℃預冷PBS洗滌3次,使用裂解液裂解細胞,1 500 r/min離心15 min,采用BCA法提取細胞總蛋白,所有操作均嚴格按照使用說明書進行。以3∶1體積比與上樣緩沖液混合,取20μL蛋白樣品上樣。濃縮膠電泳電壓為80 V,分離膠為130 V,電泳4 h后用PVDF膜半干轉,轉膜1.5 h。然后PVDF膜用含5%脫脂奶粉的PBS液封閉1 h,H3、NF-κB p65、,CyclinD1、β-actin和cleaved-caspase 3抗體用5%牛奶稀釋(1∶1 000)后,4 ℃過夜,TBST洗膜,5%的牛奶稀釋的辣根過氧化物酶標記的兔抗羊二抗,洗膜,按照ECL說明書,1∶1配置發光工作液,超敏化學發光法顯色,凝膠分析系統分析記錄條帶光密度。用Image J軟件進行分析,以相應目的蛋白條帶的積分光密度值與β-actin或H3的比值表示檢測蛋白的相對表達量。實驗重復3次,取平均值。
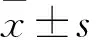
2 結果
2.1 各組細胞增殖抑制率比較 不同給藥時間各組細胞增殖抑制率比較見表1。
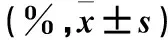
表1 不同給藥時間各組細胞增殖抑制率比較
注:與空白組比較,#P<0.05;與對照組比較,*P<0.05;與A組比較,&P<0.05;與前一給藥時間比較,△P<0.05。
2.2 各組細胞凋亡率比較 不同給藥時間各組細胞凋亡率比較見表2。
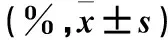
表2 不同給藥時間各組細胞凋亡率比較
注:與空白組比較,#P<0.05;與對照組比較,*P<0.05;與A組比較,&P<0.05;與前一給藥時間比較,△P<0.05。
2.3 各組細胞NF-κB p65、cleaved-caspase 3及Cyclin D1蛋白相對表達量比較 前期實驗證實高劑量TAK-242對SKOV-3細胞增殖、凋亡的影響更明顯,僅用B組細胞進行機制探討。各組細胞p65、cleaved-caspase 3及cyclin D1蛋白相對表達量比較見表3。
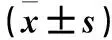
表3 給藥48 h時各組細胞NF-κB p65、cleaved-caspase 3及cyclin D1蛋白相對表達量比較
注:與空白組比較,#P<0.05;與對照組比較,*P<0.05。
3 討論
TLR4屬于一型跨膜蛋白[10],在結構上由胞外區、跨膜區和胞內區三部分組成。隨著研究的深入,發現TLR4在促進細胞因子的合成與釋放,引發炎癥反應;促進免疫細胞膜表面表達相關免疫分子,促進免疫細胞的成熟和功能化;抗病毒感染;調節免疫應答;介導全身免疫病理損傷,以及其家族間的協同作用影響免疫應答等方面起到重要的作用。TLR4信號通路的傳導主要包括髓樣分化因子(MyD88)非依賴性和MyD88依賴性兩條信號通路,前者不依賴于MyD88蛋白的激活作用,主要通過IRF-3來延遲性激活NF-κB的活性;后者主要通過MyD88的激活,從而快速的上調NF-κB的活性。NF-κB是卵巢癌發病機制中的重要參與者,抑制NF-κB的活性可以抑制卵巢癌細胞的增殖和促進其凋亡[11]。在正常條件下,NF-κB主要通過與其抑制性亞單位IκBα結合存在于胞漿中,當TLR4介導的信號通路傳導至IκBα時,可以使IκBα發生泛素化降解,脫離IκBα束縛的NF-κB p65從胞漿中轉位至胞核內,并與特異的靶基因序列結合,從而調控下游相關目的基因cyclin D1和cleaved-caspase 3蛋白的表達[11]。在以往研究中發現,TLR4在卵巢癌腫瘤標本中的表達明顯升高,并與卵巢癌患者的病情進展存在顯著相關性[13],使用抑制TLR4表達的藥物可以顯著抑制NF-κB的活性,從而抑制卵巢癌細胞的增殖和促進凋亡,提示TLR4有可能成為卵巢癌治療的重要靶點。TAK-242是TLR4的特異性抑制劑[14],目前證實其在體外細胞培養實驗中具有抗腫瘤作用,但是對于其在卵巢癌細胞增殖和凋亡中的作用目前相關報道卻不多。
本研究結果表明,給藥24、48、72 h時,A、B組細胞增殖抑制率、凋亡率均高于對照組、空白組;給藥24、48、72 h時, B組細胞增殖抑制率均高于A組;隨給藥時間增加,B組細胞增值抑制率、凋亡率升高。說明TAK-242可抑制卵巢癌細胞的增殖、促進細胞凋亡,并呈現劑量依賴性。在后續研究中,本研究對其機制進行了進一步探討,研究結果表明,TAK-242可以顯著抑制核內轉錄因子p65蛋白的表達水平。caspase 3是卵巢癌發生細胞凋亡過程中的關鍵性調節蛋白[12],caspase 3蛋白的表達受NF-κB的調節[13],其主要通過裂解后的cleaved-caspase 3成熟體發揮作用,因此本研究進一步探討了TAK-242對于cleaved-caspase 3蛋白表達的影響,結果表明,TAK-242可以顯著增加cleaved-caspase 3蛋白的表達水平,這可能是其發揮促凋亡的機制之一。Cyclin D1是卵巢癌細胞增殖的關鍵調節蛋白[14],其表達同樣受NF-κB的調節[15]。因此,本研究探討了TAK-242對cyclin D1蛋白表達的影響,結果表明,TAK-242可以顯著抑制cyclin D1蛋白的表達,提示這可能是TAK-242抑制卵巢癌細胞增殖的機制之一。
綜上所述,TAK-242可抑制人卵巢癌細胞的增殖、促進細胞凋亡,其機制可能為抑制NF-κB信號通路。但本研究僅為體外細胞培養實驗,未來需在動物實驗中進一步去驗證TAK-242對人卵巢癌細胞增殖、凋亡的影響。
[1] 邵婷, 陳秀瑋. 卵巢癌的病因假說及危險因素和流行病學研究進展[J]. 中華臨床醫師雜志(電子版), 2013,4(19):8894-8897.
[2] 錢冰, 王金華. 125例上皮性卵巢癌的預后分析[J]. 中國腫瘤外科雜志, 2013,5(6):362-365.
[3] Nezhat FR, Apostol R, Nezhat C, et al. New insights in the pathophysiology of ovarian cancer and implications for screening and prevention[J]. Am J Obstet Gynecol, 2015,213(3):262-267.
[4] Baek MH, Lee SW, Park JY, et al. Preoperative Predictive Factors for Complete Cytoreduction and Survival Outcome in Epithelial Ovarian, Tubal, and Peritoneal Cancer After Neoadjuvant Chemotherapy[J]. Int J Gynecol Cancer, 2017, 23(3):22-27
[5] Grunewald T, Ledermann JA. Targeted Therapies for Ovarian Cancer[J]. Best Pract Res Clin Obstet Gynaecol, 2016,14(6):61-70
[6] Mousavi A, Karimi-Zarchi M, Behtash N, et al. The Role of Intraperitoneal Carboplatin as Consalidation Chemotherapy in Women with Ovarian Carcinoma: Report of Our Experience and Systematic Review[J]. Int J Biomed Sci, 2016,12(4):120-124.
[7] 鄭麗華, 程忠平. TLR4及其在卵巢癌細胞增殖調控中的研究進展[J]. 中國婦幼健康研究, 2014,25(1):168-171.
[8] Huang JM, Zhang GN, Shi Y, et al. Atractylenolide-I sensitizes human ovarian cancer cells to paclitaxel by blocking activation of TLR4/MyD88-dependent pathway[J]. Sci Rep, 2014,11(4):12-17.
[9] Matsunaga N, Tsuchimori N, Matsumoto T, et al. TAK-242 (resatorvid), a small-molecule inhibitor of Toll-like receptor (TLR) 4 signaling, binds selectively to TLR4 and interferes with interactions between TLR4 and its adaptor molecules[J]. Mol Pharmacol, 2011,79(1):34-41.
[10] Gomez R, Villalvilla A, Largo R, et al. TLR4 signalling in osteoarthritis-finding targets for candidate DMOADs [J]. Nat Rev Rheumatol, 2014,29(6):68-77.
[11] Gambhir S, Vyas D, Hollis M, et al. Nuclear factor kappa B role in inflammation associated gastrointestinal malignancies[J]. World J Gastroenterol, 2015,21(11):3174-3183.
[12] Zhang Y, Peng W, Ao X, et al. TAK-242, a Toll-Like Receptor 4 Antagonist, Protects against Aldosterone-Induced Cardiac and Renal Injury[J]. PLoS One, 2015,10(11): 142456-142461.
[13] Ptak A, Rak-Mardyla A, Gregoraszczuk EL. Cooperation of bisphenol A and leptin in inhibition of caspase-3 expression and activity in OVCAR-3 ovarian cancer cells[J]. Toxicol In Vitro, 2013,27(6):1937-1943.
[14] Catanzaro D, Ragazzi E, Vianello C, et al. Effect of Quercetin on Cell Cycle and Cyclin Expression in Ovarian Carcinoma and Osteosarcoma Cell Lines[J]. Nat Prod Commun, 2015,10(8):1365-1368.
[15] Zhang H, Zhang X, Ji S, et al. Sohlh2 inhibits ovarian cancer cell proliferation by upregulation of p21 and downregulation of cyclin D1[J]. Carcinogenesis, 2014,35(8):1863-1871.
劉玉華(E-mail: weiweijudy@163.com)
10.3969/j.issn.1002-266X.2017.19.010
R737.31
A
1002-266X(2017)19-0037-03
2016-10-24)

