長鏈非編碼RNA CCAT1對人宮頸癌細胞株HeLa增殖的影響及其機制
周白云,郭永利,王卓,王文琴
(黔西南州人民醫院,貴州黔西南州562400)
·基礎研究·
長鏈非編碼RNA CCAT1對人宮頸癌細胞株HeLa增殖的影響及其機制
周白云,郭永利,王卓,王文琴
(黔西南州人民醫院,貴州黔西南州562400)
目的 觀察長鏈非編碼RNA (LncRNA)CCAT1對宮頸癌細胞株HeLa增殖的影響,并探討其可能作用機制。方法 ①過表達、抑制CCAT1表達對HeLa增殖的影響:取對數生長期HeLa細胞分為1、2、3、4組,分別轉染pcDNA3.1- CCAT1過表達慢病毒、pcDNA3.1對照慢病毒、siRNA、CCAT1-siRNA,別于轉染0、24、48 h時采用 CCK8法觀察各組細胞增殖情況。②HeLa細胞CCAT1互補microRNA分子分析:采用核質分離實驗分析CCAT1的細胞定位,網站預測并分析與CCAT1互補配對的microRNA分子。③LncRNA CCAT1靶向microRNA分子分析:取HeLa細胞分為A、B、C組,分別轉染亂序無意義序列、CCAT1-siRNA、pcDNA3.1- CCAT1過表達的慢病毒。轉染48 h采用熒光定量PCR方法檢測各組細胞miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543 。④細胞RASSF1A 、cyclin D1 mRNA檢測:取HeLa細胞,分為甲、乙、丙、丁、戊組,分別轉染亂序無意義序列、CCAT1-siRNA、CCAT1-siRNA+ miR-181a-5p inhibitor(miR-181a-5p抑制劑)、pcDNA3.1- CCAT1過表達的慢病毒、pcDNA3.1- CCAT1過表達的慢病毒+ miR-181a-5p mimic(miR-181a-5p類似物)。轉染48 h采用熒光定量PCR法檢測各組細胞RASSF1A 、cyclin D1 的RNA表達。結果 轉染24、48 h時,1組細胞增殖OD值小于2組,3組細胞增殖OD值高于4組(P均<0.05)。與CCAT1互補的前6位microRNA分別為miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543。轉染48 h時B組miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p相對表達量均高于A、C組,C組miR-181a-5p、miR-181b-5p、miR-4295相對表達量均低于A組(P均<0.05)。轉染48 h時,乙組RASSF1A相對表達量低于、cyclin D1 mRNA相對表達量高于甲組,丁組RASSF1A相對表達量高于、cyclin D1 mRNA相對表達量低于甲組(P均<0.05);丙、丁、戊組RASSF1A相對表達量高于、cyclin D1 mRNA相對表達量低于乙組(P均<0.05);丁組RASSF1A相對表達量高于、cyclin D1 mRNA相對表達量低于丙組(P均<0.05);戊組RASSF1A相對表達量低于、cyclin D1 mRNA相對表達量高于丁組(P均<0.05)。結論 CCAT1可抑制HeLa細胞的增殖。其機制可能為CCAT1上調RASSF1A表達、抑制cyclin D1轉錄。CCAT1通過與miR-181a-5p互補配對調控RASSF1A、cyclin D1的表達。
宮頸腫瘤;宮頸癌;長鏈非編碼RNA;長鏈非編碼RNA CCAT1
宮頸癌是常見的婦科生殖道腫瘤之一,HPV持續感染被認為是宮頸癌的主要危險因素[1,2]。隨著宮頸癌篩查技術的進步及普及,全球宮頸癌病死率持續下降,但發展中國家的病死率仍位居女性癌癥病死率首位[3]。宮頸癌發病的具體機制尚不清楚,手術及放化療是其常用的治療方法,但效果均不佳。個體化治療是一種新興的腫瘤治療方法,使腫瘤基因、治療靶點成為目前的研究熱點。非編碼基因[4,5]主要分為microRNA、piRNA、tRNA、長鏈非編碼RNA(LncRNA)等[6,7]。目前關于宮頸癌相關的microRNA相關研究較多[8~10],但關于LncRNA在宮頸癌中的相關報道較少。CCAT1是一種LncRNA,位于8號染色體8q24.21區,且在物種間具有較好的保守性,該區域具有眾多的染色體變異位點,并與前列腺癌[11~14]、結腸癌、淋巴系統腫瘤的發生發展有關。我們前期研究發現,宮頸癌組織中CCAT1低表達,但其在宮頸癌發生發展中的具體作用機制尚不明確。我們觀察了CCAT1對宮頸癌HeLa細胞增殖的影響,并探討其可能作用機制。現將結果報告如下。
1 材料與方法
1.1 細胞、試劑及儀器 人宮頸癌HeLa細胞株購自上海中科院生化細胞所細胞庫,培養基為DMEM basic 培養基+10%胎牛血清+雙抗,pcDNA3.1- CCAT1過表達慢病毒的啟動子采用CMV,由澤恒生物技術有限公司構建,CCAT1-siRNA由廣州銳博生物技術有限公司合成。 siRNA瞬時轉染均采用Invitrogen公司的Lipofectamine3000包裹。細胞CO2培養箱購Forma Scientific,熒光定量PCR的熒光染料采用TAKAT SYBR Green,熒光定量PCR儀采用Bio-Rad公司CFX96。Ki67抗體(abcam公司ab15580),CCK8試劑盒(日本同仁公司JE603),CCK8檢測酶標儀采(Bio-Rad公司Model 550),核質分離試劑盒(碧云天核蛋白提取試劑盒P0028),RNA提取采用TaKaRa公司TRIzol試劑,逆轉錄試劑盒購自TaKaRa公司,引物由上海生工生物技術有限公司合成。microRNA、inhibitor由廣州銳博公司合成。
1.2 CCAT1對HeLa細胞增殖的影響
1.2.1 促進CCAT1表達對HeLa細胞增殖的影響觀察 取對數生長期HeLa細胞株分為1、2組,培養至細胞密度約70%時換為無血清培養基饑餓2 h, 1、2組分別轉染pcDNA3.1- CCAT1過表達慢病毒、pcDNA3.1空載體慢病毒。將轉染后細胞置于5% CO2、37 ℃培養箱中培養。分別于轉染0、24、48 h時采用 CCK8法檢測兩組細胞增殖情況,采用熒光酶標儀檢測450 nm處光密度(OD)值。
1.2.2 抑制CCAT1表達對HeLa細胞增殖的影響觀察 取對數生長期HeLa細胞株分為3、4組,培養至細胞密度約70%時換為無血清培養基饑餓2 h, 3、4組分別轉染CCAT1-siRNA、siRNA對照亂序。將轉染后細胞置于5% CO2、37 ℃培養箱中培養。分別于轉染0、24、48 h時采用 CCK8法檢測兩組細胞增殖情況,采用熒光酶標儀檢測450 nm處光密度(OD)值。
1.3 HeLa細胞CCAT1互補microRNA分子分析 采用核質分離實驗[15]分析CCAT1的細胞定位,所有操作均嚴格按照使用說明書進行。采用starbase V2.0(http://starbase.sysu.edu.cn/)網站分析與CCAT1互補配對的microRNA分子。
1.4 LncRNA CCAT1靶向microRNA分子分析 取對數生長期HeLa細胞,分為A、B、C組,每組5個復孔。A組為空白對照組,轉染亂序無意義序列,B組轉染CCAT1-siRNA,C組轉染pcDNA3.1- CCAT1過表達的慢病毒。轉染48 h采用熒光定量PCR方法檢測各組細胞miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543 表達(“1.3”中與CCAT1互補配對的microRNA前6位),所有操作均嚴格按照使用說明書進行。
1.5 各組細胞的RASSF1A 、cyclin D1 的mRNA表達檢測 補救實驗證實CCAT1與miR-181a-5p存在互補配對結合,既往研究證實miR-181a-5p可通過靶向抑癌基因RASSF1A從而發揮促進腫瘤細胞增殖[16]。取對數生長期HeLa細胞,分為甲、乙、丙、丁、戊組,每組5個復孔。甲組為空白對照組,轉染亂序無意義序列,乙組采用Lipofectamine 3000TM包裹CCAT1-siRNA轉染,丙組轉染CCAT1-siRNA+ miR-181a-5p inhibitor(miR-181a-5p抑制劑),丁組轉染pcDNA3.1- CCAT1過表達的慢病毒,戊組轉染pcDNA3.1- CCAT1過表達的慢病毒+ miR-181a-5p mimic(miR-181a-5p類似物)。轉染48 h采用熒光定量PCR法檢測各組RASSF1A 、cyclin D1 的mRNA表達,所有操作均嚴格按照使用說明書進行。用2-ΔΔCt表示目的基因的相對表達量。以GAPDH為內參,RASSF1A上游引物5′-GACCTCTGTGGCGACTTCAT-3′;下游引物5′-CTCCACAGGCTCGTCGC-3′;cyclin D1上游引物5′-TGAGGGACGCTTTGTCTGTC-3′;下游引物5′-GCCTTTGGCCTCTCGATACA-3′; GAPDH上游引物5′-AATGGGCAGCCGTTAGGAAA-3′;下游引物5′-GCGCCCAATACGACCAAATC-3′。20 μL體系進行反轉錄,反應條件為:37 ℃、30 min,85 ℃、5 s,4 ℃。PCR體系為:10 μL SYBR染液,上下游引物各0.8 μL,模板1 μL,其余采用DEPC水補齊。反應條件:92 ℃、3 min預變性,92 ℃、30 s,58 ℃、15 s,39個循環,72 ℃、1 min,4 ℃。
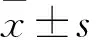
2 結果
2.1 各組細胞增殖情況比較 轉染0、24、48 h各組細胞增殖情況比較見表1。
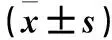
表1 轉染0、24、48 h各組細胞OD值比較
注:與2組比較,*P<0.05;與4組比較,#P<0.05。
2.2 HeLa細胞CCAT1細胞定位及互補microRNA分子分析 核質分離實驗提示 約70%CCAT1位于細胞質中,30%位于細胞核中,主要定位于細胞質中。互補microRNA分子分析結果見表2。與CCAT1互補的前6位microRNA分別為miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543。

表2 與CCAT1互補的microRNA分子分析結果
2.3 各組細胞miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543相對表達量比較 各組細胞miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543相對表達量比較見表3。
2.4 各組細胞RASSF1A 、cyclin D1 mRNA相對表達量比較 各組細胞RASSF1A 、cyclin D1 mRNA相對表達量比較,見表4。
3 討論
非編碼RNA是一大類轉錄產物不翻譯成蛋白質的核酸分子,主要包括tRNA、piRNA、microRNA、LncRNA等。其中microRNA的研究相對較多,其發揮作用的主要方式是負性調控,LncRNA是一類長度超過200 bp的轉錄本,具有來源豐富、組織特異性好、部分序列保守等特點[17]。相較于micorRNA,LncRNA的作用方式更為復雜,具有順勢(cis)調控作用和反式調控(trans)等多種調控方式,其既能位于細胞核中,也能分布于細胞質內;既可以促進轉錄,也可以抑制轉錄;既能通過分子支架作用結合蛋白質,也能通過海綿作用吸附microRNA分子[11~13]。既可以修飾蛋白質,也可以影響mRNA的成熟和穩定;既可以結合核酸,也可以結合蛋白。例如HotAir可以與PRC2復合體互作,影響組蛋白H3K27表觀遺傳學改變[18],在肝癌、食管癌、乳腺癌、胰腺癌等疾病中發揮關鍵作用;Xist同樣也可以通過募集PRC2復合體,介導X染色體失活[19];而H19則可以作為分子篩發揮“海綿作用”吸附microRNA分子,最終影響對應microRNA的靶mRNA分子[20]。然而,宮頸癌相關的LncRNA研究,卻知之甚少。
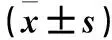
表3 各組細胞miR-181a-5p、miR-181b-5p、miR-4295、miR-130a-5p、miR-148b-3p、miR-543相對表達量比較
注:與A組比較,*P<0.05;與C組比較,#P<0.05。
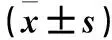
表4 各組細胞RASSF1A 、cyclin D1 mRNA相對表達量比較
注:與甲組比較,*P<0.05;與乙組比較,#P<0.05,與丙組比較,△P<0.05;與丁組比較,##P<0.05。
本研究發現CCAT1抑制人HeLa細胞增殖,其發揮作用可能是通過與miR-181a-5p互補配對,抑制miR-181a-5p表達從而上調miR-181a-5p靶分子RASSF1A表達,進而抑制cyclin D1轉錄,最終抑制HeLa細胞增殖。為研究CCAT1在宮頸癌中的是否具有作用,我們首先在HeLa細胞針對CCAT1進行了敲降,發現HeLa細胞的增殖能力顯著上調,而過表達CCAT1將抑制HeLa細胞增殖。核質分離實驗證實,CCAT1主要定位于細胞質中,而hotair、NEAT1主要位于細胞核中,這提示CCAT1可能與某些microRNA分子具有互補配對結合的可能,由此我們通過starbase V2.0網站分析發現,CCAT1與miR-181b-5p、miR-181a-5p、miR-4295、miR-130a-3p、miR-148b-3p等microRNA分子具有序列互補配對,提示存在結合的可能。進一步研究發現,敲降CCAT1后,miR-181b-5p、miR-181a-5p、miR-4295、miR-130a-3p表達均上調,而過表達CCAT1則抑制miR-181b-5p、miR-181a-5p、miR-4295、miR-130a-3p的表達,也即CCAT1與以上microRNA分子具有趨勢相反的表達。其中miR-181b-5p的變化最為顯著,遠超于其余三個microRNA分子,這提示CCAT1可能主要通過影響miR-181b-5p的分子功能,發揮抑癌作用。序列互補分析提示CCAT1與miR-181b-5p具有13個堿基的互補配對,強烈提示存在直接結合的可能。既往研究表明,miR-181b-5p可以通過與抑癌基因RASSF1A的mRNA 3′UTR結合[16],下調其mRNA表達水平,反之促進RASSF1A下游基因周期蛋白cyclin D1轉錄,加速細胞增殖。為研究CCAT1是否通過miR-181b-5p發揮抑癌基因作用,我們通過補救實驗驗證猜想。結果提示:敲降CCAT1導致的RASSF1A下調和cyclin D1上調,在給予miR-181a-5p inhibitor后,均可得到逆轉;而過表達CCAT1導致的RASSF1A上調和cyclin D1下調,在給予miR-181a-5p mimic后,同樣得到了逆轉。
綜上所述,CCAT1可抑制HeLa細胞的增殖。其機制可能為CCAT1上調RASSF1A表達、抑制cyclin D1轉錄。CCAT1通過與miR-181a-5p互補配對調控RASSF1A、cyclin D1的表達。
[1] Hammer A, Rositch A. Age-specific prevalence of HPV16/18 genotypes in cervical cancer: A systematic review and meta-analysis [J]. Int J Cancer, 2016,138(12):2795-2803.
[2] 張珊,洪穎,馬莉,等.宮頸細胞學陰性HPV陽性婦女的HPV分型檢測[J].山東醫藥,2015,55(43) : 5-7.
[3] Duval M. A systematic study on dysregulated microRNAs in cervical cancer development[J].Int J Cancer, 2016,138(6):1312-1327.
[4] Sullenger BA, Nair S. From the RNA world to the clinic[J].Science, 2016,352(6292):1417-1420.
[5] Zhang C, Gao L, Xu EY. LncRNA, a new component of expanding RNA-protein regulatory network important for animal sperm development[J]. Semin Cell Dev Biol, 2016,(16)30175-30176.
[6] Stuwe E, Tóth KF, Aravin AA. Small but sturdy: small RNAs in cellular memory and epigenetics[J]. Genes Dev, 2014,28(5):423-431.
[7] Chen LL. Linking Long Noncoding RNA Localization and Function[J]. Trends Biochem Sci, 2016,41(9):761-772.
[8] Ferrari D, Bianchi N. MicroRNAs Modulate the Purinergic Signaling Network[J]. Trends Mol Med, 2016,22(10):905-918.
[9] Piletia K, Kunej T. MicroRNA epigenetic signatures in human disease[J]. Arch Toxicol, 2016,90(10): 2405-2419.
[10] Logan M, Hawkins SM. Role of microRNAs in cancers of the female reproductive tract: insights from recent clinical and experimental discovery studies[J].Clin Sci (Lond), 2015,128(3):153-180.
[11] Xu S, Wang H. ANRIL lncRNA triggers efficient therapeutic efficacy by reprogramming the aberrant INK4-hub in melanoma[J]. Cancer Lett, 2016,381(1):41-48.
[12] Thomson DW, Dinger ME. Endogenous microRNA sponges: evidence and controversy[J].Nat Rev Genet, 2016,17(5):272-283.
[13] Sauvaget C, Nishino Y, Konno R, et al. Challenges in breast and cervical cancer control in Japan[J].Lancet Oncol, 2016,17(7): 305-312.
[14] Mizrahi I, Mazeh H. Colon Cancer Associated Transcript-1 (CCAT1) Expression in Adenocarcinoma of the Stomach[J].J Cancer, 2015,6(2):105-110.
[15] Yuan JH, Yang F. A long noncoding RNA activated by TGF-β promotes the invasion-metastasis cascade in hepatocellular carcinoma[J].Cancer Cell, 2014,25(5):666-681.
[16] Briuer-Hartmann D, Hartmann JU. PML/RARα-Regulated miR-181a/b Cluster Targets the Tumor Suppressor RASSF1A in Acute PromyelocyticLeukemia[J].Cancer Res,2015,75(16):3411-3424.
[17] Quinn JJ, Chang HY. Unique features of long non-coding RNA biogenesis and function[J].Nat Rev Genet, 2016,17(1):47-62.
[18] Li L, Liu B. Targeted disruption of Hotair leads to homeotic transformation and gene derepression[J].Cell Rep, 2013,5(1):3-12.
[19] Sarma K, Cifuentes-Rojas C. ATRX directs binding of PRC2 to Xist RNA and Polycombtargets[J].Cell, 2014,159(4):869-883.
[20] Kallen AN, Zhou XB. The imprinted H19 lncRNA antagonizes let-7 microRNAs[J].Mol Cell,2013,52(1):101-112.
·作者·編者·讀者·
文后參考文獻的著錄方法
按GB/T7714-2005《文后參考文獻著錄規劃》采用順序編碼制著錄,依照其在文中出現的先后順序用阿拉伯數字加方括號標出。參考文獻中的作者1~3名全部列出,3名以上只列前3名,后加“,等”或其他與之相應的文字。外文期刊名稱用縮寫,以《Index Medicus》中的格式為準;中文期刊用全名。論文題目后加文獻類型及標識,如專著[M]、期刊文章[J]等。每條參考文獻均須著錄起止頁。作者必須認真核對參考文獻原文,無誤后將其按引用順序(用阿拉伯數字)排列于文末。
10.3969/j.issn.1002-266X.2017.19.009
R737.33
A
1002-266X(2017)19-0033-04
2016-10-26)

