FMNL2基因小干擾RNA 質粒轉染人宮頸癌Hela、Siha細胞株Vimentin及E-cadherin的表達觀察
陶明珠,張強,周鐵軍,楊成萬
(西南醫科大學附屬醫院,四川瀘州 646000)
FMNL2基因小干擾RNA 質粒轉染人宮頸癌Hela、Siha細胞株Vimentin及E-cadherin的表達觀察
陶明珠,張強,周鐵軍,楊成萬
(西南醫科大學附屬醫院,四川瀘州 646000)
目的 觀察同源形成素樣蛋白2(FMNL2)基因小干擾RNA 質粒轉染人宮頸腺癌細胞株Hela、鱗癌細胞株Siha波形蛋白(Vimentin)及鈣黏附蛋白E(E-cadherin)的表達的影響。方法 分別取Hela、Siha細胞各分為實驗組、對照組,實驗組中加入含有2 mL Lipofectamine 2000TM包裹的FMNL2-siRNA (100 nmol/L)的無血清培養基,對照組加2 mL的無血清培養基。采用RT-PCR法檢測轉染72 h時各組FMNL2、波形蛋白(Vimentin)及鈣黏附蛋白E(E-cadherin) mRNA,采用細胞免疫化學染色法檢測轉染72 h時各組FMNL2、Vimentin及E-cadherin 蛋白。結果 轉染72 h時Hela、Siha細胞實驗組FMNL2 mRNA及蛋白的相對表達量均低于對照組,轉染72 h時Hela、Siha細胞實驗組Vimentin mRNA及蛋白的相對表達量均低于對照組,轉染72 h時Hela、Siha細胞實驗組 E-cadherin mRNA及蛋白的相對表達量mRNA相對表量均高于對照組(P均<0.05)。結論 FMNL2基因小干擾RNA 質粒轉染可抑制Hela、Siha細胞Vimentin 表達,促進 E-cadherin表達。 FMNL2可能參與了宮頸癌EMT。
宮頸腫瘤;宮頸癌;宮頸鱗癌;宮頸腺癌;同源形成素樣蛋白;上皮間質轉化
宮頸癌是女性最常見的惡性腫瘤之一,組織學類型主要有鱗癌和腺癌,其侵襲和轉移是影響患者預后的主要因素[1]。研究表明,在腫瘤侵襲和轉移初始過程中,腫瘤上皮細胞可發生上皮間質轉化(EMT),抑制或逆轉EMT可抑制腫瘤的侵襲和轉移,EMT可增加腫瘤細胞的轉移能力[2,3]。波形蛋白(Vimentin)、鈣黏附蛋白E(E-cadherin)是EMT重要的相關蛋白。同源形成素樣蛋白2(FMNL2)是一種新近發現的一種轉移相關基因,位于2q23.3[4]。研究[5]發現,FMNL2可能通過EMT促進結直腸癌的浸潤和轉移。FMNL2在宮頸鱗癌組織中高表達,并且與淋巴結轉移情況有關[6],但FMNL2是否介導宮頸癌EMT的相關報道較少。我們觀察了FMNL2基因小干擾RNA 質粒轉染人宮頸腺癌細胞株Hela、鱗癌細胞株Siha Vimentin及E-cadherin表達的影響,現將結果報告如下。
1 材料與方法
1.1 細胞、試劑及儀器 人宮頸腺癌Hela細胞株由西南醫科大學附屬醫院中心實驗室惠贈,人宮頸鱗癌Siha細胞株購自南方醫科大學病理學實驗室。FMNL2抗體購自Chemcruz公司,E-cadherin、Vimentin抗體購自基因科技上海有限公司,Envision兩步法試劑盒、DAB試劑盒、細胞打孔液Trion X-100購自中杉金橋公司。DMEM高糖型培養液購自賽默飛世爾生物化學制品(北京)有限公司,胎牛血清(FBS)購自深圳賽泰克生物科技有限公司,二甲基亞砜(DMSO)購自美國Sigma公司,胰蛋白酶、磷酸鹽緩沖液(PBS)購自上海生化公司。FMNL2-siRNA(可抑制FMNL2表達)轉染試劑購自廣州銳博生物科技有限公司;Lipofectamine 2000 Reagent購自lifetechnologies公司。總RNA提取試劑盒、DNA Marker、2×Taq PCR MasterMix購自北京天根科技有限公司,RT試劑盒購自成都博瑞克生物技術有限公司,PCR引物購自生工生物工程有限公司。CO2細胞電熱恒溫培養箱(HEPA class100型)購自美國Thermo公司,倒置相差顯微鏡(TS100-F100型)購自德國Leica公司,PCR擴增儀(TC-512型)購自英國Techne公司,凝膠掃描成像儀購自美國Bio-rad公司。
1.2 Hela、Siha細胞培養與FMNL2-siRNA轉染方法 分別取Hela、Siha細胞,置于含10%FBS的DMEM培養基,37 ℃、飽和濕度、5% CO2恒溫培養箱中培養。待細胞約80%融合時,0.25%胰蛋白酶消化,傳代3次后備用。收集對數生長期的Hela、Siha細胞各分為實驗組、對照組,1×105/mL 接種于6孔板中,每組3個復孔,37 ℃、飽和濕度、5% CO2培養箱中培養;待細胞融合達35%~50%時,吸棄上清液。向實驗組中加入含有2 mL Lipofectamine 2000包裹的FMNL2-siRNA (100 nmol/L)的無血清培養基,對照組加2 mL的無血清培養基,培養72 h后備用。
1.3 各組FMNL2、Vimentin及E-cadherin mRNA檢測 采用RT-PCR法。轉染72 h,取對數生長期的各組細胞,常規TRIzol法提取總RNA,所有操作均嚴格按照總RNA提取試劑盒操作步驟于無菌條件下完成。配制逆轉錄反應體系,進行逆轉錄反應,將所得逆轉錄反應原液置于-20 ℃中保存;按PCR試劑盒說明書配制PCR擴增反應體系,進行PCR擴增反應,檢測各組細胞FMNL2、Vimentin及E-cadherin mRNA,對PCR擴增反應產物進行瓊脂糖凝膠電泳,應用凝膠掃描成像系統檢測電泳結果,以GADPH為內參,將目的基因與內參吸光值相比得到目的基因的相對表達量。GAPDH上游引物5′-ACCACAGTCCATGCCATCAC -3′;下游引物5′-TCCACCACCCTGTTGCTGTA -3′,序列長度450 bp。FMNL2上游引物5′-TGGATTCGCAGCGAG-3′;下游引物5′-CAGGAGGTAGGTTCATAG-3′,序列長度120 bp。Vimentin上游引物5′-CGCTTCGCCAACACAT-3′;下游引物5′-AGGGCATCCACTTCACAG-3′,序列長度690 bp。E-cadherin上游引物5′-AAGCCTCAGGTC ATAAACATC-3′;下游引物5′-CGCCTCCTTCTTCATCATAG-3′,序列長度460 bp。反應條件:94 ℃、3min預變性,94℃、30 s變性,53 ℃、30 s退火,72 ℃、30 s延伸,30個循環;終末延伸,72 ℃,3 min;4 ℃保存備用。
1.4 各組FMNL2、Vimentin及E-cadherin 蛋白檢測 采用細胞免疫化學染色法。取轉染72 h時各組細胞,PBS緩沖液漂洗、室溫下4%多聚甲醛固定15 min。滴加一抗FMNL2(稀釋比例1∶50)、E-cadherin(稀釋比例1∶100)、Vimentin(稀釋比例1∶200),室溫孵育2 h,滴加A液,室溫孵育30 min,滴加現配好的二氨基聯苯胺(DAB),顯色,蘇木素復染,梯度酒精脫水,二甲苯透明,中性樹膠封片。用Image-pro plus6.0圖像分析軟件分析,對每張爬片隨機攝像5幀,檢測其陽性細胞的平均光密度值(IOD),取平均值。
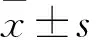
2 結果
2.1 各組FMNL2、Vimentin及E-cadherin mRNA相對表達量比較 轉染72 h時各組FMNL2、Vimentin及E-cadherin mRNA相對表達量比較見表1、圖1。
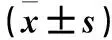
表1 轉染72 h時各組FMNL2、Vimentin及E-cadherin mRNA相對表達量比較
注:與同一細胞對照組比較,▲P<0.05;與Siha細胞對照組比較,#P<0.05。

圖1 轉染72 h時各組FMNL2、Vimentin及E-cadherin mRNA表達情況
2.2 各組FMNL2、Vimentin及E-cadherin 蛋白IOD值比較 轉染72 h時各組FMNL2、Vimentin及E-cadherin蛋白IOD值比較見表2、圖2、圖3。
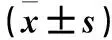
表2 轉染72 h時各組FMNL2、Vimentin及E-cadherin蛋白IOD值比較
注:與同一細胞對照組比較,▲P<0.05;與Siha細胞對照組比較,#P<0.05。

注:a1 對照組FMNL2表達情況;a1′ 實驗組FMNL2表達情況;b1對照組 Vimentin表達情況; b1′實驗組Vimentin表達情況;c1對照組 E-cadherin表達情況;c1′ 實驗組 E-cadherin表達情況。
圖2 Hela細胞FMNL2、Vimentin及E-cadherin蛋白表達情況(×400)

注:a1 對照組FMNL2表達情況;a2實驗組FMNL2表達情況;b1對照組 Vimentin表達情況; b2實驗組Vimentin表達情況;c1對照組 E-cadherin表達情況;c2實驗組 E-cadherin表達情況。
圖3 Siha 細胞FMNL2、Vimentin及E-cadherin蛋白表達情況(×400)
3 討論
EMT是一個極其復雜的過程,其特征是發生EMT的細胞上皮細胞特性逐漸消失,獲得間質細胞特性,并伴有免疫表型的改變。上皮細胞標志物如Ecadherin表達減少, 間質細胞標志物如Vimentin 表達增高,是上皮間質轉化的重要標志[7,8]。E-cadherin表達的下調或缺失是EMT的典型特征。 Vimentin即波形蛋白是一種中間絲蛋白,在上皮細胞中極少表達,是間質細胞一個重要的分子標記,其在上皮性腫瘤細胞表達陽性或增高就提示可能發生了EMT。EMT是腫瘤細胞獲得侵襲和轉移能力的最主要途徑[9,10]。本實驗發現Hela、Siha細胞均有Vimentin蛋白和mRNA的表達,且Hela細胞Vimentin蛋白和mRNA的相對表達量均高于E-cadherin蛋白和mRNA的相對表達量,同時也高于明顯高于Siha細胞的Vimentin蛋白和mRNA的相對表達量。說明Hela細胞和Siha細胞均存在EMT,且Hela細胞的EMT程度更高。
FMNL2屬于形成素同源蛋白家族,其主要功能為參與細胞骨架的構建及重塑,同時維持細胞的穩定結構和動態結構,與細胞分裂、變形等過程有關。其在惡性腫瘤中的研究較少,有研究表明FMNL2的表達與肝癌[11]、結直腸癌[12,13]、惡性黑色素瘤[14]、宮頸鱗癌[6]等的侵襲轉移及預后有關。且有研究證實FMNL2在結直腸癌組織中可能通過促進結直腸癌EMT的發生,增強其侵襲、轉移的能力[5],但其在宮頸癌的浸潤轉移機制中是否與EMT有關尚不清楚。
本研究發現,轉染72 h時Hela、Siha細胞實驗組FMNL2、VimentinmRNA相對表量均低于對照組,E-cadherin mRNA相對表達量高于對照組。轉染72 h時Hela、Siha細胞實驗組FMNL2、Vimentin蛋白的IOD值均低于對照組,E-cadherin 的IOD值高于對照組。說明沉默FMNL2基因可在mRNA、蛋白水平抑制Hela細胞和Siha細胞的EMT。因此,FMNL2沉默能夠抑制人子宮頸癌EMT的發生,從而發揮抑制子宮頸癌黏附、轉移的作用。由此推測,FMNL2可能有促進宮頸癌細胞EMT的作用,其可能通過促進子宮頸癌細胞EMT從而促進宮頸癌細胞的黏附、轉移。FMNL2對子宮頸癌細胞EMT影響機制,尤其是細胞傳導信號通路的研究還有待于進一步實驗驗證和分析。EMT的發生涉及多個信號轉導通路如TGF-β信號通路[15]、Wnt/β-catenin通路、Ras-MEK-MAPK通路、PI3K/Akt[16]、JAK/STAT3[17]通路等。FMNL2基因的編碼產物屬于DRFs家族成員,FMNL2是DRFs成員,序列里有GTP酶結合結構域和自身調節結構域,是Rho-GTP酶家族的下游效應因子,通過介導單細胞阿米巴樣運動調控細胞移動[18]。其可以與肌動蛋白結合蛋白、Rho GTPase相互作用,是Rho信號轉導通路、Scr酪氨酸激酶信號轉導通路以及Wnt信號轉導通路中的組成成分。FMNL2對子宮頸癌EMT的影響是否是通過上述轉導通路發揮作用尚待進一步研究。
綜上所述,FMNL2基因小干擾RNA 質粒轉染可抑制人宮頸癌Hela、Siha細胞Vimentin 表達,促進細胞E-cadherin表達。 FMNL2可能參與了宮頸癌EMT。
[1] Cheng Y, Zhou Y, Jiang W, et al. Significance of E-cadherin,β-catenin,and vimentin expression as postoperative prognosis indicators in cervica1 squamous cell carcinoma [J]. Hum Pathol, 2012,43(8):1213-1220.
[2] Ding XM. MicroRNAs:regulators of cancer metastasis and epithelial-mesenchymal transition (EMT)[J]. Chin J Cancer, 2014,33(3):140-147.
[3] Hazan RB, Phillips GR, Qiao RF,et al. Exogenous expression of Ncadherin in breast cancer cells induces cell migration invasion and metastasis[J]. J Cell Biol, 2000,148(4):779-790.
[4] Katoh M, Katoh M. Identification and characterization of human FMNL1,FMNL2 and FMNL3 genes in silico[J]. Int J Oncol, 2003,22(5):1161-1168.
[5] Li Y, Zhu X, Zeng Y, et al. FMNL2 enhances invasion of colorectal carcinoma by inducing epithelial mesenchymal transition[J]. Mol Cancer Res, 2010,8(12):1579-1590.
[6] 張強,楊成萬,周鐵軍,等. FMNL2在宮頸鱗癌組織中的表達及臨床意義[J].現代醫藥衛生,2014,30(21):3227-3228.
[7] Myong NH. Loss of E-cadherin and acquisition of vimentin in epithelial-mesenchymal transition are noble indicators of uterine cervix cancer progression [J]. Korean J Pathol, 2012,46(4):341-348.
[8] Liu Z,Sun B,Qi L, et al. Zinc finger E-box binding homeobox 1 promotes vasculogenic mimicry in colorectal cancer through induction of epithelial-to-mesenchymal transition [J]. Cancer Sci, 2012,103(4):813-820.
[9] Chen XF,Zhang HJ,Wang HB, et al.Transforming growth factor -β1 induces epithelial -to-mesenchymal transition in human lung cancer cells via PI3K/Akt and MEK/Erk1/2 signaling pathways[J]. Mol Biol Rep, 2012,39(4):3549-3556.
[10] Mu Y, Gudey SK, Landstrom M. Non-Smad signaling pathways[J]. Cell Tissue Res, 2012, 347(1): 11-20.
[11] Liang L, Guan J, Zeng Y,et al. Down-regulation of formin-like 2 predicts poor prognosis in hepatocellular carcinoma[J]. Hum Pathol, 2011,42(11): 1603-1612.
[12] 朱曦齡,梁莉,丁彥青.FMNL2在大腸癌細胞系中的表達及意義[J]. 南方醫科大學學報,2008,28(10):1775-1778.
[13] Li B,Xie Z,Li Z,et al. MicroRNA-613 targets FMNL2 and suppresses progression of colorectal cancer[J]. Am J Transl Res, 2016,8(12):5475-5484.
[14] Gardberg M,Heuser VD,Koskivuo I,et al. FMNL2/FMNL3 formins are linked with oncogenic pathways and predict melanoma outcome[J]. J Pathol Clin Res, 2016,2(1): 41- 52.
[15] Heldin CH, Vanlandewijck M, Moustakas A. Regulation of EMT by TGFβ in cancer[J]. FEBS Lett, 2012,586(14):1959-1970.
[16] Tsai JH, Hsu LS, Lin CL,et al.3,5,4′-Trimethoxystilbene, a natural methoxylated analog of resveratrol, inhibits breast cancer cell invasiveness by downregulation of PI3K/Akt and Wnt/β-catenin signaling cascades and reversal of epithelial mesenchymal transition[J]. Toxicol Appl Pharmacol, 2013,272(3):746-756.
[17] 湯軼,孫曉紅.二甲雙胍對宮頸癌Hela細胞Twist及E-cadherin表達的影響及機制[J].山東醫藥,2016,56(9):31-33.
[18] Kitzing TM, Wang Y, Pertz O, et al. Formin-like 2 drives amoeboid invasive cell motility downstream of RhoC[J]. Oncogene, 2010, 29(16):2441-2448.
Expression of Vimentin and E-cadherin in human cervical carcinoma cell lines Hela and Siha transfected by FMNL2 gene siRNA
TAOMingzhu,ZHANGQiang,ZHOUTiejun,YANGChengwan
(TheAffiliatedHospitalofSouthwestMedicalUniversity,Luzhou646000,China)
Objective To investigate the expression of Vimentin and E-cadherin in human cervical carcinoma cell lines Hela and Siha transfected with Formin-like protein 2(FMNL2)gene small interference RNA (siRNA). Methods Both Hela cells and Siha cells were divided into the experimental group and control group, respectively. Cells in the experimental group were treated with 2 mL serum-free culture medium containing 100 nmol/L FMNL2-siRNA encapsulated by Lipofectamine 2000TM. Cells in the control group were treated with 2 mL serum-free culture medium. We used RT-PCR to detect the expression of FMNL2, Vimentin and E-cadherin mRNA in each group 72 h after transfection. Cellular immunohistochemistry was applied to detect the expression of FMNL2, Vimentin and E-Cadherin proteins in each group 72 h after transfection. Results The relative expression of FMNL2 mRNA and protein in both Hela cells and Siha cells of the experimental group 72 h after transfection was lower than that in the control group, respectively (P<0.05). The relative expression of Vimentin mRNA and protein in both Hela cells and Siha cells of the experimental group 72 h after transfection was lower than that in the control group, respectively, whereas the expression of E-cadherin mRNA and protein was higher than that in the control group (allP<0.05).Conclusions FMNL2 gene small interference RNA transfection may inhibit the expression of Vimentin and promote the expression of E-cadherin in Hela cells and Siha cells. FMNL2 may participate in the epithelial-mesenchymal transition of human cervical cancer.
cervical neoplasms; cervical carcinoma; cervical squamous-cell carcinoma; uterine cervical adenocarcinoma; formin-like protein; epithelial-mesenchymal transition
四川省衛生廳科研基金資助項目(100243)。
陶明珠(1972-),女,本科,主管護師,主要研究方向為腫瘤基礎及護理。E-mail: ycwty163@163.com
楊成萬(1969-),男,碩士,教授,主要研究方向腫瘤病理。E-mail: ycwty@163.com。
10.3969/j.issn.1002-266X.2017.19.002
R737.3
A
1002-266X(2017)19-0005-04
2016-11-04)

