LncRNA在宮頸癌組織中的表達譜變化及意義
陳干濤 楊 瀟 程艷香
·基礎研究·
LncRNA在宮頸癌組織中的表達譜變化及意義
陳干濤 楊 瀟 程艷香
目的 研究宮頸癌組織中lncRNA的表達變化情況,為探討lncRNA參與宮頸癌發生與發展提供分子依據。方法 取20例宮頸癌患者的宮頸癌組織和20例正常宮頸組織,應用高通量lncRNA芯片技術分別檢測兩組中lncRNA表達譜的變化情況,并應用qRT-PCR技術對結果加以驗證。結果 與正常宮頸組織相比,宮頸癌組織中共有30586條lncRNA和13982條mRNA存在差異性表達,通過GO聚類分析表明,上調mRNA和下調mRNA分別參與多種不同的生物過程。通過進一步分析發現變化差異性最明顯的10個lncRNA可能通過影響相應的mRNA來發揮其生物學功能。qRT-PCR 結果與芯片檢測結果一致,提示4個lncRNA(BC008359,RP11-521B24.5,BRE-AS1,和RP11-229P13.15)在宮頸癌組織中發揮重要作用。結論 本實驗闡述了宮頸癌組織中lncRNA的變化情況,為探討lncRNA參與宮頸癌發生與發展以及治療提供新的分子依據。
宮頸癌組織;lncRNA;高通量lncRNA芯片技術
(ThePracticalJournalofCancer,2017,32:523~527)
宮頸癌(cervical cancer)是最常見的婦科惡性腫瘤之一,僅次于乳腺癌,且宮頸癌發病呈年輕化趨勢[1]。非編碼RNA(Non-coding RNAs)是指不翻譯為蛋白但是具調節作用的功能性RNA分子,包括siRNA、miRNA和長鏈非編碼RNA(lncRNA)。lncRNA是一類長度超過200nt的RNA[2]。近年來由于測序技術的廣泛應用,發現lncRNA通常存在于核內或細胞質中,廣泛參與個體發育和生命過程的調控,并與疾病的發生發展密切相關。研究發現疾病狀態下非編碼RNA的表達存在差異,提示未來可將非編碼RNA作為生物指標進行疾病診斷和預測[3-5],因此對其功能深入了解可作為腫瘤診斷和治療的檢測指標,且可迅速用于實際領域[3,6]。
本研究應用高通量lncRNA芯片技術檢測20例正常宮頸組織和20例宮頸癌組織中lncRNA表達譜的變異,篩選出差異表達的lncRNA,進行聚類分析,篩選出與宮頸癌相關的lncRNA,為進一步闡明宮頸癌的發病機制提供實驗依據,為臨床治療提供潛在的靶點。
1 材料與方法
1.1 標本收集
20例宮頸癌組織來自2015年1月至2015年6月在武漢市人民醫院進行手術的宮頸癌患者;20例正常宮頸組織來自其他婦科手術患者,均證實為正常子宮組織。標本采集均經過患者家屬簽署知情同意書并經本醫院倫理委員會審核通過。
1.2 材料
提取RNA的Trizol(Invitrogen公司);反轉錄試劑盒和SYBR-Green Real-time PCR Master Mix試劑盒(ABI公司);real-time PCR引物由TaKaRa公司設計并合成;Human lncRNA Microarrays V 3.0的芯片選擇、探針設計、圖像采集、數據分析等由上海康成生物公司完成。
1.3 芯片的選擇
利用Arraystar公司所開發出的12×135k的lncRNA芯片,其覆蓋目前NCBI Refseq、UCSC Known Gene、RNAdb,NRED等多個數據庫的lncRNA種類。
1.4 探針設計
Arraystar lncRNA芯片設計的探針為60 met的長寡核苷酸,這些探針在高嚴格雜交條件下能夠得到高靈敏度以及高特異性的理想實驗結果。并且,針對每條序列都設計多條探針,增加了信號的可靠度。
1.5 組織樣本總RNA的提取與檢測
按照Trizol(Invitrogen)說明書,分別取120 mg的組織樣本,按照試劑說明,分別從正常組織和宮頸癌組織抽提總RNA。通過紫外分光光度計測定吸光度值260、280、230 nm的吸收值,對總RNA進行計算濃度并評估純度;同時結合甲醛變性凝膠瓊脂電泳檢測RNA純度及完整性。
1.6 cDNA樣品合成、標記和雜交
利用Invitrogen公司提供的cDNA合成試劑盒進行逆轉錄,合成雙鏈互補DNA;利用Nimblegen公司的DNA標記試劑盒進行雙鏈互補DNA的標記,使用分光光度計檢測熒光標記效率,以保證后續芯片實驗結果的可靠性;利用NimbleGen提供的雜化系統進行排列雜交,然后利用Nimblegen清洗液試劑盒進行清洗。
1.7 圖像采集和數據分析
利用Agilent Microarray Scanner (Agilent p/n G2565BA)掃描芯片掃描熒光強度,然后將掃描圖像輸入Agilent Feature Extraction軟件,以進行網格對齊與表達數據分析。通過分位數標準化以及Agilent Feature Extraction軟件內將表達數據進行規范,后用Agilent Gene Spring Software軟件分析。芯片選擇,探針設計,圖像采集和數據分析由上海康成生物完成。
1.8 Real-timePCR檢測lncRNA變化
選差異性變化最大的lncRNA通過Real-timePCR 進行驗證。采用ABI 7300熒光定量PCR儀,SYBR Green熒光染料(ABI公司)摻入法相對定量,同時以內參GAPDH為參照,計算差異表達的倍數。
2 結果
2.1 lncRNA表達芯片結果
將40個組織樣本定量進行高通量lncRNA芯片雜交,檢測宮頸癌組織與正常宮頸組織中lncRNA的表達譜,表達譜數據通過t檢驗分析,繪制散點圖(Scatter Plot),以差異倍數Fold>2倍且P<0.05為篩選條件,篩選出顯著性差異表達的lncRNA(圖1)。共檢測出30586條lncRNA,進行聚類分析和比較后,發現差異表達的lncRNA共22043條。其中11545條表達上調,10498條表達下調,在所有的表達差異lncRNA 中,RP11-44K6.2表達上升倍數最多,為404.26倍;RP4-781K5.4為下降倍數最多的lncRNA,為-529.83倍。同時檢測mRNA的表達情況,發現13982 個mRNA表達出現差異性變化,其中5867個表達上升和7115表達下降。在這些變化的mRNA中,SAA2為表達上升倍數最多(7784.59倍)的mRNA,而SERPINB3為下降倍數最多的mRNA(-6948.15倍)。
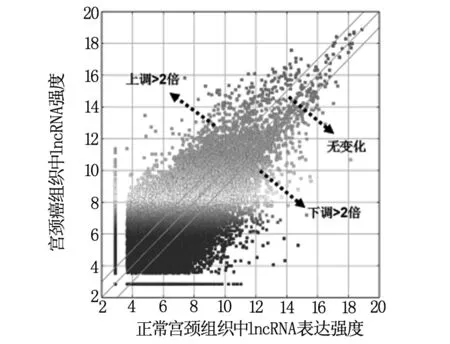
圖1 lncRNA表達散點圖
2.2 聚類分析獲得參與宮頸癌的mRNA的相關功能和信號通路
基因本體論(gene ontology,GO)是基因功能國際標準分類體系,分為分子功能(Molecular Function),生物過程(biological process)和細胞組分(cellular component)三部分。
通過GO聚類分析發現在宮頸癌組織中,上調mRNA(Fold>2)多與細胞膜成分相關,具有受體反應和離子通道等分子功能,參與了刺激反應,信號傳導和細胞交流等生物過程(圖2 A,B,C);下調mRNA(Fold>2)與細胞膜細胞器成分相關,具有蛋白錨定和能量傳遞等功能,參與了核苷酸代謝,嘌呤代謝和核苷磷酸代謝等生物過程(圖2 D,E,F)。參考KEGG Pathway,根據分子參與的功能,表達差異性變化的mRNA可能參與了鈣信號轉導,細胞內吞,細胞粘附和神經信號傳導以及一些信號通路如MAPK,p53,Ras和Wnt等信號通路(圖3)。
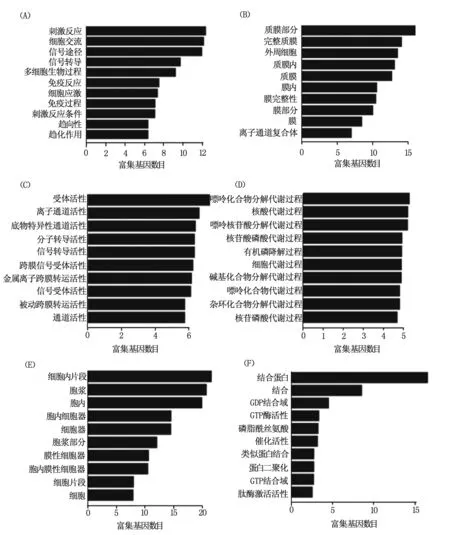
注:A,B和C代表上調mRNA的細胞過程,細胞組分和分子功能分析圖;D,E和F代表下調mRNA的細胞過程,細胞組分和分子功能分析圖。 圖2 mRNA差異表達的Go分析圖
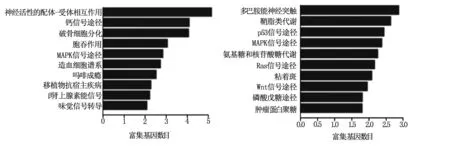
注:左圖為上調,右圖為下調。 圖3 上調和下調mRNA的通路分析圖
2.3 lncRNA和mRNA共差異表達譜以及lncRNA功能預測
很多研究表明lncRNA能夠通過影響mRNA表達情況來發揮其生物學功能。KEGG Pathway根據分子參與的功能,以Pathway Map形式展示每個通路中基因(蛋白質)、小分子等網絡。對差異表達mRNAs進行通路分析以推斷它們參與的通路。對此我們分析了變化差異性最明顯的10個lncRNA,尋找出了與其變化密切相關的mRNA,這些lncRNA可能通過影響相應的mRNA來發揮其生物學功能,有可能成為研究宮頸癌的標志分子。
2.4 實時熒光定量RT-PCR結果驗證芯片結論
為了驗證芯片的結果,采用定量PCR法隨機測定4個變化明顯的lncRNA(BC008359,RP11-521B24.5,BRE-AS1,和RP11-229P13.15)在宮頸癌組織中表達情況。與正常組織相比,BC008359,RP11-521B24.5均出現了20倍以上的上升,而 BRE-AS1和RP11-229P13.15分別降低了70倍和25倍(圖4)。上述結果表明,定量PCR結果與芯片檢測結果一致,證明lncRNA芯片結果可靠。
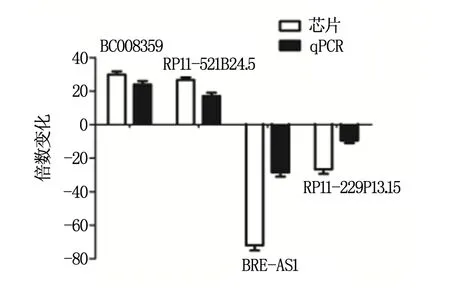
圖4 qRT-PCR檢驗lncRNA芯片
3 討論
關于lncRNA在宮頸癌方面已經有很多研究,Gibb等檢測了宮頸瘤變組織中lncRNA的差異表達,發現在CIN1,CIN2和CIN3期組織中lncRNA均有差異表達[7]。其激活和失活均能從分子水平調控腫瘤細胞的生長[8]。近年來測序技術的廣泛應用,一些lncRNA逐漸被提出和發現。HOTAIR被發現在多種原癌組織中表達,Huang等檢測了218例宮頸癌患者HOTAIR的表達,發現在癌變組織中存在高表達[9],提示該分子可以作為宮頸癌診斷和轉移的標記物[9-10]。王文玲等用PFLP檢測發現,H19在宮頸癌組織中高表達,而在正常組織中不表達[11],同時Vidal等發現上調H19可以促進宮頸細胞對HPV的易感性[12]。因此H19基因可以作為宮頸癌早期復發的標志物。此外P21,UCA1和MALAT-1也被發現在癌組織中高表達,提示癌細胞復發和轉移的可能[13-15]。lncRNA芯片技術能快速高效地發現具有重要調控功能的lncRNA,逐漸成為lncRNA檢測重要手段,將有助于開發新的癌癥診斷和治療方法。
本研究中我們借助Arraystar公司的lncRNA芯片,在臨床中收集了20例宮頸癌組織和20例正常宮頸組織,分析兩組lncRNA表達譜的變化。發現宮頸癌組織中差異表達的lncRNA共22043條。其中11545條表達上調,10498條表達下調。mRNA共13982個出現差異性變化,5867個表達上升和7115個表達下降。上調mRNA(Fold>2)多與細胞膜成分相關,具有受體反應和離子通道等分子功能,參與了刺激反應,信號傳導和細胞交流等生物過程(圖2 A,B,C);下調mRNA(Fold>2)與細胞膜細胞器成分相關,具有蛋白錨定和能量傳遞等功能,參與了核苷酸代謝,嘌呤代謝和核苷磷酸代謝等生物過程(圖2 D,E,F),KEGG通路分析表明MAPK,p53,Ras和Wnt等信號通路很可能參與了mRNA的分子調控。很多研究證實,lncRNA的表達與mRNA表達水平具有密切關系,lncRNA能夠通過影響mRNA表達情況來發揮其功能。我們著重分析了表達差異最高的10條lncRNA和mRNA共差異表達譜,發現無論上調和下調顯著的lncRNA附近的功能性mRNA均有不同程度的表達上調和下調(Fold>2),其中lncRNA RP11-534N16.1下調63倍對應的mRNA DSG1下調61倍,為這10條lncRNA中下調的mRNA倍率最高,后續研究將會進一步確定這兩者的關系。同時,我們通過熒光定量PCR隨機測定4個變化明顯的lncRNA(BC008359,RP11-521B24.5,BRE-AS1,和RP11-229P13.15)進一步驗證,也到相同的結論,提示這4個lncRNA在宮頸癌組織中可能發揮重要作用。目前,關于宮頸癌發病原因和機制,需要進一步研究。在本實驗中,我們闡述了宮頸癌組織中lncRNA的變化情況,并找出與宮頸癌關系最密切的lncRNA分子,為探討lncRNA參與宮頸癌發生與發展及治療提供分子依據,我們將進一步對這些lncRNA進行研究,以期闡明這些差異表達的IncRNA在宮頸癌中的作用,尋找宮頸癌治療的有效靶點。
[1] 夏 燕,張 鈿,張朝霞,等.基因、人乳頭瘤病毒和血清蛋白相關檢測在宮頸癌診斷中的應用新進展〔J〕.中華實用診斷與治療雜志,2008,22(12):924-927.
[2] Okazaki Y,Furuno M,Kasukawa T,et al.Analysis of the mouse transcriptome based on functional annotation of 60770 full-length cDNAs〔J〕.Nature,2002,420(6915):563-573.
[3] Huarte M,Rinn JL.Large non-coding RNAs:missing links in cancer〔J〕.Hum Mol Gene,2010,19(R2):R152-161.
[4] Zhang Z,Hao H,Zhang CJ,et al.Evaluation of novel gene UCA1 as a tumor biomarker for the detection of bladder cancer〔J〕.Zhonghua Yi Xue Za Zhi,2012,92(6):384-387.
[5] Tano K,Mizuno R,Okada T,et al.MALAT-1 enhances cell motility of lung adenocarcinoma cells by influencing the expression of motility-related genes〔J〕.Febs Lett,2010,584(22):4575-4580.
[6] Ozgur E,Mert U,Isin M,et al.Differential expression of lo- ng non-coding RNAs during genotoxic stress-induced apoptosis in HeLa and MCF-7 cells〔J〕.Clin Exp Med,2013,13(2):119-126.
[7] Gibb EA,Becker-Santos DD,Enfield KS,et al.Aberrant expression of long noncoding RNAs in cervical intraepithelial neoplasia〔J〕.Int J Gynecol Cancer,2012,22(9):1557-1563.
[8] Kim K,Jutooru I,Chadalapaka G,et al.HOTAIR is a negative prognostic factor and exhibits pro-oncogenic activity in pancreatic cancer〔J〕.Oncogene,2013,32(13):1616-1625.
[9] Huang L,Liao LM,Liu AW,et al.Overexpression of long noncoding RNA HOTAIR predicts a poor prognosis in patients with cervical cancer〔J〕.Arch Gynecol Obstet,2014,290(4):717-723.
[10] Wilson L,Brown JS,Shin GP,et al.Annual direct cost of urinary incontinence〔J〕.Obstet Gynecol,2001,98(3):398-406.
[11] Wang WL,Gao YM,Gao JL,et al.Expression of H19 imprinting gene in cervical carcinoma and its significance 〔J〕.Tumor,2008,28(1):89-90.
[12] Vidal AC,Henry NM,Murphy SK,et al.PEG1/MEST and IGF2 DNA methylation in CIN and in cervical cancer〔J〕.Clin Transl Oncol,2014,16(3):266-272.
[13] Farha AK,Dhanya SR,Mangalam SN,et al.Deoxyelephantopin impairs growth of cervical carcinoma SiHa cells and induces apoptosis by targeting multiple molecular signaling pathways〔J〕.Cell Biol Toxicol,2014,30(6):331-343.
[14] Wang Y,Chen W,Yang C,et al.Long non-coding RNA U- CA1a(CUDR) promotes proliferation and tumorigenesis of bladder cancer〔J〕.Int J Oncol,2012,41(1):276-284.
[15] Lai MC,Yang Z,Zhou L,et al.Long non-coding RNA MA- LAT-1 overexpression predicts tumor recurrence of hepatocellular carcinoma after liver transplatation〔J〕.Med Oncol,2012,29(3):1810-1816.
(編輯:吳小紅)
Different Expression Profiles of lncRNA in Cervical Cancer Tissues and Its Significance
CHENGantao,YANGXiao,CHENGYanxiang.
RenminHospitalofWuhanUniversity,Wuhan,430060
Objective To investigate the changes of lncRNA in cervical cancer tissues,and provide molecular basis for investigating the occurrence and development of cervical cancer related with lncRNA.Methods 20 cervical cancer patients and 20 normal cervical tissues were selected.Applicated with high-through put microarray lncRNA,we tested the variation of lncRNA expression profiles of normal cervical tissues and cervical cancer tissues.The result was verified by real-time quantitative RT-PCR.Results Compared with normal cervical tissues,a total of 30586 lncRNA and 13982 mRNA were identified as differentially expressed in cervical cancer tissues.GO cluster analysis showed that up-regulated mRNAs and down-regulated mRNAs were associated with various biological processes respectively.The 10 lncRNA showed the most obvious difference analyzed to influence mRNA corresponding to exert its biological function.Quantitative PCR results were consistent with the microarray results suggested four lncRNA (BC008359,RP11-521B24.5,BRE-AS1,and RP11-229P13.15) played important roles in cervical cancer.Conclusion The changes of lncRNA in cervical cancer,and provide molecular basis for investigating the occurrence and development and the therapy of cervical cancer related with lncRNA.
Cervical cancer tissues;lncRNA;High-throughput microarray lncRNA
湖北省衛生廳項目(編號:2012Z-Y02);湖北省衛計委一般面上項目(編號:WJ2015MB084);國家自然科學基金項目(編號:81302273)
430060 武漢大學人民醫院(陳干濤,楊 瀟,程艷香);430060 湖北省仙桃市第三人民醫院(陳干濤)
程艷香
10.3969/j.issn.1001-5930.2017.04.001
R737.33
A
1001-5930(2017)04-0523-05
2016-05-20
2016-12-15)

