多西他塞+順鉑新輔助化療聯合手術治療非小細胞肺癌臨床療效及對相關腫瘤標記物的影響
李 良,吳瑞鋒,劉子滕,冉繼朋,何俊杰(河北省保定市第一中心醫院心胸外科,河北 保定 071000)
多西他塞+順鉑新輔助化療聯合手術治療非小細胞肺癌臨床療效及對相關腫瘤標記物的影響
李 良,吳瑞鋒,劉子滕,冉繼朋,何俊杰
(河北省保定市第一中心醫院心胸外科,河北 保定 071000)
目的 探討多西他塞+順鉑新輔助化療聯合手術治療非小細胞肺癌的臨床療效以及對相關腫瘤標記物的影響。方法 根據治療方法,將我院114例非小細胞肺癌患者分為觀察組66例與對照組48例,觀察組在手術前接受多西他塞+順鉑新輔助化療,對照組僅進行手術治療。觀察兩組短期療效、生活質量(KPS評分)、長期生存率以及腫瘤標記物在手術前后的變化情況。結果 觀察組短期腫瘤病灶緩解率高于對照組,術后第2、8和24周的KPS評分及術后半年、一年和三年的生存率均高于對照組,術后8天各腫瘤標記物的濃度均低于對照組(均P< 0.05)。結論 多西他塞+順鉑新輔助化療聯合手術治療非小細胞肺癌患者,可提高臨床治療效果,更大幅度降低腫瘤標記物濃度,改善患者生活質量,提高患者生存率,值得臨床推廣。
非小細胞肺癌;生活質量;長期生存率;腫瘤標記物
近50年來,許多國家都報道肺癌的發病率和死亡率均明顯增高,肺癌已經成為發病率和死亡率增長最快、對人群健康和生命威脅最大的惡性腫瘤之一。而非小細胞肺癌(NSCLC)約占所有肺癌的80%,其中約75%的患者發現時已處于中晚期,且5年生存率較低。目前NSCLC的治療方法以外科手術切除為主,輔以放化療、中西藥等,但總體療效仍難以令人滿意[1]。同時腫瘤標志物鱗狀細胞癌抗原(SCC)、癌胚抗原(CEA)和細胞角蛋白19片段(CYFRA21-1)的監測不僅對NSCLC早期的診斷,而且對其治療和預后的判斷均有重要的臨床意義[2]。本研究探討多西他塞+順鉑新輔助化療聯合手術治療NSCLC的臨床療效以及對相關腫瘤標記物的影響,為臨床治療與決策提供相關的理論依據。
1 資料與方法
1.1 一般資料 收集2010年3月至2013年3月在我院胸外科治療的NSCLC患者114例。納入標準:經纖維支氣管鏡、穿刺活檢病理或細胞學確診;病理分型按照2002年WHO/IASLC標準;治療前均經檢查確定并按國際肺癌研究協會TNM分期標準進行分期;治療前骨髓、肝腎功能、心電圖均正常;KPS評分≥70;無其他嚴重的內科疾病;既往無放射治療和化療史。根據治療方法分為觀察組66例和對照組48例,兩組性別、年齡、病理類型和臨床分期等一般資料比較,差異均無統計學意義(P> 0.05),具有可比性,見表1。
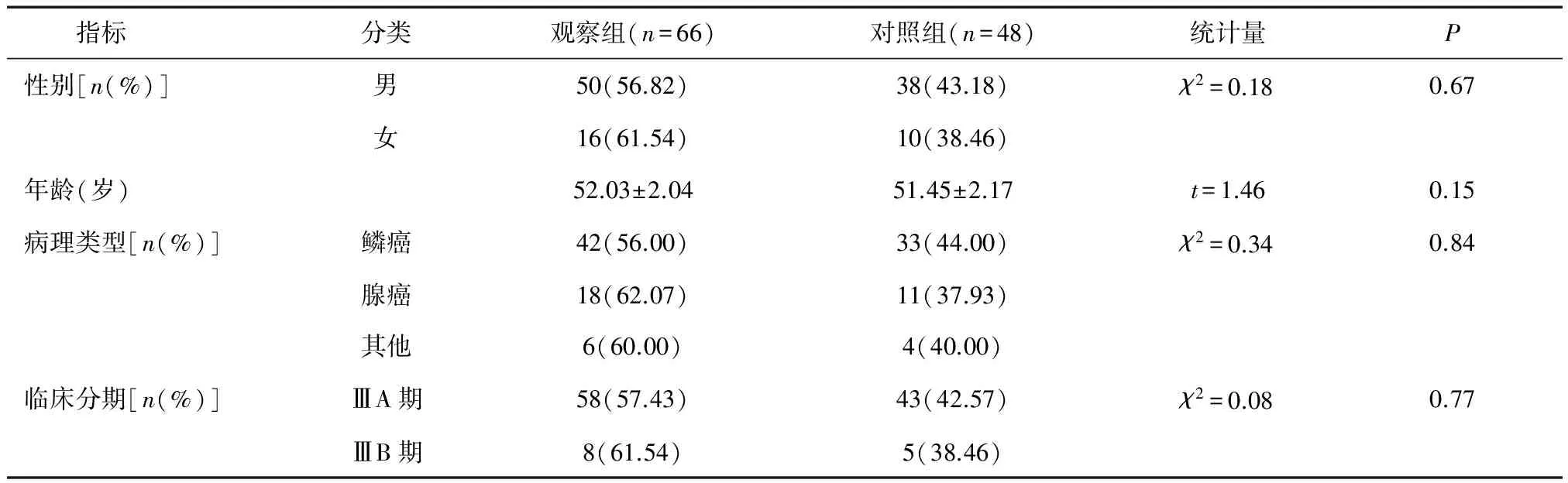
表1 兩組一般資料比較
1.2 治療方法 觀察組手術前接受新輔助化療,多西他塞75 mg/m2靜脈注射,30 min內完成,于第一天應用;順鉑25 mg/m2靜脈注射,在多西他塞給藥30 min后使用,于第1~3天應用。為了防止患者在化療期間出現惡心、嘔吐等不良反應,再補充靜脈滴注地塞米松。21天為1個治療周期,所有患者均接受2個化療周期,同時每2個化療周期結束后進行一次療效評價。對照組僅進行手術治療。手術方法:患者采用仰臥位,行全身麻醉,結合手術中的實際情況,選擇袖式肺葉切除、肺葉切除術+縱隔淋巴結清掃術、全肺切除以及支氣管袖式切除術等手術方式,清除病變淋巴結,并在術后將切下來的組織送病理檢查。腫瘤標記物檢測方法:所有患者均分別于手術前1天和手術后第8天空腹抽取靜脈血4 ml,分離血清后-20 ℃冷凍保存備用,SCC、CEA、CRFRA21-1測定均采用放射免疫法。
1.3 觀測指標 ①生活質量:分別在手術前和手術后的第2、8和24周應用Karnofsky功能狀態評分(KPS評分)標準評估兩組研究對象的生活質量。②長期生存率:隨訪兩組研究對象手術后半年、1年和3年的生存率。③腫瘤標記物:觀察所有研究對象手術前1天和術后8天的腫瘤標記物濃度。根據我院建立的腫瘤標記物的臨界值(CEA<5 ng/ml,SCC<1.5 ng/ml,CYFRA21-1:0.10~4 ng/ml),高于此值則判斷為陽性。
1.4 療效評價標準 將治療后的臨床療效按標準分為4類[3],即完全緩解:腫瘤消失,1個月內未見復發;部分緩解:腫瘤體積縮小大于50%,持續30天以上;穩定:腫瘤體積縮小小于50%,且體積尚未增大;進展:腫瘤體積增大。
1.5 統計學方法 采用SPSS 18.0軟件進行數據分析。計量資料以均數±標準差表示,組間比較采用t檢驗;計數資料比較采用卡方檢驗。P< 0.05為差異有統計學意義。
2 結果
2.1 臨床療效比較 觀察組短期腫瘤病灶緩解率高于對照組,短期療效優于對照組,術后第2、8和24周的KPS評分及術后半年、1年和3年的生存率均高于對照組(P< 0.05),見表2。
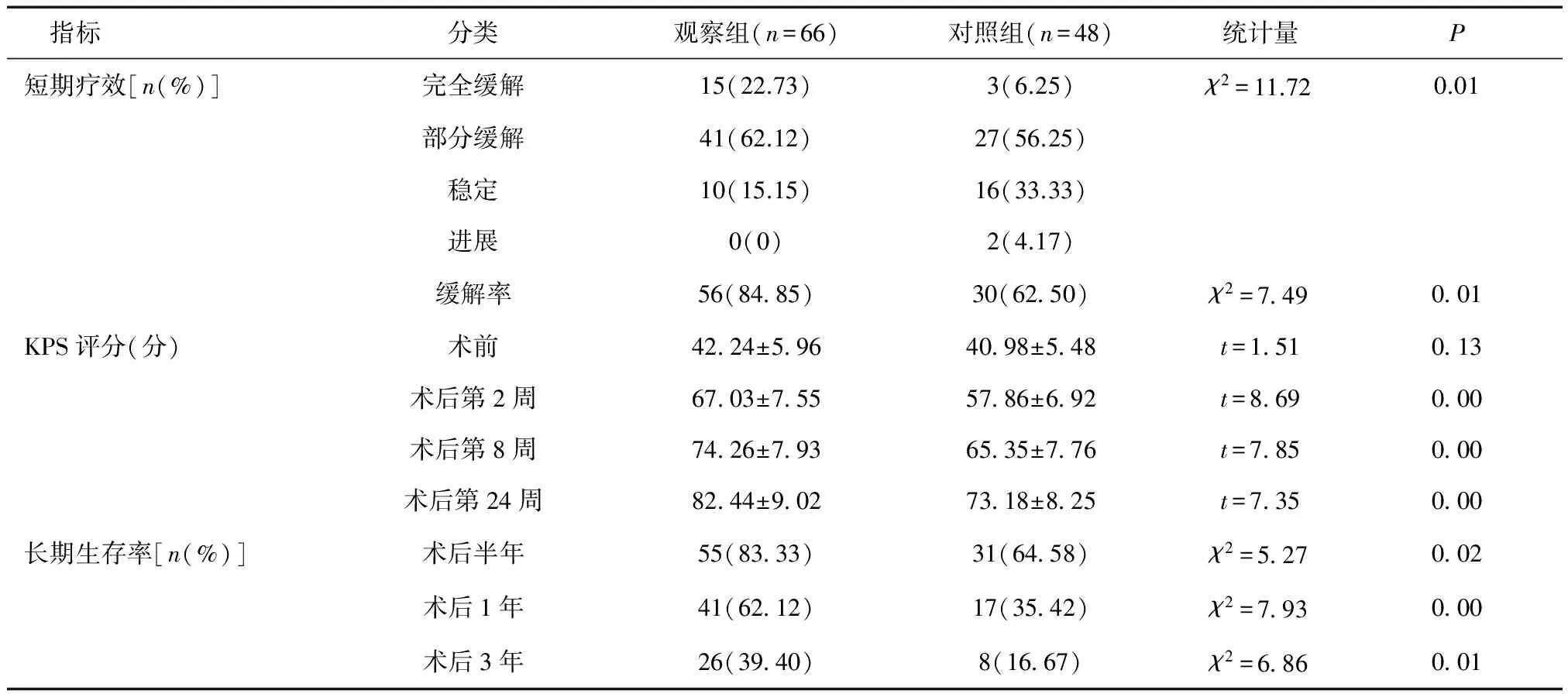
表2 兩組臨床療效比較
2.2 腫瘤標記物比較 術前1天兩組腫瘤標記物濃度差異無統計學意義(P> 0.05)。觀察組術后8天各腫瘤標記物濃度均低于對照組(P< 0.001)。見表3。
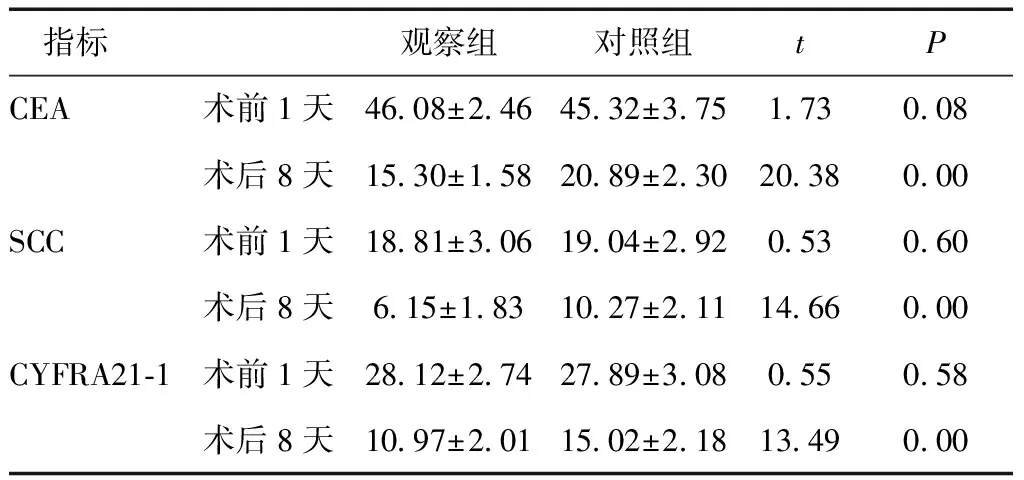
表3 兩組研究對象腫瘤標記物的比較 (ng/ml)
3 討論
NSCLC包括鱗癌、腺癌和大細胞癌。與小細胞癌相比,NSCLC癌細胞生長分裂較緩慢并且擴散轉也移相對較晚[4],因此大部分NSCLC患者就診時不僅有局部病灶,同時還存在遠處轉移。目前NSCLC的治療方法以外科手術切除為主,化療雖然對局部病灶和遠處微轉移灶均有治療作用,但是僅針對于一小部分,在化療后仍會殘留許多耐藥細胞。因此產生了術前新輔助化療[5,6],許多學者也研究探討新輔助化療聯合手術治療NSCLC的有效性和可行性,以提高NSCLC患者的治愈率和生存率[7]。
本研究采用多西他塞+順鉑的化療方案,多西他塞是一種細胞周期特異性抗腫瘤藥物,具有穩定微管和對抗解聚的作用,不僅能夠增加腫瘤細胞對放射線的敏感性,同時也能促進腫瘤細胞的凋亡[8]。順鉑具有抑制放射性損傷修復和乏氧細胞再氧合等作用,使腫瘤細胞的放射敏感性增加。已有大量的臨床實驗表明,化療聯合用藥優于單藥,含有鉑類的新輔助化療方案,能明顯緩解患者癥狀,改善患者生活質量,延長患者生存期[9]。本研究結果顯示新輔助化療聯合手術治療的患者腫瘤病灶緩解率明顯高于僅進行手術治療的患者。在生活質量方面,觀察組研究對象術后第2、8和24周的KPS評分均高于對照組。同時,觀察組術后半年、1年和3年的生存率也均高于對照組,與熊勇等[8]研究結果一致。有研究認為新輔助化療用于治療NSCLC,可以減少癌細胞在手術過程中擴散的機率,能使原發病灶和轉移淋巴結的病期降低,提高手術切除率,有助于減少術后復發與轉移,提高患者術后生存率和生活質量[10]。
肺癌血清腫瘤標記物的升高可見于咳嗽、胸水等臨床癥狀出現之前,因此腫瘤疾病的早期診斷可通過檢測腫瘤標記物來實現。同時通過增高的腫瘤標記物種類可初步判斷疾病的分期,研究[11]表明,術前血清CEA水平可以作為腫瘤疾病TNM分期的參考標準,血清CYFRA21-1的異常增高與腫瘤疾病的分期明顯相關[12]。在治療的過程中檢測腫瘤標記物有助于改善治療方案,在治療后通過監測腫瘤標記物濃度可及時預防腫瘤的復發。CEA是一種廣譜性腫瘤標志物,CEA測定主要用于對肺腺癌的療效判斷、病情發展、監測和預后估計[13]。SCC是一種特異性很好而且是最早用于診斷鱗癌的腫瘤標志物。SCC在正常的鱗狀上皮細胞中抑制細胞調亡和參與鱗狀上皮層的分化,在腫瘤細胞中參與腫瘤的生長,它有助于所有鱗狀上皮細胞起源癌的診斷和監測。CYFRA 21-1是NSCLC最有價值的血清腫瘤標志物,尤其對鱗狀細胞癌患者的早期診斷、療效觀察、預后監測有重要意義[14]。血清中SCC水平與腫瘤的進展程度相關,它配合CYFRA21-1和CEA聯合檢測可提高肺癌患者診斷的靈敏性[15]。本研究結果顯示觀察組患者術后三種腫瘤標記物的濃度均低于對照組,說明手術切除了能分泌產生SCC、CEA和CYFRA21-1的腫瘤細胞,使血清中的腫瘤標記物濃度降低,而術前多西他塞聯合順鉑的新輔助化療方案,使腫瘤轉移灶或手術殘余腫瘤細胞的病期降低,減少腫瘤標記物的分泌,標志著新輔助化療聯合手術治療有較好的臨床治療效果。
綜上所述,多西他塞+順鉑新輔助化療聯合手術治療NSCLC患者,可提高臨床治療效果,更大幅度降低腫瘤標記物濃度,改善患者生活質量,提高患者生存率,值得臨床推廣。
[1] Spranger J,Kroke A,M?hlig M,et al.Inflammatory cytokines and the risk to develop type 2 diabetes: results of the prospective population-based European Prospective Investigation into Cancer and Nutrition (EPIC)-Potsdam Study[J].Diabetes,2003,52(3):812-817.
[2] 盧先鋒,楊雪琴,張志敏,等.肺癌血清腫瘤標志物meta分析[J].中國肺癌雜志,2010,12(11):1136-1140.
[3] 邵青,楊衛兵.治療獲益的晚期非小細胞肺癌患者生活質量相關影響因素分析[J].遵義醫學院學報,2014,55(1):106-110.
[4] Saruwatari K,Yoh K.Maintenance therapy for advanced non-small-cell lung cancer[J].Gan To Kagaku Ryoho,2014,41(8):926-931.
[5] Ukena D.Chemotherapy in stageⅠ+Ⅱnon-small cell lung cancer[J].Lung Cancer,2001,33(1):25-28.
[6] Murren JR,Buzaid AC,Hait WN.Critical analysis of neoadjuvant therapy for Stage IIIa non-small cell lung cancer[J].Am Rev Respir Dis,1991,143(4):889-894.
[7] 張喜平.新輔助化療聯合手術與直接手術治療局部晚期肺癌的對比分析[J].河南醫學研究,2014,23(3):72-74.
[8] 熊勇,周同沖,劉源,等.多西他賽聯合順鉑同步放化療治療局部晚期非小細胞肺癌的療效分析[J].中華腫瘤防治雜志,2010,17(9):699-702.
[9] Abolhoda A,Martin J,Ginsberg RJ,et al.Morbidity and modality for pulmonary resections in lung cancer after induction treatment[J].LungCancer,2000,29(Suppll):89.
[10] 石東峰.兩種方案的新輔助化療聯合手術治療非小細胞肺癌的臨床觀察[D].廣西醫科大學,2012.
[11]Kawachi R,Nakazato Y,Takei H,et al.Clinical significance of preoperative carcinoembryonic antigen level for clinical stage I non-small cell lung cancer: can preoperative carcinoembryonic antigen level predict pathological stage[J].Interact Cardiovasc Thorac Surg,2009,9(2): 199-202.
[12]Hatzakis KD,Froudarakis ME,Bouros D,et al.Prognostic value of serum tumor markers in patients with lung cancer[J].Respiration,2002,69(1): 25-29.
[13]王鏡鑾.HMGB1、MMP-9和CEA在非小細胞肺癌組織中的表達及臨床意義[D].山東大學,2014.
[14]羅疏薇,歐春萍,張莉萍,等.應用ROC曲線評價CEA、CYFRA21-1、SCC對非小細胞肺癌的診斷價值[J].重慶醫學,2011,40(3):250-252+255.
[15]Schneider J.Tumor markers in detection of lung cancer[J].Adv Clin Chem,2006,42: 1-41.
The clinical effect of neoadjuvant chemotherapy of docetaxel plus cisplatin combined with operation therapy in the treatment of non-small cell lung cancer and the impact on the related tumor markers
LILiang,WURui-feng,LIUZi-teng,RANJi-peng,HEJun-jie
(Cardio-ThoracicSurgery,BaodingFirstCentralHospital,Baoding071000,China)
HEJun-jie
Objective To evaluate the effect of a neoadjuvant chemotherapy combined with operation therapy in the treatment of non-small cell lung cancer (NSCLC) and the impact on the related tumor markers.Methods One hundred and fourteen patients with NSCLC were divided into experimental group (n= 66) and control group (n= 48) according to the treatment regimens.The experimental group
the neoadjuvant chemotherapy of docetaxel plus cisplatin before operation while the control group was treated by operation only.The short-term efficacy,KPS score,long-term survival rates and change of the tumor markers before and after operation were compared.Results The tumor response rate in the experimental group was higher than that in the control group.At 2,8 and 24 weeks after operation,the KPS score in the experimental group was higher than that of the control group.After 0.5,1 and 3 years of operation,the survival rate in the experimental group was also higher than that in the control group.After 8 days of operation,the concentration of CEA,SCC and CYFRA21-1 in the experimental group was lower than that in the control group (P< 0.05).Conclusion The neoadjuvant chemotherapy of docetaxel plus cisplatin combined with operation therapy for NSCLC can improve clinical therapeutic effect and reduce the concentration of tumor markers,as well as improve the patient’s quality of life and the patient’s survival rate.It is worthy of clinical promotion.
Non-small cell lung cancer; Quality of life; Long-term survival rates; Tumor markers
何俊杰
R734.2
A
1672-6170(2017)03-0035-04
2016-09-23;
2016-11-24)

