甜茶黃酮回收工藝及抗氧化性研究
劉程程,張彩云,鄭奎玲,陳顯剛,廖莉玲,*
(1.貴州師范大學(xué)化學(xué)與材料科學(xué)學(xué)院,貴州貴陽 550001; 2.貴陽護(hù)理職業(yè)學(xué)院,貴州貴陽 550081; 3.貴州省健康茶葉科技有限公司,貴州黔南 558100)
甜茶黃酮回收工藝及抗氧化性研究
劉程程1,2,張彩云1,鄭奎玲1,陳顯剛3,廖莉玲1,*
(1.貴州師范大學(xué)化學(xué)與材料科學(xué)學(xué)院,貴州貴陽 550001; 2.貴陽護(hù)理職業(yè)學(xué)院,貴州貴陽 550081; 3.貴州省健康茶葉科技有限公司,貴州黔南 558100)
在原有生產(chǎn)甜茶素工藝的基礎(chǔ)上,探究了總黃酮的回收工藝;同時(shí)以維生素C為參照對甜茶總黃酮清除·OH和DPPH·的能力進(jìn)行了檢測。按照工廠的生產(chǎn)工藝在實(shí)驗(yàn)室模擬實(shí)驗(yàn),采用紫外可見分光光度法測定各階段的總黃酮含量。結(jié)果表明:采用75%的乙醇洗脫聚酰胺樹脂上的黃酮,黃酮的洗脫率為91.33%,洗脫液旋干得到的總黃酮的含量為36.30%。75%的乙醇洗脫液經(jīng)過FL-3樹脂進(jìn)一步純化,旋干所得產(chǎn)品總黃酮含量可達(dá)62.70%,得率為1%(以甜茶葉計(jì))。對純化后的甜茶總黃酮樣進(jìn)行紫外掃描光譜和高效液相色譜分析,初步判斷樣品中含有蘆丁、槲皮素。由甜茶總黃酮的抗氧化活性的實(shí)驗(yàn)得知,甜茶總黃酮的抗氧化活性很高;清除·OH的能力:粗黃酮>精黃酮>維生素C;在清除DPPH·的能力方面,當(dāng)濃度大于0.08 mg/mL以后,粗黃酮、精黃酮和維生素C的清除能力區(qū)別不大;在低于0.08 mg/mL時(shí),實(shí)驗(yàn)結(jié)果同樣是粗黃酮>精黃酮>維生素C。
甜茶,總黃酮,抗氧化性,回收工藝
甜茶(RubussuavissimusS. Lee),屬于薔薇科懸鉤子屬多年生多刺灌木,在貴州省主要分布在黔東南、黔北等部分縣市,且資源藏量豐富。甜茶生長在海拔1000多米的高山上,在民間被稱為“神茶”,是防治心腦血管疾病和抗癌的佳品[1]。黃酮類化合物具有抗炎、抗過敏、抗氧化、抑制脂質(zhì)過氧化反應(yīng)、預(yù)防心血管疾病等多種生理功能[2]。甜茶的主要活性成分為甜茶素、甜茶多酚、甜茶黃酮,目前的主要研究集中在甜茶素上[3],而含量較多的甜茶多酚、甜茶黃酮在生產(chǎn)甜茶素的過程中則作為廢棄物棄掉。已有研究表明,甜茶黃酮具有抗腫瘤、抗氧化等生物活性[4-5]。因此本研究是在原有生產(chǎn)甜茶素工藝的基礎(chǔ)上,探究總黃酮的回收工藝,提高甜茶的綜合利用,減少資源浪費(fèi);同時(shí)本研究還對不同含量甜茶黃酮的抗氧化活性進(jìn)行了研究,以期為甜茶黃酮的開發(fā)利用提供科學(xué)依據(jù)。
1 材料與方法
1.1 材料與儀器
甜茶 貴州健康茶科技有限公司;蘆丁 貴州迪大科技有限責(zé)任公司;槲皮素 上海源葉生物科技有限公司;D101樹脂 滄州寶恩吸附材料有限公司;707陰離子樹脂、732陽離子樹脂 江蘇省色可塞思樹脂有限公司;聚酰胺100目 國藥集團(tuán)化學(xué)制劑有限公司;FL-3 天津歐瑞生物科技有限公司;維生素C 分析純,成都市科龍化工試劑廠;二苯基苦味酰基苯肼 東京化成株式會(huì)社;三羥甲基氨基甲烷 杭州鑫瑞達(dá)化工有限公司;鄰苯三酚 北京中生瑞泰科技有限公司;其余試劑均為分析純;實(shí)驗(yàn)所用水均為二次蒸餾水。
Agilent6890高效液相色譜 安捷倫科技有限公司;TU-1900雙光束紫外可見分光光度計(jì) 北京普析通用儀器有限公司;恒溫水浴鍋、FZ102型微型植物粉碎機(jī)、101-1A型電熱恒溫鼓風(fēng)干燥箱 天津泰斯特儀器有限公司;A200S型電子天平 Germany;循環(huán)水式多用真空泵 鄭州長城科工貿(mào)有限公司。
1.2 實(shí)驗(yàn)方法
1.2.1 樹脂預(yù)處理 聚酰胺樹脂的預(yù)處理:參考文獻(xiàn)[6]中的方法處理。707陰離子樹脂、732陽離子樹脂的預(yù)處理:參考文獻(xiàn)[7]中的方法處理。
1.2.2 生產(chǎn)甜茶素的工藝中各階段總黃酮的含量確定 現(xiàn)有的甜茶素生產(chǎn)工藝流程為:甜茶提取液→過D101樹脂→用3 BV的75%乙醇洗脫D101→洗脫液過707陰離子樹脂→732陽離子樹脂→再過聚酰胺樹脂→濃縮后噴霧干燥過柱液→最后得到淡黃色的甜茶素產(chǎn)品。因此我們首先測定生產(chǎn)各環(huán)節(jié)黃酮的含量,進(jìn)而考慮其回收工藝。
1.2.2.1 樣液的制備 稱取一定量甜茶粗粉,按料液比1∶10用蒸餾水回流提取2次,第一次提取時(shí)間1 h,第二次提取時(shí)間為2 h,濾去濾渣并合并兩次的濾液得甜茶提取液。提取液過D101樹脂直至吸附飽和,先用水沖洗柱子,直至流出液無色,然后用3 BV的75%乙醇溶液洗脫,得到D101的洗脫液,D101的洗脫液以2 BV/h的流速依次過預(yù)處理好的707陰離子樹脂(35 mL)、732陽離子樹脂(17 mL)和聚酰胺樹脂(30 mL)。將從每根樹脂的流出液中取出一定量的溶液,顯色后測定其中總黃酮的含量。前一柱子的濾出液作為后一柱子的上樣液。
總黃酮的損失量=樹脂上樣液的黃酮的含量-濾出液黃酮的含量
式(1)
1.2.2.2 黃酮含量的測定方法 以蘆丁為標(biāo)準(zhǔn)品,用分光光度法測定總黃酮的含量[8]。
蘆丁標(biāo)準(zhǔn)曲線的繪制方法:準(zhǔn)確配制蘆丁標(biāo)準(zhǔn)品0.216 mg/mL,準(zhǔn)確吸取不同體積的蘆丁溶液置于6只25 mL的容量瓶中,加95%乙醇至6.0 mL;再加入1.0 mL的5% NaNO2溶液,搖勻,靜置6 min;加入1.0 mL的10% Al(NO3)3溶液,搖勻,靜置6 min;加入10.0 mL的4.0% NaOH溶液,加水稀釋至刻度,搖勻,靜置15 min,在510 nm波長處測定標(biāo)準(zhǔn)系列的吸光度,以蘆丁對照品的濃度為橫坐標(biāo),吸光度為縱坐標(biāo)進(jìn)行線性回歸并繪制標(biāo)準(zhǔn)曲線。線性關(guān)系為:Y=12.993X+0.0089,R2=0.9997。
樣品溶液中總黃酮含量測定:分別準(zhǔn)確吸取一定量的樣品溶液替代蘆丁溶液按照標(biāo)準(zhǔn)曲線繪制方法顯色后定容,并以蒸餾水作空白,于510 nm測定其吸光度,將吸光度值代入標(biāo)準(zhǔn)曲線,并按式(2)計(jì)算就可得到生產(chǎn)甜茶素的工藝中各階段總黃酮的含量。
式(2)
式中:X-樣品中總黃酮含量(mg),C-校準(zhǔn)曲線中黃酮的濃度(mg/mL),V1-定容體積即25 mL,V2-樣品溶液總體積(mL),V3-取樣體積(mL)。
1.2.3 黃酮的回收及純化
1.2.3.1 乙醇濃度對聚酰胺樹脂洗脫效果的影響 取150 mL D101洗脫液以2 BV/h的流速上聚酰胺樹脂(30 mL),吸附飽和后,分別用100 mL的10%、30%、75%、100%的乙醇進(jìn)行梯度洗脫,每25 mL收集一次。測定每管的總黃酮的含量,繪制洗脫曲線。
1.2.3.2 從聚酰胺樹脂上回收黃酮 將預(yù)處理好的707陰離子樹脂和732陽離子樹脂采用濕法裝柱的方法裝入規(guī)格為2 cm×60 cm的層析柱中,裝柱的體積分別為120 mL和60 mL;聚酰胺樹脂同樣采用濕法裝柱的方法裝入規(guī)格為1.5 cm×60 cm的層析柱中,裝柱的體積為30 mL。取250 mL的D101樹脂的洗脫液,以2 BV/h的流速依次過707陰離子樹脂、732陽離子樹脂和聚酰胺樹脂,并測定732樹脂流出液的黃酮含量。
待聚酰胺樹脂吸附完后,先用水沖洗柱子,合并水洗液及過柱液測定黃酮含量。接著用75%的乙醇溶液洗脫聚酰胺樹脂并測定洗脫液黃酮含量。將洗脫液使用旋轉(zhuǎn)蒸發(fā)儀在減壓狀態(tài)下旋干成粉末。精確稱取少許旋干物,用無水乙醇溶解并定容于25 mL容量瓶中,測總黃酮的濃度。旋干物中總黃酮的含量按式(3)計(jì)算:
含量(%)=C×V/M×100
式(3)
式中:C-校準(zhǔn)曲線中黃酮的濃度(mg/mL),V-定容體積即25 mL,M-稱取的旋干物質(zhì)量(mg)。
聚酰胺樹脂上洗脫率的計(jì)算如式(4):
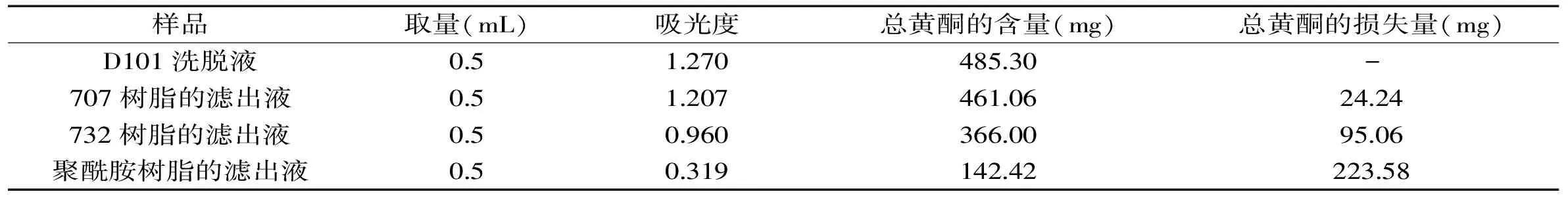
表1 生產(chǎn)甜茶素的工藝各階段黃酮的含量
聚酰胺樹脂上的洗脫率(%)=75%乙醇洗脫下的黃酮的量/(732樹脂過柱液黃酮量-聚酰胺樹脂過柱液黃酮量)×100
式(4)
1.2.3.3 用FL-3樹脂第二次純化 取聚酰胺樹脂的75%的乙醇洗脫液真空濃縮后(使大部分乙醇揮發(fā)出去),再加水配成濃度為2.164 mg/mL的溶液,繼續(xù)過FL-3樹脂,上樣體積為3倍柱體積,吸附飽和后,用8.3 BV 40%乙醇進(jìn)行洗脫,取解吸液顏色深的部分旋干,得到近一步純化的樣品A,按1.2.3測定黃酮含量,按式(5)計(jì)算得率。

式(5)
1.2.4 甜茶總黃酮的鑒定
1.2.4.1 樣品A的紫外-可見光掃描 取少量樣品A溶解于無水乙醇中,在200~600 nm的范圍內(nèi)進(jìn)行紫外-可見光掃描,波長間隔為5 nm[9]。
1.2.4.2 樣品A的高效液相色譜 取少量樣品A先用50%(v·v-1)的甲醇溶解。以蘆丁、槲皮素為標(biāo)準(zhǔn)品,高效液相色譜條件[10-11]:
色譜柱:Diamonsil(鉆石)C18色譜柱250 mm×4.6 mm;流動(dòng)相為:甲醇∶水=50∶50;流速:1 mL·min-1;柱溫:25 ℃;檢測波長:254 nm;進(jìn)樣量:5 μL。
1.2.5 抗氧化性研究
1.2.5.1 粗黃酮和精黃酮樣品的制備 將D101洗脫液旋干,作為純化前的甜茶總黃酮備用(粗黃酮);經(jīng)聚酰胺樹脂純化后的洗脫液旋干,作為純化后的甜茶總黃酮備用(精黃酮)。
1.2.5.2 清除·OH的測定 在8支25 mL的比色管中依次加入體積同為0.85 mL,物質(zhì)的量濃度均是7.5 mmol/L的硫酸亞鐵銨溶液和水楊酸溶液(95%乙醇配制),1 mL不同濃度(0.1、0.2、0.3、0.4、0.5、0.6 mg/mL)的樣品(甜茶粗黃酮、甜茶精黃酮和維生素C),最后在加入樣品溶液的6支試管中加入0.85 mL 0.3% H2O2溶液啟動(dòng)反應(yīng),用蒸餾水定容至10 mL。剩下2個(gè)含有硫酸亞鐵銨溶液和水楊酸溶液的試管,一支加入H2O2,另一支加入要測的樣品溶液。在36 ℃恒溫水浴鍋中反應(yīng)半小時(shí)后在510 nm處以蒸餾水作空白測量其吸光度。清除率的計(jì)算公式如下:
其中:AO為對照品的吸光度(FeSO4+水楊酸+H2O2);AXO為樣品本身的吸光度(FeSO4+水楊酸+樣液);AX為加入樣品后的吸光度(FeSO4+水楊酸+樣液+H2O2)。
1.2.5.3 清除DPPH·的測定 取8支比色管,第一支比色管中準(zhǔn)確地加入 0.2 mg/mL的DPPH·無水乙醇溶液1.6 mL;第二支準(zhǔn)確移取體積為1 mL的樣品液于25 mL具塞比色管;剩下6支比色管中準(zhǔn)確地加入0.2 mg/mL的DPPH·無水乙醇溶液1.6 mL和體積為1 mL不同濃度(0.02、0.04、0.06、0.08、0.10、0.12 mg/mL)的樣品液(甜茶粗黃酮、甜茶精黃酮和維生素C),都用無水乙醇定容至10 mL,搖勻后在暗處放置半小時(shí)用無水乙醇作空白參比,在515 nm處測定的吸光度。清除率的計(jì)算公式如下:
其中:AO為對照品的吸光度(DPPH);AiO為樣品本身的吸光度(樣液);Ai為加入樣品后的吸光度(DPPH+樣液)。
2 結(jié)果與分析
2.1 黃酮的回收
2.1.1 實(shí)驗(yàn)室模擬工廠生產(chǎn)甜茶素工藝各階段黃酮含量的測量結(jié)果 由表1中可以看出,聚酰胺樹脂黃酮的損失量最多,為223.58 mg,說明黃酮主要是被吸附在聚酰胺樹脂上,那么對工廠總工藝中回收總黃酮的工作主要集中在對聚酰胺樹脂上吸附黃酮的回收。
2.1.2 乙醇濃度對聚酰胺樹脂洗脫效果的影響 由圖1中洗脫量可知,聚酰胺樹脂不易解吸,需較濃的醇液才能洗脫下來,其中75%乙醇的解吸量最大,所以選用75%的乙醇對聚酰胺進(jìn)行洗脫。

圖1 乙醇濃度對聚酰胺樹脂黃酮洗脫效果的影響Fig.1 The influence of ethanol concentration on polyamide resin elution注:圖中1~4號為10%乙醇濃度;5~8號為30%乙醇; 9~12號為75%乙醇;13~16號為無水乙醇。
2.1.3 從聚酰胺樹脂上回收黃酮 從聚酰胺樹脂上洗脫下來的樣品中總黃酮的含量為36.30%,洗脫率為91.33%。

表2 用聚酰胺樹脂純化甜茶總黃酮的結(jié)果
注:含量(%)為黃酮量占旋干物總量的百分比;總黃酮的含量為樣液所含黃酮的質(zhì)量;“-”為未測。
2.1.4 用 FL-3樹脂第二次純化 對最終得到的總黃酮樣品A進(jìn)行含量測定,含量為62.70%,以甜茶葉計(jì)算得率為1%。
2.2 甜茶總黃酮的鑒定
2.2.1 樣品A的紫外-可見光掃描圖 黃酮的特征吸收峰在250~300 nm及300~400 nm處存在兩個(gè)特征峰,從圖2中可以看出,該樣品在200~250 nm之間有一個(gè)明顯的吸收峰,在250~300 nm及300~400 nm之間有兩個(gè)微弱的峰。可以初步判斷出有黃酮類物質(zhì)的存在。

圖2 黃酮樣品A的紫外-可見光掃描圖譜Fig.2 The ultraviolet-visible scanning of flavonoids samples A
2.2.2 樣品A的高效液相色譜 由圖3~圖6可知,蘆丁標(biāo)準(zhǔn)品的保留時(shí)間為12.375 min,槲皮素標(biāo)準(zhǔn)品的保留時(shí)間為31.828 min,而樣品分別在12.477 min和31.629 min時(shí)有明顯的峰,初步說明甜茶總黃酮樣品中存在蘆丁、槲皮素物質(zhì)。甜茶黃酮的成分有待于進(jìn)一步深入研究。
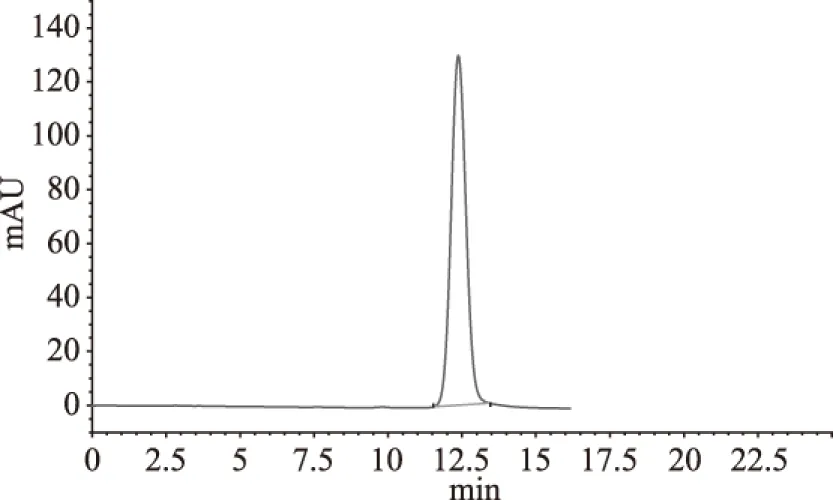
圖3 蘆丁標(biāo)準(zhǔn)品的高效液相色譜圖Fig.3 The HPLC of Rutin standard

圖4 槲皮素的高效液相色譜圖Fig.4 The HPLC of quercetin standard

圖5 樣品A的高效液相色譜圖Fig.5 The HPLC of sample A
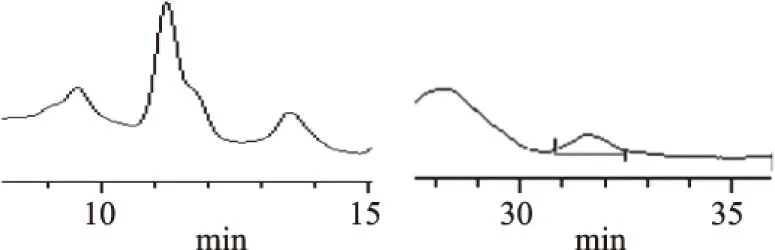
圖6 樣品A高效液相色譜圖中的局部放大圖Fig.6 The partial enlargement of HPLC of samples A
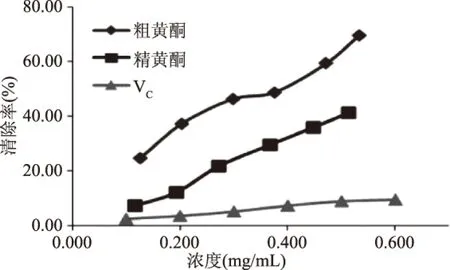
圖7 清除·OH的比較Fig.7 The comparison of·OH scavenging ability
2.3 甜茶中黃酮抗氧化性研究
2.3.1 清除·OH的實(shí)驗(yàn)結(jié)果 由圖7可知,隨著濃度的增加,清除·OH的能力增加,即抗氧化活性增加,而且精黃酮和粗黃酮的抗氧化活性明顯高于維生素C。粗黃酮的抗氧化活性比精黃酮的高,可能是因?yàn)榇贮S酮中含有多酚類其它物質(zhì),具有協(xié)同作用,所以抗氧化活性高。
2.3.2 清除DPPH·的實(shí)驗(yàn)結(jié)果 由圖8可知,同清除·OH一樣,隨著濃度的增加,清除DPPH·的能力增加,抗氧化活性增加,在濃度低于0.08 mg/mL時(shí),粗黃酮增加的速率最大、其次是精黃酮、VC的增速最慢,因此粗黃酮最先達(dá)到最大清除率。當(dāng)濃度達(dá)到0.08 mg/mL時(shí),三者的清除能力基本一致。
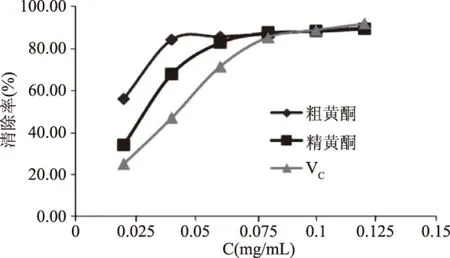
圖8 清除DPPH·的比較Fig.8 The comparison of DPPH· scavenging ability
3 結(jié)論與討論
在原有生產(chǎn)甜茶素工藝的基礎(chǔ)上,探究了總黃酮的回收工藝。研究了從聚酰胺樹脂上回收黃酮的條件,最后確定用75%(v·v-1)的乙醇作為樹脂的解吸劑。75%乙醇洗脫液蒸發(fā)揮去大部分乙醇再加水配成總黃酮濃度為2.164 mg/mL的溶液,經(jīng)過FL-3樹脂進(jìn)一步純化,得到最終的樣品A,含量可達(dá)62.7%,得率為1%。
對純化后的甜茶總黃酮樣品A,做紫外掃描光譜和高效液相色譜分析,初步推斷樣品A中含蘆丁、槲皮素。
在甜茶總黃酮的抗氧化活性的實(shí)驗(yàn)中,實(shí)驗(yàn)結(jié)果顯示純化前后的甜茶黃酮類化合物均表現(xiàn)出較強(qiáng)的抗氧化性,可以顯著地清除·OH、DPPH·。隨著濃度的增加,其抗氧化性會(huì)隨之增強(qiáng),但純化后的總黃酮抗氧化活性有所降低。
[1]柏蕓,薛淑靜,周明,等.薔薇科甜茶加工應(yīng)用研究進(jìn)展[J].農(nóng)產(chǎn)品加工:創(chuàng)新版,2010(11):52-55.
[2]趙秀玲.黃酮類化合物的研究進(jìn)展[J].江蘇調(diào)味副食品,2010,27(5):17-22.
[3]王立波,畢彩虹.甜茶活性成分最新研究進(jìn)展[J].糧食與油脂,2007(2):47-49.
[4]吳燕春,吳冬,謝金鮮,等.廣西甜茶總黃酮的體外抗腫瘤作用[J].中國實(shí)驗(yàn)方劑學(xué)雜志,2010,16(7):165-167.
[5]譚冬明,羅星曄,陳全斌.廣西甜茶水提取物中不同分離部位的抗氧化性研究[J].中國食品添加劑,2016(6):125-129.
[6]張彩云,崔紫姣,陳顯剛,等.FL-3大孔樹脂純化甜茶總黃酮的研究[J].食品工業(yè),2014,35(10):93-95.
[7]鮑晨陽,韋萬麗,陳顯剛,等.甜茶素和甜茶總多酚的制備[J].食品與發(fā)酵工藝,2016,42(5):180-183.
[8]沈小燕,解成喜.天山堇菜中總黃酮的提取和測定[J].分析實(shí)驗(yàn)室,2008,27(S2):235.
[9]白新鵬.食品檢驗(yàn)新技術(shù)[M].北京:中國計(jì)量出版社,2010:41-46.
[10]Gao Artur Figueirinha,Antonio Paranhos.Cymbopogon citratus leaves:Characterisa-tion of flavonoids by HPLC·-PDA-ESI/MS/MS and an approach to their potential as a source of bioactive polyphenols[J].Food Chemistry,2008,110(30):718-728.
[11]楊亞玲,趙紅芳.固相萃取和高效液相色譜測定甜茶中的黃酮類物質(zhì)[J].食品科學(xué),2006,27(9):197-199.
Study on recycling technology and antioxidant activities of total flavones of sweet tea
LIU Cheng-cheng1,2,ZHANG Cai-yun1,ZHENG Kui-ling1,CHEN Xian-gang3,LIAO Li-ling1,*
(1.School of Chemistry and Material Science,Guizhou Normal University,Guiyang 550001,China; 2.Guiyang Nursing Vocational College,Guiyang 550081,China; 3.Guizhou Province Health Tea Science and Technology Limited Company,Qiannan 558100,China)
The recycling technology of flavonoids was explored meanwhile unchanging original production of rubusoside. The removal capacity of the purified and unpurified flavonoids of sweet tea on ·OH,DPPH· were studied by vitamin C as reference. Experiments were conducted in the laboratory according to production process in the factories and the contents of the total flavone in different parts were determined by using UV method. The results showed that the elution rate of flavonoids from the polyamide resin was up to 91.33% by 75% ethanol as elution liquid and content of flavonoids was up to 36.3%. 75% ethanol desorption solution was purified by FL-3 resin further,the content of flavonoids in the final product was up to 62.70%,the yield was 1%. There were rutin and quercetin in the final flavonoids product by UV and HPLC analysis. Flavonoids compounds in sweet tea had good oxidation resistance. ·OH scavenging ability were in order:unpurified flavonoids>purified flavonoids>vitamin C. DPPH· scavenging ability of unpurified flavonoids,purified flavonoids and vitamin C were almost the same when the concentration was more than 0.08 mg/mL,ability of DPPH· scavenging were in order:unpurified flavonoids>purified flavonoids>vitamin C when concentration is less than 0.08 mg/mL.
sweet tea;the total flavone;antioxidant activity;the recycling process
2016-10-28
劉程程(1984-),女,碩士,講師,從事分析化學(xué)研究,E-mail:lccangel@163.com。
*通訊作者:廖莉玲(1963-),女,碩士,教授,從事天然產(chǎn)物方面的研究,E-mail:lll6383@163.com。
貴州省科學(xué)技術(shù)廳中藥現(xiàn)代化攻關(guān)項(xiàng)目(黔科合ZY字【2012】3012號);貴陽市科技局現(xiàn)代藥業(yè)計(jì)劃項(xiàng)目(筑科合同[2012204]號)。
TS201.2
B
1002-0306(2017)09-0201-05
10.13386/j.issn1002-0306.2017.09.030

