中國對蝦蝦殼制備幾丁質工藝研究
柏 韻,李 然,張 振,郭雪松,張冬陽
(錦州醫科大學食品科學與工程學院,遼寧錦州 121000)
中國對蝦蝦殼制備幾丁質工藝研究
柏 韻,李 然,張 振*,郭雪松*,張冬陽
(錦州醫科大學食品科學與工程學院,遼寧錦州 121000)
本實驗以中國對蝦蝦殼為原料制備幾丁質,利用檸檬酸脫鈣、蛋白酶脫除蛋白質,通過對蛋白酶活力測定,本實驗選用Alcalase堿性蛋白酶進行實驗。通過單因素實驗和Box-behnken響應面設計優化幾丁質的最佳制備條件,以灰分含量為脫鈣指標,得到檸檬酸脫鈣最佳工藝條件為:固液比1∶12,反應時間2.5 h,檸檬酸濃度為8%,灰分含量為0.42%。以蛋白質含量為指標,測得堿性蛋白酶脫蛋白的最佳工藝條件為:加酶量2200 U/g,反應時間5 h,反應溫度50 ℃,脫除的蛋白質濃度可達到31.42%。本實驗條件溫和、反應迅速、無環境污染,符合我國綠色無公害理念,為工業化生產幾丁質提供基礎。
幾丁質,檸檬酸,蛋白酶,響應面,最佳工藝
幾丁質,常用名甲殼素,作為天然的堿性多糖廣泛地存在于自然界中。幾丁質和其衍生物有著“第六大生命要素”的美名。幾丁質自然生成量很大,每年約為10 億t以上,僅次于纖維素。幾丁質在蝦、蟹甲殼中含量較高,約為10%~30%,是自然界中少見的帶正電荷的可食性動物纖維素。幾丁質可以抑制細菌生長,可降解,與生物有良好的相容性,因此在醫學、藥學、食品、化工等各個領域倍受青瞇[1-2]。
幾丁質主要從蝦、蟹殼中提取,通過脫蛋白、脫鈣、脫脂等過程制備,目前除鈣、除蛋白質的方法主要是利用鹽酸和NaOH溶液[3],此過程不僅耗時較長,在生產過程中會有大量廢液的生成,對環境影響嚴重[4]。因此本實驗選用檸檬酸代替鹽酸,同時利用酶反應條件的溫和性及高效性,在較短時間內脫除蛋白質,此方法保留幾丁質原有的結構,同時保護環境。
因此,本實驗以中國對蝦蝦殼為原料,對檸檬酸脫鈣、蛋白酶脫蛋白質進行工藝優化,通過響應面設計得到制備幾丁質的最佳工藝條件。
1 材料與方法
1.1 材料與儀器
中國對蝦 錦州海鮮市場;Alcalase堿性蛋白酶、木瓜蛋白酶、Dispase分散酶、福林酚試劑、牛血清蛋白 BIOSHARP公司;檸檬酸、酪氨酸、碳酸鈉、三氯乙酸、過氧化氫、乙醚等試劑 分析純。
恒溫水浴鍋 天津市泰斯特儀器有限公司;UV-6300型紫外可見分光光度計 上海美譜達儀器有限公司;pHs-3B型精密pH計 上海雷磁儀器有限公司;分析天平 上海精密科學儀器有限公司;DHG-9140型電熱恒溫鼓風干燥箱 上海一恒科技有限公司;高速粉碎機 上海圣科儀器設備有限公司。
1.2 實驗方法
1.2.1 工藝流程 酶法優化幾丁質制備工藝流程:蝦殼預處理→檸檬酸脫鈣→水洗至中性→蛋白酶脫蛋白質→水洗至中性→乙醚脫脂→干燥→脫色→幾丁質
1.2.2 原料預處理 將新鮮對蝦洗凈,去肉去雜質,45 ℃恒溫水浴鍋浸泡20 min,浸泡后的蝦殼用清水洗至無內容物,晾干水分。將瀝干水分的蝦殼置于75 ℃的鼓風干燥箱中,干燥4 h。將充分干燥好的蝦殼放入搗碎機內粉碎[5],蝦殼粉備用。
1.2.3 灰分測定 參照國標GB 5009.4-2010《食品中灰分的測定》[6]。稱取蝦殼粉5 g,精確至0.0001 g,加入1 mL乙酸鎂溶液(240 g/L)使試樣完全潤濕,放置10 min,在水浴鍋上將水分蒸干。在電熱板上以小火加熱使試樣充分炭化至無煙。置于馬弗爐中550 ℃灼燒4 h,冷卻至200 ℃左右。取出,放入干燥器中冷卻30 min后稱量,重復灼燒至前后兩次稱量相差不超過0.5 mg。做三組平行實驗,取平均值。
1.2.4 水分測定 直接干燥法。準確稱取5 g蝦殼粉置于濾紙筒內,封好上口,在105 ℃烘箱中烘1 h,取出后放置于干燥器中備用。重復上述實驗至稱量前后兩次稱量相差不超過0.5 mg。參照GB 5009.3-2010食品中水分的測定[7]。
1.2.5 脂肪含量測定 索氏提取法。準確稱取5 g蝦殼粉置于濾紙筒內,封好上口,在105 ℃烘箱中烘1 h,以吸收濾紙包中的水分。取出后放置于干燥器中備用。具體測定方法參照國標GB/T 14772-2008食品中粗脂肪的測定[8]。做三組平行實驗,取平均值。
1.2.6 蛋白質含量測定 在分析天平上準確稱取5 g粉碎的蝦殼,加入30 mL質量分數為4%的NaOH溶液,于溫度95 ℃下水浴浸泡60 min,離心分離,濾渣重復上述實驗,合并上清液,用凱氏定氮法測定上清液中的蛋白質含量。參照國標GB 5009.5-2010,食品中蛋白質的測定[9]。做三組平行實驗,取平均值。
1.3 檸檬酸脫鈣工藝優化
1.3.1 檸檬酸濃度對蝦殼粉中灰分含量影響 選擇固液比1∶10、反應時間3 h,分別加入濃度為 6、8、10、12、14 g/L 的檸檬酸對蝦殼粉進行脫鈣處理,測得灰分含量。
1.3.2 固液比對蝦殼粉中灰分含量影響 反應時間為3 h、檸檬酸濃度10 g/L,測得固液比為1∶1、1∶5、1∶10、1∶15、1∶20 g/mL的灰分含量。
1.3.3 反應時間對蝦殼粉中灰分含量影響 固液比1∶10,檸檬酸濃度10 g/L,分別測得反應2、2.5、3、3.5、4 h后的灰分含量。
1.3.4 響應面實驗 為優化檸檬酸脫鈣,在單因素的基礎上,以檸檬酸濃度、固液比、反應時間為自變量,灰分含量為Y,運用響應面法設計實驗。

表1 檸檬酸脫鈣設計因素水平編碼表
1.4 酶活力的測定
采用福林酚顯色法[10-11],測得680 nm處的OD值并計算酶活力。酶活力定義為1 g固體酶粉,在一定溫度和pH條件下,1 min水解酪素產生1 μg酪氨酸為1個活力單位,用U/g表示。
1.4.1 比色計常數K的測定 以酪氨酸溶液為標準,繪制標準曲線,其中以酪氨酸含量為橫坐標,吸光度OD值為縱坐標。
1.4.2 樣品測定 取1 mL酶稀釋液,40 ℃下預熱5 min,加入1 mL 2%酪蛋白溶液、2 mL 0.4 mol/L三氯乙酸,沉淀15 min,過濾,取濾液1 mL,加5 mL 0.4 mol/L碳酸鈉、1 mL福林酚試劑,40 ℃恒溫水浴顯色20 min,680 nm處比色。同時做空白實驗。
1.5 酶解法脫蛋白質工藝優化
1.5.1 福林酚法測蛋白質 取7支試管,分別加入0、0.1、0.2、0.4、0.6、0.8、1 mL標準蛋白質溶液(250 μg/mL牛血清蛋白),用水補足到1 mL,加入5 mL福林酚試劑甲,混勻,于25 ℃放置10 min,再加入試劑乙0.5 mL,立即搖勻,25 ℃保溫30 min,于500 nm處比色。以蛋白質濃度為橫坐標,光密度值為縱坐標[12],繪制標準曲線。
1.5.2 加酶量對蛋白質含量的影響 分別加入1000、1500、2000、2500、3000 U/g的Alcalase堿性蛋白酶,在50 ℃下反應5 h,取1 mL水解液于500 nm處比色,通過標準曲線計算水解液中蛋白質含量。做三組平行實驗,取平均值,同時做空白實驗。
1.5.3 反應時間對蛋白質含量的影響 反應溫度50 ℃,加入2000 U/g Alcalase堿性蛋白酶,分別反應1、3、5、7、9 h,計算水解液中蛋白質含量。方法同上。
1.5.4 反應溫度對蛋白質含量的影響 加入2000 U/g Alcalase堿性蛋白酶,恒溫水浴的溫度分別為30、40、50、60、70 ℃,反應時間5 h,測得水解液中蛋白質含量。方法同上。
1.5.5 響應面實驗 為優化蛋白酶脫蛋白質工藝,在單因素實驗的基礎上,以反應溫度、加酶量、反應時間為自變量,蛋白質濃度為Y值,運用響應面法設計實驗[13],分析各研究自變量及其交互作用對蛋白質濃度的影響。

表2 蛋白酶脫蛋白質設計因素水平編碼表
1.6 乙醚脫脂
將脫鈣、脫蛋白后的蝦殼粉用無水乙醚浸泡3 h,過濾、揮干乙醚。
1.7 脫色
將揮干乙醚后的蝦殼粉經過30%過氧化氫溶液浸泡2 h。
1.8 數據討論分析
利用Design-Expert8.0.6進行響應面設計。
2 結果與分析
2.1 蝦殼常規指標測定結果
由表3可知,對蝦殼中各成分含量進行測定,其中灰分17.88%、水分4.32%、脂肪14.26%、蛋白質41.65%,其余部分主要為甲殼素。

表3 蝦殼常規指標測定結果
2.2 檸檬酸脫鈣單因素實驗結果
2.2.1 檸檬酸濃度對蝦殼粉中灰分含量影響 檸檬酸濃度對蝦殼中灰分影響見圖1。
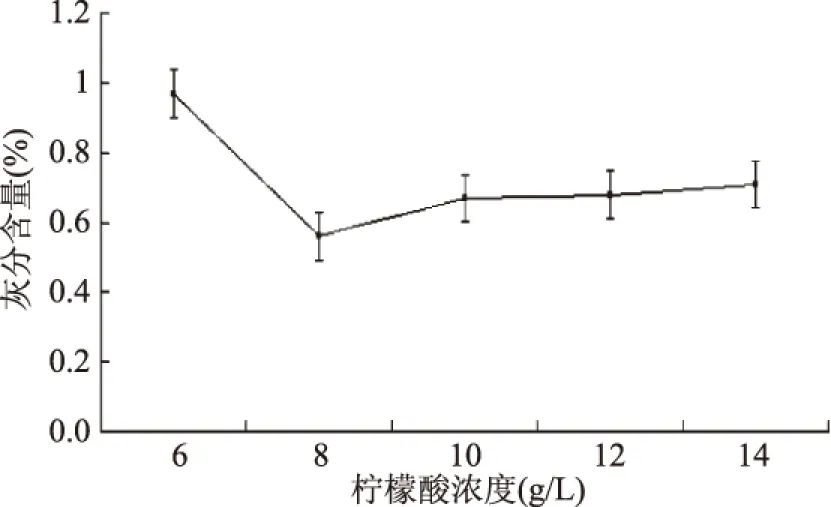
圖1 檸檬酸濃度對蝦殼中灰分影響Fig.1 Effect of citric acid concentration on ash content in shrimp shells
圖1表明,當檸檬酸濃度為8 g/L時,灰分含量最低,濃度小于8 g/L時,隨著濃度的增加,灰分含量逐漸降低,而當檸檬酸濃度大于8 g/L時,隨檸檬酸濃度增加,灰分含量有小幅升高,但總體趨于穩定,因此選擇最佳濃度為8 g/L。
2.2.2 固液比對蝦殼粉中灰分含量影響 固液比對蝦殼粉中灰分含量影響見圖2。

圖2 固液比對蝦殼粉中灰分含量影響Fig.2 Effect of solid-liquid ratio on ash content in shrimp shells
圖2表明,當固液比小于1∶10 時,隨著固液比的增大,灰分含量有所下降,且下降明顯。固液比的增加有助于蝦殼中的無機鹽與檸檬酸充分接觸,有利于無機鹽溶解[14]。當固液比在1∶10 以后,灰分含量降低緩慢。因此固液比1∶10為最佳。
2.2.3 反應時間對蝦殼粉中灰分含量影響 反應時間對蝦殼粉中灰分含量影響見圖3。

圖3 反應時間對蝦殼中灰分影響Fig.3 Effect of reaction time on ash content in shrimp shell
圖3表明,當反應時間為3 h時,灰分含量最低。2~3 h時,增加反應時間,檸檬酸與蝦殼中的無機鹽反應越來越完全,灰分含量呈逐漸減少的趨勢。3 h后延長反應時間,灰分含量沒有明顯的變化,因此3 h為最佳反應時間。
2.2.4 響應面實驗優化檸檬酸脫鈣
2.2.4.1 響應面實驗結果 利用Design-Expert8.0.6進行響應面設計,以灰分含量(Y)為響應值,響應面實驗結果如表4,對表4進行回歸分析,得到回歸方程為Y=0.59+0.046A+0.23B-0.30C+0.097AB+0.11AC-0.10BC+0.18A2+0.086B2+0.37C2

表4 檸檬酸脫鈣Box-Behnken實驗設計結果

表5 檸檬酸脫鈣Box-Behnken回歸方程方差分析
注:差異不顯著,p≥0.05,*差異顯著,p≤0.05;**差異極顯著,p≤0.01。


圖4 反應時間和檸檬酸濃度相互作用對檸檬酸脫鈣工藝影響的響應曲線面Fig.4 Response curve surface of citric acid decalcification process with interaction of reaction time and citric acid concentration

圖5 反應時間和固液比相互作用對檸檬酸脫鈣工藝影響的響應曲線面Fig.5 Response curve surface of citric acid decalcification process with interaction of reaction time and solid-liquid ratio
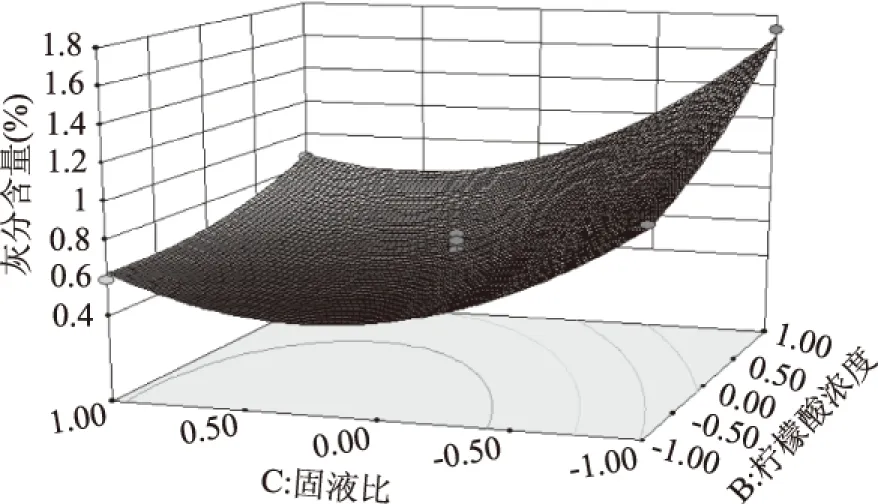
圖6 檸檬酸濃度和固液比相互作用對檸檬酸脫鈣工藝影響的響應曲線面Fig.6 Response curve surface of citric acid decalcification process with interaction of citric acid concentration and solid-liquid ratio
從圖 4、圖5、圖6可見:檸檬酸濃度、反應時間和固液比之間的交互作用。從圖4可見:根據響應面彎曲程度分析得出,檸檬酸濃度較低時,增加反應時間,灰分含量逐漸降低后趨于平穩。當提高檸檬酸濃度時,灰分含量隨著反應時間的增加先降低后緩慢增加。隨著檸檬酸濃度增加,與蝦殼中的無機鹽反應越完全,溶液一直呈現酸性,從而檸檬酸鈣未出現沉淀,因此灰分含量隨著時間逐漸減小[15]。從圖5可見:隨固液比的增加,灰分含量呈現降低趨勢,反應時間增長,隨著固液比的增加,灰分含量先降低后略有上升。當固液比較低時,溶液中的檸檬酸隨著反應的進行而逐漸減少,最終導致溶液pH增大而使其中的檸檬酸鈣沉淀吸附在幾丁質上,從而使產品灰分含量較大,增加固液比后,溶液一直保持酸性,未出現沉淀,隨反應時間增加,灰分含量開始減少,料液比與反應時間之間存在相互作用。從圖6可見:隨著固液比和檸檬酸濃度的增加,灰分含量同樣先減少后略有上升,曲面較陡,表明檸檬酸濃度和固液比的相互作用對灰分含量的影響較大。
2.2.4.3 檸檬酸脫鈣最佳工藝條件的確定 通過軟件Design-ExpertV8.0.6求解方程,得到了最優提取工藝條件為:固液比為1∶12.4,反應時間2.5 h,檸檬酸濃度為8.14%,在上述條件下,由響應面模型預測的灰分含量0.420%。為了驗證模型可行性,結合實際情況以固液比為1∶12,反應時間在2.5 h,檸檬酸濃度為8%,經過三次重復實驗,灰分含量平均值為0.423%,與預測值0.420%結果比較接近,說明模型可以很好的反映檸檬酸脫鈣的最佳工藝條件。
2.3 酶解法脫蛋白質單因素實驗
2.3.1 福林酚法測蛋白質 以吸光度OD值為縱坐標,牛血清蛋白濃度為橫坐標,繪制標準曲線,測定濃度為0~250μg/mL,結果如圖7所示。

圖7 牛血清蛋白濃度-吸光度標準曲線Fig.7 Bovine serum albumin concentration-absorbance standard curve
2.3.2 加酶量對蛋白質含量的影響 根據酶活力測定結果選擇Alcalase堿性蛋白酶進行實驗。加酶量對蛋白質含量的影響見圖8。

圖8 加酶量對蛋白質含量的影響Fig.8 The amount of enzyme on protein content
圖8表明,蛋白質濃度隨著加酶量增加而增加。當加酶量在2000 U/g以下時,蛋白質濃度增加明顯,坡度較大,當加酶量>2000 U/g時,增加緩慢,總體趨勢趨于平穩。因此最適加酶量為2000 U/g。
2.3.3 反應時間對蛋白質含量的影響 反應時間對蛋白質含量的影響見圖9。
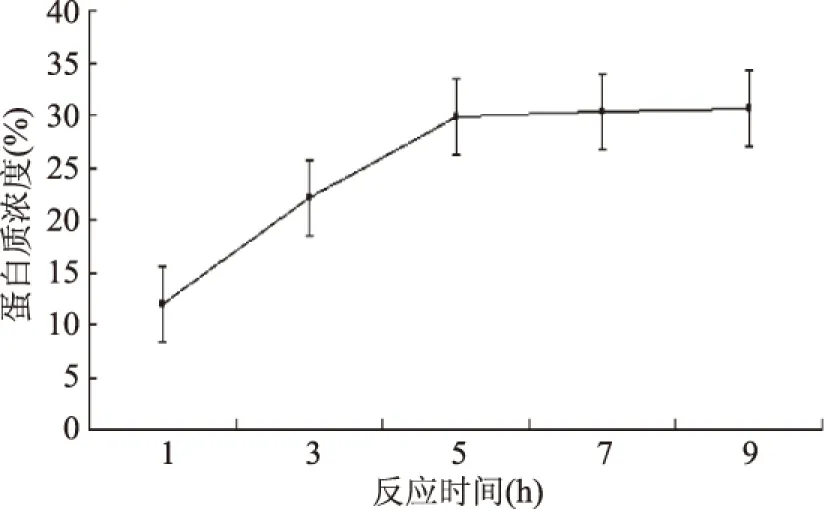
圖9 反應時間對蛋白質含量的影響Fig.9 Effect of reaction time on protein content
圖9表明,延長反應的時間,反應進行的越完全,蛋白質濃度也隨之增加,反應時間在5 h之前,蛋白質濃度增加明顯,當反應時間為5 h時,水解液中蛋白質濃度達到30%,之后增加反應時間,蛋白質濃度增加不明顯,因此反應時間為5 h。
2.3.4 反應溫度對蛋白質含量的影響 反應溫度對蛋白質含量的影響見圖10。

圖10 反應溫度對蛋白質含量的影響Fig.10 Effect of reaction temperature on protein content
圖10表明,反應溫度由30 ℃升至50 ℃的過程中,蛋白質濃度由21.9%升至44.5%,之后隨著溫度的上升,蛋白質濃度基本保持不變。在較高溫度下,蛋白質在酶解液中溶解度較大,分子運動加劇,蛋白質分子從蝦殼中分離的速率加快。當溫度大于50 ℃,超出蛋白酶最適溫度,酶活力降低,因此蛋白質濃度基本不增加。因此選用50 ℃作為最佳反應溫度。
2.4 堿性蛋白酶脫蛋白質響應面優化
2.4.1 響應面實驗結果 利用Design-Expert8.0.6進行響應面設計,以蛋白質濃度(Y)為響應值,響應面實驗結果如表6,對表6進行回歸分析,得到回歸方程為Y=29.95+1.54A-0.68B+0.17C+0.34AB-0.61AC-0.87BC-2.09A2-6.39B2-2.57C2
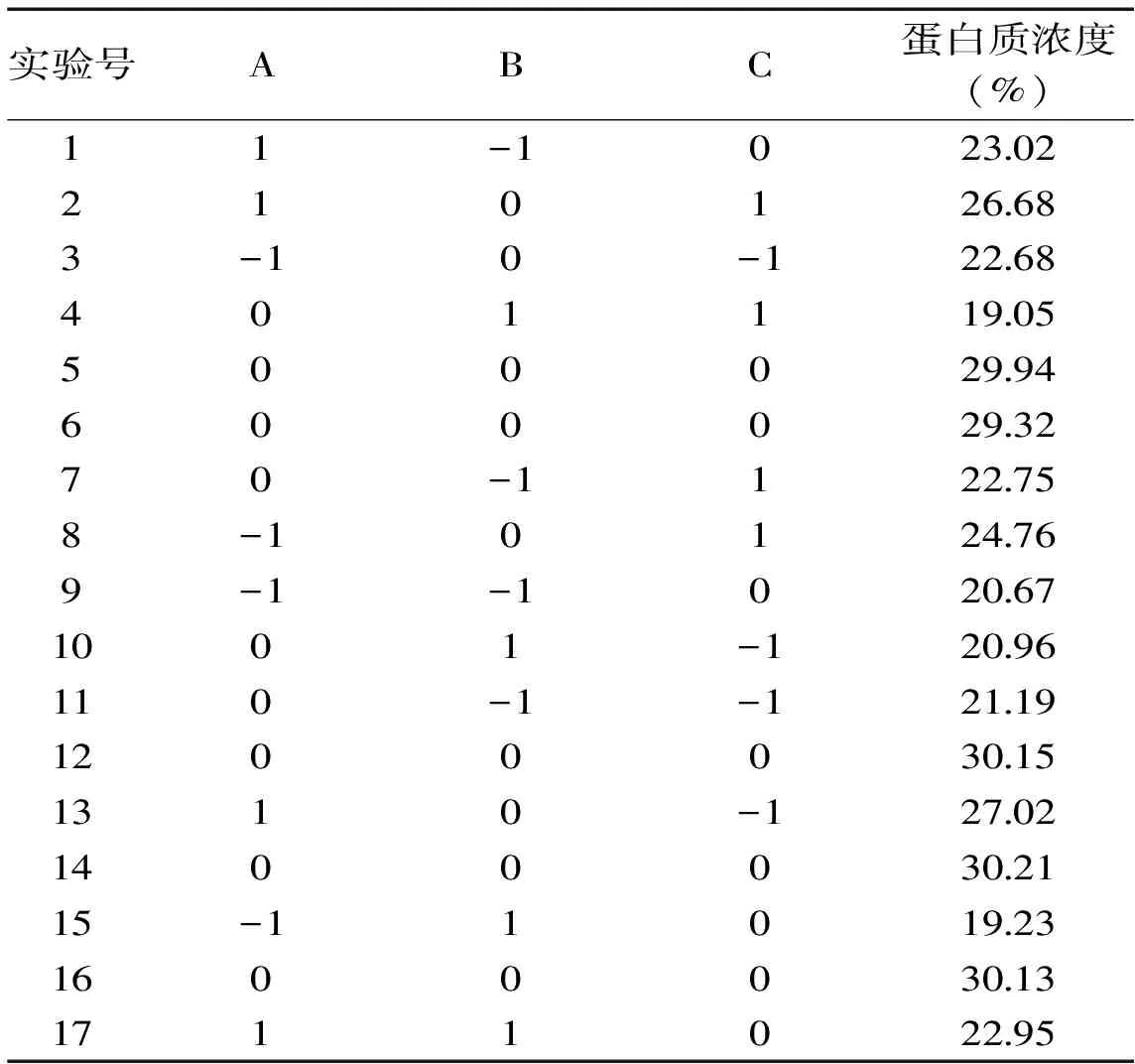
表6 蛋白酶法脫蛋白質的Box-Behnken實驗設計結果

圖11、圖12、圖13表明:反應溫度、加酶量、反應時間三個因素間存在交互作用。從圖11可知:蛋白質濃度隨著加酶量和反應時間的增加先增加后降低,曲線弧度較大。增加反應時間,反應越完全,增加蛋白酶的添加量,脫除的蛋白質含量越高,說明反應時間和加酶量對蛋白質濃度的影響較大。從圖12可見:溫度較低時,蛋白質濃度隨著加酶量的增加明顯上升,提高反應溫度,分子間運動加快,蛋白質濃度增加,溫度超過酶最適溫度后酶活力降低,蛋白質脫除率減少。從圖13可見:隨著反應溫度和反應時間的增加,蛋白質濃度同樣有先增加后減少的過程,曲面明顯,有明顯的峰值,兩者之間存在相互作用。

表7 堿性蛋白酶脫蛋白質的Box-Behnken回歸方程方差分析
注:**差異極顯著,p≤0.01;*差異顯著,p≤0.05;不顯著,p≥0.05。

圖11 反應時間和加酶量相互作用對堿性蛋白酶脫蛋白工藝影響的響應曲線面Fig.11 Response curve surface of alcalase protease deproteinization process with interaction of reaction time and protease dosage

圖12 反應溫度和加酶量相互作用對堿性蛋白酶脫蛋白工藝影響的響應曲線面Fig.12 Response curve surface of alcalase protease deproteinization process with interaction of reaction temperature and protease dosage

圖13 反應溫度和反應時間相互作用對堿性蛋白酶脫蛋白工藝影響的響應曲線面Fig.13 Response curve surface of alcalase protease deproteinization process with interaction of reaction temperature and reaction time
2.4.3 堿性蛋白酶脫蛋白質的最佳工藝條件確定 通過軟件Design-ExpertV8.0.6求解方程,得到的堿性蛋白酶脫蛋白質最佳提取工藝條件為:加酶量2197.29 U/g,反應時間4.92 h,反應溫度49.46 ℃,在上述條件下由響應面模型預測的蛋白質濃度為30.24%。為了檢測模型可行性,結合具體自身實際情況,以反應溫度50 ℃,加酶量2200 U/g,反應時間5 h,經過三次重復實驗平均值為31.42%,與預測值30.24%結果比較接近,說明模型可靠,可以得出良好的提取工藝條件。
3 結論
通過單因素實驗和Box-behnken響應面設計優化幾丁質的最佳制備條件,以灰分含量為脫鈣指標,得到檸檬酸脫鈣最佳工藝條件為:固液比1∶12,反應時間2.5 h,檸檬酸濃度為8%,灰分含量為0.42%,符合食品級要求。以蛋白質含量為指標,測得堿性蛋白酶脫蛋白的最佳工藝條件為:加酶量2200 U/g,反應時間5 h,反應溫度50 ℃,脫除的蛋白質濃度可達到31.42%。
幾丁質的制備一直是人們研究的熱點,但常用的制備方法多用到鹽酸、濃堿[16-17]。此類試劑雖然易得,但反應時間長,同時在反應過程中會產生多種廢液,對環境污染嚴重。本實驗選用酶法脫蛋白,試劑的用量少,反應條件溫和,反應時間與傳統工藝相比較明顯縮短。利用福林酚法測得的蛋白質含量,靈敏性高,顯色效果明顯,減少了不必要的偏差實驗步驟,方便快捷。
[1]姜山,史源,朱啟忠.殼聚糖文獻分析[J].大學化學,2011(4):45-48.
[2]Ashish Dev,Jithin C,Sreeja V,et al. Novel carboxymethyl chitin nanoparticles for drug delivery applications[J]. Carbohy drate polymers,2010,79(4):1073-1079
[3]Knorr D. Recovery and utilization of chitin and chitosan in food processing waste management[J]. Food Technology,1991,34:114-120.
[4]Mahmoud N S,Ghaly A E,Arab F.Unconventional approach for demineralization of deproteinized crustacean shells for chitin production[J].Journal of Biochemistry and Biotechnology,2007,3(1):1-9
[5]劉錫紅,趙靈希,張成杰,等.酶法從蝦殼中提取甲殼素工藝優化的研究[J].食品工業科技,2013(22):209-212,216.
[6]GB 5009.4-2010,食品安全國家標準 食品中灰分的測定[S]. 2010.
[7]GB 5009.3-2010,食品安全國家標準 食品中水分的測定[S]. 2010.
[8]GB/T 5009.6-2003,食品中脂肪的測定[S]. 2003.
[9]GB 5009.5-2010,食品安全國家標準 食品中蛋白質的測定[S]. 2010.
[10]張劍,趙雷敏,康林霞.堿性蛋白酶活力分析方法研究[J].日用化學工業,2012(3):192-195.
[11]KarinaDM,VykundeshwariG,AnaMRP,et al.Effect of dynamic high-pressure treatment on the interfacial and foaming properties of soy protein isolate-hydroxypropyl methylcellulose ssystems[J].Food Hydrocolloids,2011,25(6):1640-1645.
[12]Lowry O H,Rosebrough N J,陳祥娥,等.福林酚試劑法測定蛋白質[J].食品與藥品,2011(3):147-151.
[13]王馨云,耿麗晶,陳偉杰,等.響應面法優化五味子枯葉中木脂素的提取條件[J].飼料研究,2015,22:48-54.
[14]彭元懷,黃川,趙澤潔.超聲波輔助提取蝦殼甲殼素的工藝研究[J].食品工業科技,2012(9):304-308.
[15]唐義寶,謝晶.檸檬酸用于蝦頭、蝦殼的脫鈣處理[J].食品科學,2012(10):6-9.
[16]Karina D M,Vykundeshwari G,Ana M R P,et al. Effect of dynamic high-pressure treatment on the interfacial and foaming properties of soy protein isolate-hydroxypropylmethylcelluloses systems[J].Food Hydrocolloids,2011,25(6):1640-1645.
[17]梁玉佳.南極磷蝦蝦殼中甲殼素的制取與應用[D].大連:大連工業大學,2013.
Optimum technology of chitin preparation from penaeus chinensis
BAI Yun,LI Ran,ZHANG Zhen*,GUO Xue-song*,ZHANG Dong-yang
(College of Food Science and Engineering,Jinzhou Medical University,Jinzhou 121000,China)
In this study,chitin was extracted from Penaeus chinensis,and the protein was removed by protease and decalcified by citric acid. The protease activity was measured by Alcalase Alkaline protease. The optimal conditions of chitin preparation were determined by single factor experiment and Box-behnken response surface design. The optimal conditions of decalcification were obtained as follows:solid-liquid ratio 1∶12,reaction Time 2.5 h,citric acid concentration of 8%,ash content of 0.42%. The optimum conditions were as follows:adding 2200 U/g enzyme,reaction time 5 h,reaction temperature 50 ℃,and the protein concentration could reach 31.42% by taking the protein content as the index. The experimental conditions are mild,rapid response,no environmental pollution,in line with the concept of pollution-free green,and to provide the basis for industrial production of chitin.
chitin;citric acid;protease;response surface;optimal process
2016-11-17
柏韻(1992-),女,碩士,研究方向:農產品加工與貯藏工程,E-mail:m13188132062@163.com。
*通訊作者:張振(1983-),男,博士,講師,研究方向:食品營養與安全,E-mail:zhangzhen8849@163.com。 郭雪松(1970-),男,碩士,副教授,研究方向:農產品精深加工及綜合利用,E-mail:Jzguoxuesong@163.com。
遼寧醫學院校長基金(XZJJ20140121);大學生創新訓練項目(201610160057)。
TS254.1
B
1002-0306(2017)09-0174-07
10.13386/j.issn1002-0306.2017.09.025

