不同滴度噬菌體D29對氣道上皮細胞9HTE的生長及功能影響研究*
梁 梅,郭述良,張紅梅
(1.重慶市渝北區人民醫院呼吸內科 401120;2.重慶醫科大學附屬第一醫院呼吸內科,重慶 400016;3.重慶市第五人民醫院呼吸內科 400062)
不同滴度噬菌體D29對氣道上皮細胞9HTE的生長及功能影響研究*
梁 梅,郭述良2△,張紅梅3
(1.重慶市渝北區人民醫院呼吸內科 401120;2.重慶醫科大學附屬第一醫院呼吸內科,重慶 400016;3.重慶市第五人民醫院呼吸內科 400062)
目的 研究噬菌體D29不同滴度對氣道上皮細胞株9HTE的生長及功能影響。方法 分別用高滴度(109PFU/mL)和低滴度(107PFU/mL)噬菌體D29及噬菌體緩沖液組作用于9HTE細胞株后,用四甲基偶氮唑藍比色法(MTT)檢測細胞生長情況;用酶聯免疫吸附試驗(ELISA)法測量細胞上清液白細胞介素(IL)-6、IL-8水平;用逆轉錄PCR(RT-PCR)檢測細胞間黏附分子-1(ICAM-1)mRNA的表達,用流式細胞技術檢測細胞凋亡率。結果 高、低滴度噬菌體D29作用氣道上皮細胞一段時間后,對細胞生長活性、細胞因子IL-6、IL-8和ICAM-1 mRNA的表達,以及細胞凋亡率的影響與噬菌體緩沖液組比較差異無統計學意義(P>0.05)。結論 高、低滴度噬菌體D29對體外培養的氣道上皮細胞生長及功能無明顯影響。
細菌噬菌體;氣管;白細胞介素類;血管細胞黏附分子1;氣道上皮細胞;安全性
當前,結核病仍是全球最嚴重的公共衛生問題之一,2014年全球960萬人患有結核病,其中150萬人因感染結核而死亡,48萬人為耐多藥結核病。結核病耐藥形勢嚴峻,而現有的治療方案無法達到令人滿意的效果,因此急需研發新的治療結核病的方法和制劑。噬菌體作為細菌病毒中的一種,能在感染細菌周期末期特異性裂解宿主菌,故可作為抗菌制劑而被用于研究[1],特別是用于耐藥菌的治療[2]。噬菌體D29能裂解結核分枝桿菌,有望用于結核病的診斷和治療。本課題組前期研究發現,噬菌體D29能裂解巨噬細胞內的結核分枝桿菌,使結核病模型豚鼠肝、脾臟器荷菌量減少,這為研制耐藥結核病治療用噬菌體制劑奠定了基礎[3]。且前期研究還發現噬菌體D29通過呼吸道給入后到達肺部的滴度比皮下、肌內注射高,且維持時間長,表明氣道給藥可能有利于治療肺結核[4]。但通過呼吸道給入噬菌體安全性如何還不得而知,本文通過對噬菌體D29對體外培養的氣道上皮的生長和功能研究,以期了解噬菌體通過氣道給藥的安全性。
1 材料與方法
1.1 材料 試驗材料:氣道上皮細胞株9HTE,由重慶市兒童醫院呼吸科實驗室惠贈;噬菌體D29由中國藥品生物制品檢定所王國治教授惠贈。試劑:DMEM培養基(美國Hyclone公司),胎牛血清(FBS,美國Gibco公司),胰蛋白酶(美國Gibco公司),四甲基偶氮唑藍比色(MTT,超純級,美國Amersco公司),酶聯免疫吸附試驗(ELISA)試劑盒(美國R&D公司分裝),Annexin V/PI細胞凋亡檢測試劑盒(凱基公司)。逆轉錄試劑盒、RNAiso、Plus、Tag酶、DNA Marker (上海寶生物公司),引物序列由上海寶生物合成。
1.2 方法
1.2.1 9HTE細胞的培養 氣道上皮細胞9HTE用含10%的FBS DMEM培養基(內含有4.0 mmol/L谷氨酰胺,4 500 mg/L葡萄糖)培養于50 mL培養瓶中,置于37 ℃,5%CO2細胞培養箱中培養,每隔1 d換液,待細胞于對數生長期時用于試驗。
1.2.2 MTT比色法檢測細胞增殖活性 取對數生長的9HTE細胞制成1×105/mL接種到96孔細胞培養板內,每孔150 μL,待過夜貼壁后換無血清培養液培養24 h,使細胞同步化于G0期。取出培養板后棄去無血清培養基,給藥組加入噬菌體D29使得每孔終濃度分別為109、107PFU/mL(高滴度組、低滴度組),每孔終體積均為200 μL,以噬菌體緩沖液(phage buffer)為陰性對照孔,均設置4個復孔,置于37 ℃、5%CO2細胞培養箱培養,24 h后,加入MTT(5 g/L)每孔20 μL后放入37 ℃、5%CO2細胞培養箱孵育4 h,以800 r/min,離心5 min,棄去上清液,每孔加入二甲基亞砜150 μL,輕輕振蕩10 min,使紫色結晶完全溶解后,用全波長酶標儀于570 nm檢測吸光度(A)值,該試驗重復3次。細胞存活率=(A給藥組-A空白組)/(A正常組-A空白組)×100%。其中給藥組為試驗干預組,正常組為未做任何處理組,空白組為單純加入MTT細胞培養基組。
1.2.3 ELISA法檢測細胞上清液白細胞介素(IL)-6、IL-8分泌水平 接種處于對數生長期的9HTE氣道上皮細胞懸液以1×105/孔接種于24孔細胞培養板內,每孔500 μL待過夜貼壁后試驗組加入噬菌體D29使每孔的最終濃度分別為109、107PFU/mL(高滴度組、低滴度組),終體積為1 mL,均設置4個復孔;以phage buffer為陰性對照組,脂多糖(LPS,終濃度為10 mg/L)設置為陽性對照組,置入37 ℃、5%CO2細胞培養箱培養,2 d后,收集細胞上清液,3 000 r/min,離心20 min,取上清液,按照ELISA試劑盒說明書操作,測上清液細胞因子IL-6、IL-8水平,該試驗重復3次。
1.2.4 RT-PCR半定量檢測氣道上皮細胞細胞間黏附分子-1(ICAM-1)mRNA的表達 將對數生長的氣道上皮細胞懸液以1×106/瓶接種到細胞培養瓶中,細胞過夜貼壁后加入噬菌體D29使每孔的終濃度分別為109、107PFU/mL(高滴度組、低滴度組),終體積為3 mL;以phage buffer為陰性對照組,置入37 ℃、5%CO2細胞培養箱培養,2 d后按照說明書提取細胞總RNA,反轉錄合成cDNA鏈,加入Tag酶及上、下游引物,在PCR儀上進行PCR擴增。ICAM-1引物核苷酸序列:上游5′-GAG TCT GCT GGG AAT TTT CTG G-3′,下游5′-GAG GTG ACA GTG AAG TGT GAG G-3′,PCR循環參數為:94 ℃ 30 s變性,56 ℃ 30 s退火,共反應30循環;β-actin上游5′-TCC TGT GGC ATC CAC GAA ACT-3′,下游5′-GAA GCA TTT GCG GTG GAC GAT-3′。PCR循環參數為:94 ℃ 30 s變性,58 ℃ 30 s退火,共反應35循環,擴增產物瓊脂糖電泳并掃描成像,計算機軟件分析電泳條帶灰度。
1.2.5 流式細胞儀對氣道上皮細胞凋亡的檢測 臺盼藍記數細胞活力大于95%的氣道上皮細胞105/孔接種于24孔細胞培養板,細胞貼壁后換無血清DMEM培養基24 h,使細胞同步于G0期。試驗組加入噬菌體D29使每孔終濃度分別為109、107PFU/mL(高滴度組、低滴度組),終體積為1 mL;陰性對照組加入phage buffer,均設3個復孔,刺激48 h后,以無二乙胺四乙酸(EDTA)的0.25%胰蛋白酶收集上清液和底壁細胞,以1 000 r/min離心5 min。用無菌PBS洗滌2次,沉淀以500 μL binding緩沖液懸浮細胞,加入5 μL AnnexinV-FITC混勻后再加入5 μL碘化丙啶(PI),室溫避光孵育10 min后立即用流式細胞儀檢測。
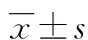
2 結 果
2.1 高、低滴度噬菌體D29對9HTE細胞生長活性 高滴度和低滴度分別作用于氣道上皮細胞9HTE不同時間12、24、48 h后,各組存活率見表1。采用重復測量方差分析,作用時間對9HTE細胞無明顯影響(F=0.892,P=0.427);高、低滴度對細胞生長活性比較差異無統計學意義(F=0.506,P=0.619);作用時間及濃度之間不存在交互作用(F=1.053,P=0.408)。
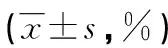
表1 MTT法檢測9HTE細胞增殖存活率結果
2.2 高、低滴度噬菌體D29對9HTE分泌細胞因子的影響
2.2.1 高、低滴度噬菌體D29對9HTE分泌IL-6的影響 用高、低滴度噬菌體D29作用于氣道上皮細胞9HTE 48 h后,各組細胞上清液IL-6水平較少,高滴度組[(1.185±0.114)ng/L]、低滴度組[(1.193±0.932)ng/L]與陰性對照組[(1.238±0.443)ng/L]及正常組[(1.210±0.101)ng/L]兩兩比較差異無統計學意義(F=0.257,P=0.855);陽性對照組[(3.788±0.048)ng/L]與正常組比較細胞因子水平明顯升高,比較差異有統計學意義(t=46.123,P=0.000)。
2.2.2 高、低滴度分別對9HTE分泌IL-8的影響 高滴度組[(0.632±0.042)ng/L]、低滴度組[(0.596±0.163)ng/L]細胞上清液細胞因子IL-8水平與陰性對照組[(0.625±0.003)ng/L]及正常組[(0.609±0.025)ng/L]比較差異無統計學意義(F=1.568,P=0.248);陽性對照組[(0.817±0.016)ng/L]與正常組比較細胞因子水平升高明顯,比較差異有統計學意義(t=14.064,P=0.000)。
2.2.3 高、低滴度噬菌體D29對9HTE細胞表達ICAM-1的mRNA影響 高滴度組(2.76±0.27)和低滴度組(2.75±0.30)各組間ICAM-1 mRNA表達量與陰性對照組(2.84±0.15)和正常組(2.49±0.35)均比較差異無統計學意義(F=0.695,P=0.581),見圖1。

1:高滴度組;2:低滴度組;3:陰性對照組;4:正常組。
圖1 各組9HTE細胞ICAM-1 mRNA的表達
2.2.4 流式細胞儀檢測 高滴度組[(9.82±0.59)%]、低滴度組[(9.98±0.34)%]與陰性對照組[(10.09±0.32)%]、正常對照組[(10.56±0.18)%]凋亡率兩兩比較差異無統計學意義(F=1.992,P=0.194)。
3 討 論
結核病耐藥問題逐漸嚴重,故急需要開發新的抗菌藥物,噬菌體D29裂解譜廣,抗原性較高,能裂解耐藥結核分枝桿菌,故有望用于肺結核病特別是耐藥結核病的治療[5]。結核病以肺部感染最多,通過課題組前期研究表明通過呼吸道給藥噬菌體到達肺部量最多,藥物量維持時間長[4,6],保證其有效性,但目前國內外對噬菌體對氣道上皮的功能及安全性研究甚少。
氣道上皮細胞具有機械屏障作用,同時還有更重要的免疫炎癥防御作用[7],氣道上皮細胞受刺激后可產生多種炎癥介質,募集炎性細胞,誘發異常炎癥反應,造成病理損傷[8]。IL-6在正常氣道上皮細胞極少分泌,但在受刺激后分泌量增加,其主要功能是促進T、B細胞增殖活化,參與炎癥反應,導致機體發熱等,IL-8是一種化學趨化因子,可趨化并激活中性粒細胞到達炎癥部位,發揮作用[9]。而ICAM-1屬于免疫球蛋白超家族成員之一,參與調解炎癥反應,細胞和組織之間分化和發育、免疫反應應答及淋巴細胞歸巢和再循環等一些重要的生理功能[10],也是大部分血清型鼻病毒、呼吸道合胞病毒等多種病毒的受體,受到相關病毒感染時,其ICAM-1表達上調[11-13]。
本試驗研究結果提示:無論是高滴度或是低滴度噬菌體D29對氣道上皮細胞分泌的IL-6、IL-8及氣道上皮細胞的生長活性和ICAM mRNA 的分泌均無明顯影響,表明噬菌體D29本身不會刺激氣道上皮細胞發生炎癥反應,初步表明噬菌體D29對氣道上皮細胞具有較好的安全性,但本試驗僅限于體外試驗,對體內試驗是否安全需要進一步動物試驗證明。
綜上所述,噬菌體D29作用于人氣道上皮細胞一段時間過后,對其生長及功能均無明顯影響,表面噬菌體D29對氣道上皮細胞有較好的安全性,為今后噬菌體生物制劑通過呼吸道治療肺結核感染提供安全性依據。
[1]Rastogi V,Pragya,Verma N,et al.An overview on bacteriophages:a natural nanostructured antibacterial agent[J].Curr Drug Deliv,2016.DOI:10.2174/1567201813666 160406115744.[Epub ahead of print].
[2]Latz S,Wahida A,Arif A,et al.Preliminary survey of local bacteriophages with lytic activity against multi-drug resistant bacteria[J].J Basic Microbiol,2016,56(10):1117-1123.
[3]Peng L,Chen BW,Luo YA,et al.Effect of mycobacteriophage to intracellular mycobacterium smegmatis and mycobacterium tuberculosis in vitro[J].Respirology,2005,10 Suppl:S177.
[4]梁梅,郭述良,張紅梅,等.噬菌體D29不同途徑給入在小鼠體內的代謝分布[J].中國新藥與臨床雜志,2012(5):272-276.
[5]鄔亭亭,劉平,羅永艾,等.分枝桿菌噬菌體D29的生物學特性研究及其抗耐藥結核潛力的探討[J].世界科技研究與發展,2012,34(2):314-317.
[6]楊文慧.分枝桿菌噬菌體D29應用于耐藥結核病治療的探索性研究[D].天津:中國人民解放軍軍事醫學科學院,2009.
[7]Lloyd CM,Saglani S.Asthma and allergy:the emerging epithelium[J].Nat Med,2010,16(3):273-274.
[8]Liu YJ.Thymic stromal lympHopoietin:master switch for allergic inflammation[J].J Exp Med,2006,203(2):269-273.
[9]曹雪濤.醫學免疫學[M].6版.北京:人民衛生出版社,2013:52-55.
[10]唐可京,李幼基,謝汕茂.ICAM-1與VCAM-1 的結構表達與調控[J].醫學分子生物學雜志,2002,24(3):173-177.
[11]Bochkov YA,Gern JE.Rhinoviruses and their receptors:implications for allergic disease[J].Curr Allergy Asthma Rep,2016,16(4):30.
[12]Alves MP,Sch?gler A,Ebener S,et al.Comparison of innate immune responses towards rhinovirus infection of primary nasal and bronchial epithelial cells[J].Respirology,2016,21(2):304-312.
[13]Liu X,Qin X,Xiang Y,et al.Progressive changes in inflammatory and matrix adherence of bronchial epithelial cells with persistent respiratory syncytial virus (RSV) infection (progressive changes in RSV infection)[J].Int J Mol Sci,2013,14(9):18024-18040.
Effects of different titers of bacteriophage D29 on growth and function of airway epithelia cell 9HTE*
LiangMei1,GuoShuliang2△,ZhangHongmei3
(1.DepartmentofRespiratory,People′sHospitalofYubeiDistrict,Chongqing401120,China; 2.DepartmentofRespiratory,theFirstAffiliatedHospitalofChongqingMedicalUniversity,Chongqing400016,China; 3.DepartmentofRespiratory,theFifthPeople′sHospitalofChongqing,Chongqing400062,China)
Objective To research the effects of different titers of bacteriophage D29 on growth and function of airway epithelial cell 9HTE.Methods Cell viability rates was analyzed after applying high(109PFU/mL) and low(107PFU/mL) titers of bacteriophage D29 and phage buffer respectively by MTT colorimetry.Additionally,the secretion levels of IL-6,IL-8 in cell culture supernatant were detected by ELISA.RT-PCR was performed to detect the expression of ICAM-1 mRNA.Cell apoptosis rate was analyzed by flow cytometry.Results There was no difference in cell growth,secretion levels of IL-6,IL-8,ICAM-1 mRNA and cell apoptosis rate between cells treated with high and low titers of D29 and phage buffer(P>0.05).Conclusion Neither high nor low titer of bacteriophage D29 exerts effect on growth and function of airway epithelial cell 9HTE invitro.
bacteriophages;trachea;interleukins;vascular cell adhesion molecule-1;airway epithelial cells;security
10.3969/j.issn.1671-8348.2017.15.003
國家自然科學基金資助項目(81570010)。作者簡介:梁梅(1984-),住院醫師,碩士,主要從事呼吸系統疾病方面研究。△
,E-mail:guosl999@sina.com。
R329.2
A
1671-8348(2017)15-2024-03
2016-11-21
2017-01-09)

