表面等離子體共振免疫傳感器用于快速檢測微囊藻毒素的研究
李 瑩,鐘金鋼,馬 驍,李仕萍,齊 攀
(1.光電信息與傳感技術廣東普通高校重點實驗室,暨南大學,廣東廣州 510632;2.暨南大學預科部,廣東廣州 510610;3.暨南大學光電工程系,廣東廣州 510632;4. 廣東交通職業(yè)技術學院電子工程系,廣東廣州 510650)
表面等離子體共振免疫傳感器用于快速檢測微囊藻毒素的研究
李 瑩1,2,鐘金鋼1,3,馬 驍1,3,李仕萍1,3,齊 攀4,*
(1.光電信息與傳感技術廣東普通高校重點實驗室,暨南大學,廣東廣州 510632;2.暨南大學預科部,廣東廣州 510610;3.暨南大學光電工程系,廣東廣州 510632;4. 廣東交通職業(yè)技術學院電子工程系,廣東廣州 510650)
針對現(xiàn)有微囊藻毒素(MC-LR)檢測方法操作復雜、因標記而污染環(huán)境、儀器貴重,不利于現(xiàn)場快速檢測等問題,將自行研制的表面等離子體共振(SPR)生物芯片檢測儀應用于微囊藻毒素的檢測,提出抑制型SPR生物芯片快速檢測痕量微囊藻毒素的方法。采用該方法分別對濃度為3.5、2.5、1.5、1、0 μg/L的MC-LR樣品進行了檢測。結果表明:該方法檢測限小于1 μg/L,可滿足世界衛(wèi)生組織(WHO)對于飲用水和我國地表水環(huán)境質量標準中MC-LR最低含量檢測的需求。該方法完成一個樣品檢測耗時約8 min,相比于高效液相色譜法(HPLC)和酶聯(lián)免疫吸附法(ELISA)等傳統(tǒng)檢測方法,快速定量是其最大的優(yōu)勢,可用于食品質量監(jiān)控和現(xiàn)場實時檢測。
表面等離子體共振,生物芯片,無標記快速檢測,微囊藻毒素
隨著社會工業(yè)化的發(fā)展,水體富營養(yǎng)化日益嚴重,藍藻水華現(xiàn)象頻頻發(fā)生,產生的藻毒素嚴重威脅人類和動物的健康。藍藻的次生代謝產物微囊藻毒素(Microcystin,MC)出現(xiàn)頻率最高、產生量大且危害最嚴重[1]。MC能引起神經系統(tǒng)異常癥狀,如頭暈、耳鳴、眩暈、頭痛、嘔吐、惡心、輕度耳聾、視力障礙和失明等,造成肝臟等多個器官的損傷[2-4]。在我國長江、黃河、松花江等主要河流以及滇池、上海淀山湖等淡水湖泊中都相繼發(fā)生過藍藻水華污染現(xiàn)象[5]。微囊藻毒素是一類具有生物活性的單環(huán)七肽,分子量900~1200 u,是一種肝毒素,是肝癌的強烈促癌劑[6]。至今已發(fā)現(xiàn)80多種異構體,在淡水環(huán)境中存在較多、毒性較強的是微囊藻毒LR[6],具有水溶性和耐熱性,不揮發(fā),抗pH變化,在水中的自然降解過程十分緩慢。目前,世界衛(wèi)生組織(WHO)推薦的飲用水標準和我國地表水環(huán)境質量標準中規(guī)定MC-LR的標準限量值≤1 μg/L[7]。
MC-LR的檢測常用方法有高效液相色譜法(High Performance Liquid Chromatography,HPLC)、酶聯(lián)免疫吸附法(Enzyme Linked Immunosorbent Assay,ELISA)、液相色譜-質譜/質譜法(Liquid Chromatography-Mass Spectrometry/Mass Spectrometry,LC-MS/MS)等,這些方法的缺點是樣品處理時間長,檢測過程煩瑣、難于操作,使用放射性元素或標記物而污染環(huán)境,儀器價格昂貴且檢測成本高,在實際應用中受到限制[5,8-9]。基于表面等離子體共振(Surface Plasmon Resonance,SPR)的生物芯片是一種生物傳感器,不需要標記就可對分子間的相互作用進行實時監(jiān)測,已被廣泛用于藥物分析、食品分析、環(huán)境監(jiān)測等許多領域[10-14]。
本研究采用自行開發(fā)的便攜式表面等離子體共振(SPR)生物芯片檢測儀,利用免疫反應的特異性,采用競爭型免疫方法檢測微囊藻毒素(MC-LR),分析動力學反應過程,建立標準曲線。
1 材料與方法
1.1 材料與儀器
便攜式SPR生物芯片檢測儀為自行研制,如圖1[15]所示,檢測儀包括光路系統(tǒng)、流路系統(tǒng)、電路(信號探測與控制)系統(tǒng)、軟件(數(shù)據(jù)分析)系統(tǒng)和傳感芯片等部分。光路系統(tǒng)基于目前已應用成熟的Kretschman結構,采用共振角光信號的探測方式。用電學方法控制入射光角度的改變,檢測不同入射角時反射光強的變化,方法簡便易行,系統(tǒng)測量精度可達0.002°。用Labview軟件編寫控制程序,界面友好。

圖1 表面等離子體共振生物芯片檢測儀示意圖Fig.1 System schematic of SPR biochip detector sensor
MC-LR(Microcystin-LR)標準品 TAS(Taiwan Algal Science Inc.),分子量995.2,純度≥95%;MC-LR單克隆抗體(1 mg/mL)、MC-LR和BSA的耦聯(lián)抗原MC-LR-BSA(1 mg/mL) 伊普瑞斯科技有限公司(北京);巰基十一酸[HS(CH2)10COOH]、巰基己酸[HS(CH2)6OH]、乙醇胺(Eth)、十二烷基硫酸鈉(SDS)、N-羥基琥珀酰亞胺(N-Hydroxysuccinimide,NHS)、碳二亞胺[N-ethyl-N′-(dimethylaminopropyl)carbodiimide,EDC] 美國Sigma公司;其它試劑 北京化學試劑公司。免疫反應的緩沖液是PBS緩沖液(2 mmol/L NaH2PO4,2 mmol/L Na2HPO4,150 mmol/L NaCl,pH7.4),MC-LR標準品、MC-LR抗原、MC-LR單克隆抗體用PBS緩沖液稀釋成相應濃度的溶液。
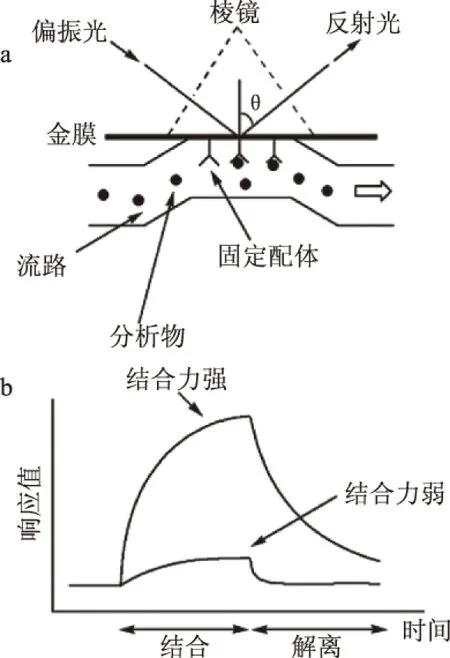
圖2 表面等離子體共振傳感器檢測過程示意圖Fig.2 Application example of Kretschmann SPR detector注:(a)SPR傳感芯片工作示意圖;(b)免疫反應結果簡圖。
1.2 檢測原理
利用SPR進行生物(免疫反應)實驗時,一般還要在傳感芯片表面固定一種反應物,使其形成分子敏感膜;然后含待測物的樣品通過流路系統(tǒng)進入傳感芯片,傳感芯片上分子間相互作用的情況可由SPR信號(共振波長或者共振角)的改變反映出來,并通過計算機軟件將整個反應過程顯示和記錄下來[16-17]。圖2[16]為Kretschmann型SPR檢測儀器的傳感芯片的工作示意圖和免疫反應實驗結果簡圖。圖2a中,金膜上用共價交聯(lián)法固定了配體,當含有匹配的受體的樣品流經芯片表面時,親和反應將分析物(受體)捕獲在膜表面,引起折射率的增加,反射光的共振狀態(tài)也會相應改變;圖2b為典型的免疫反應響應曲線,通過注入含有待檢測物質和不含有待檢測物質的緩沖液,可實時監(jiān)測被分析物結合與解離的過程。如圖2b所示,隨著反應時間(橫坐標)的改變,待測樣品折射率產生變化,從而引起新的共振波長或者共振角度(縱坐標)。因此,可根據(jù)表面等離子體共振時入射光波長或者角度與金屬薄膜表面液體折射率的關系來探測生物分子間的相互作用。
1.3 生物芯片的制備
本實驗所用生物芯片的基底為直徑20 mm厚度1 mm的圓形玻璃片,上面沉積50 nm的金,然后通過自組裝單層分子膜(Self-Assembled Monolayer,SAM)技術對金膜進行修飾,固定生物探針。香柏油的折射率與玻璃相近,由香柏油作為耦合劑,將鍍有金膜的傳感芯片安放到儀器上。安裝流通系統(tǒng),通入PBS緩沖液,基線穩(wěn)定幾分鐘后進行生物芯片的自組裝,通入0.1 mmol/L的HS(CH2)10COOH(巰基十一酸)和0.9 mmol/L的HS(CH2)6OH(巰基己酸)的乙醇溶液,對金膜表面進行化學修飾2 h。修飾液中的巰基與金鍵合,形成羧基。通入PBS緩沖液清洗,形成整個反應的基線。基線穩(wěn)定后加入0.1 mol/L的NHS和0.1 mol/L的EDC混合液(1∶1,v/v),活化芯片表面15 min,將芯片表面的羧基活化成活潑酯。然后用PBS沖洗2 min,芯片修飾完畢。然后進行生物探針的固定,在修飾和活化后的生物芯片表面固定稀釋了30倍的微囊藻毒素衍生物(MC-LR-BSA)作為生物探針,此時SPR響應值逐漸升高,30 min后通入PBS沖洗2 min,響應值高于探針固定前,說明探針固定效果較好。加入1 mol/L的乙醇胺(pH8.5)封閉滅活剩余的酯鍵,2~4 min,PBS沖洗后,生物芯片制備完成,可用于下一步的免疫檢測。
2 結果與分析
2.1 抗體工作濃度的確定
微囊藻毒素MC-LR的分子量是995.2,如果生物芯片表面固定抗體,MC-LR能與抗體結合,但對芯片表面附近的折射率影響較小,SPR共振峰的變化小,導致檢測限偏高,因此MC-LR分子不適于直接法檢測。為了對MC-LR痕量物質檢測,提出抑制型SPR生物芯片檢測方法。將MC-LR-BSA固定在生物芯片表面,作為生物探針,不同濃度的微囊藻毒素分子與過量抗體混合,各組樣品中抗體為固定的工作濃度,靜置5 min后,通入生物芯片表面,檢測SPR效應,分析動力學過程。每個樣品測試完畢,通入PBS緩沖液和1%的SDS溶液,進行洗脫和再生,使SPR響應值回到基線。SPR生物芯片抑制免疫法檢測微囊藻毒素的過程示意如圖3所示。
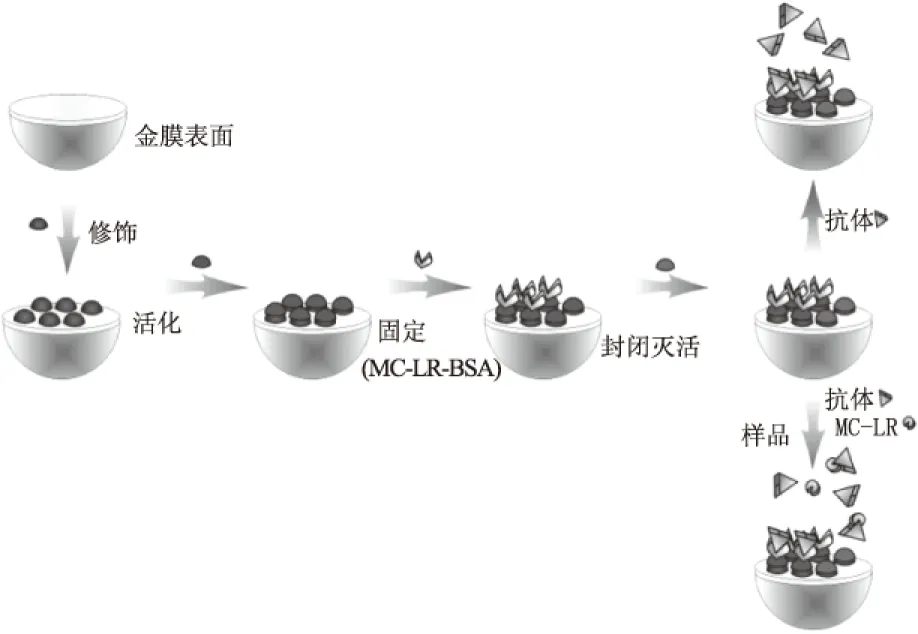
圖3 MC-LR表面等離子體共振免疫檢測示意圖Fig.3 Scheme of MC-LR immune detection by surface plasmon resonance
為了確定抗體工作濃度,在生物芯片表面固定MC-LR-BSA,MC-LR單克隆抗體用PBS稀釋1、2、3、10 mg/L,分別作為檢測樣品,比較各組樣品的SPR響應值,作為選擇工作抗體濃度的依據(jù)。抗體濃度的選擇主要考慮兩點[6]:一是適當?shù)慕Y合值。結合值高,抗體濃度高,抑制濃度隨之增大,檢測限也將提高;結合值低,抗體濃度低,競爭抑制曲線工作范圍變小[18]。二是抗體的消耗量。由于抗體的制備成本較高,抗體消耗量大,會導致檢測成本增加。由圖4可見,在同樣的進樣量和進樣速度等實驗條件下,10 mg/L單克隆抗體的結合值最大,1 mg/L單克隆抗體的結合值最小。結合值大,抑制濃度隨之增大,抗體消耗量也大,會增加檢測成本;結合值小,檢測范圍相應減小。因此,綜合考慮檢測成本和檢測范圍,最后選擇3 mg/L為抗體工作濃度,檢測范圍是1~4 μg/L。
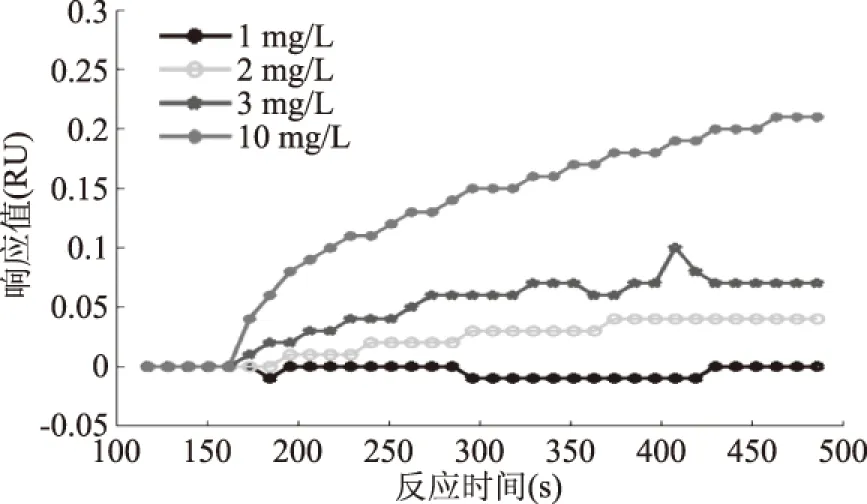
圖4 抗體與生物探針免疫反應的動力學曲線Fig.4 Immune response kinetic curves of antibody and biological probes
用PBS緩沖液稀釋MC-LR抗體,與微囊藻毒素分子樣品混合,靜置5 min,讓兩者充分反應。混合物通入生物芯片表面,記錄SPR響應值的動態(tài)變化。上述混合物中的微囊藻毒素分子和生物芯片表面的探針MC-LR-BSA都可以與混合物中的抗體結合,即微囊藻毒素分子抑制探針MC-LR-BSA(和探針競爭關系)與微囊藻毒素抗體的結合。
2.2 芯片穩(wěn)定性測試
為了測試芯片的穩(wěn)定性,以10 mg/L的MC-LR單克隆抗體作為檢測樣品,與芯片表面探針MC-LR-BSA發(fā)生免疫反應,以1%的SDS為再生液,重復20次,測試芯片的穩(wěn)定性,其中第1次、第10次和第20次測試的免疫反應曲線如圖5所示。求得20次測量的平均結合值(SPR響應)為0.2055 RU,標準偏差為0.058,相對標準偏差為2.7%,可見芯片結合以及再生均穩(wěn)定。

圖5 生物芯片重復性測試曲線Fig.5 Repeatability test curve of biological chip
2.3 抑制法檢測微囊藻毒素的標準曲線和檢測限
用PBS緩沖液稀釋MC-LR抗體,與一組微囊藻毒素分子樣品混合,靜置5 min,讓兩者充分反應。在混合物中抗體的終濃度為3 mg/L,微囊藻毒素分子的終濃度分別為0、1、1.5、2.5、3.5 μg/L。混合物通入生物芯片表面,記錄SPR響應值的動態(tài)變化。抗體的分子量較大,抗體與芯片表面的探針結合后,抗原-抗體結合物引起SPR響應值變化大,則樣品中微囊藻毒素分子的濃度與SPR響應值的變化成反比。如果樣品中微囊藻毒素濃度小,則更多的微囊藻毒素抗體與生物芯片表面探針結合,SPR響應值即共振角的變化大。免疫反應約8 min后,結束檢測,通入PBS溶液和1%的SDS溶液,進行洗脫和再生,使抗原-抗體結合物分解,然后PBS緩沖液清洗2 min,SPR響應值可回到免疫反應前的基線,可用于下組樣品的檢測。
圖6是該組樣品通入芯片表面,抑制法檢測微囊藻毒素分子時的動力學曲線,當樣品中微囊藻毒素濃度大時,可與芯片表面探針結合的微囊藻毒素抗體的數(shù)量少,免疫反應速度慢,SPR響應值低,微囊藻毒素分子濃度與SPR響應值成反比。

圖6 抑制法檢測MC-LR的動力學曲線Fig.6 Kinetic curve of detection of MC-LR by inhibition assay
圖7是抑制法檢測微囊藻毒素分子的標準曲線,用免疫反應6 min時的響應值作為縱坐標,微囊藻毒素濃度作為橫坐標,曲線近似呈倒“S”型,檢出限小于1 μg/L,可滿足WHO對于飲用水和我國地表水環(huán)境質量標準中MC-LR的標準限量值≤1 μg/L的檢測需求。由未知濃度的待測樣品SPR響應值,查詢標準曲線,可得出樣品中微囊藻毒素的濃度。由圖6可見,一個樣品的檢測耗時約8 min,相比于HPLC和ELISA等傳統(tǒng)檢測方法[19],其快速定量是最大的優(yōu)勢,該裝置和方法可用于食品質量監(jiān)控和現(xiàn)場實時檢測。
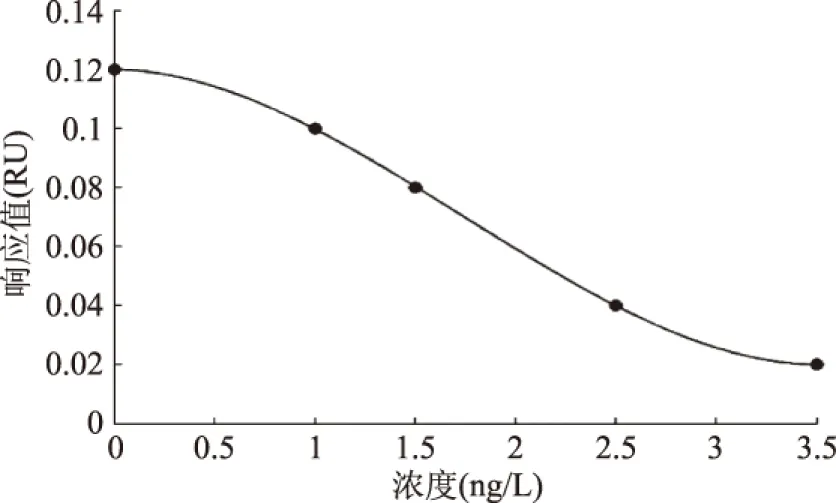
圖7 抑制法檢測MC-LR的標準曲線Fig.7 Standard curve of MC-LR detection by inhibition assay
3 結論
提出抑制型SPR生物芯片快速檢測痕量微囊藻毒素的方法。實驗結果表明所建立的研究方法檢測限小于1 μg/L,可滿足WHO對于飲用水和我國地表水環(huán)境質量標準中MC-LR最低含量檢測的需求,本研究采用的抗體工作濃度是3 mg/L,如果降低抗體工作濃度,還可以降低微囊藻毒素分子樣品的檢出限。與常用的ELISA等方法相比,SPR生物芯片檢測方法具有設備便攜、樣品前處理簡單、免標記、特異性強、操作簡便、對環(huán)境無污染、成本低、可快速給出定量結果等優(yōu)點,可進行現(xiàn)場大量樣品的實時連續(xù)檢測和快速篩選,適用于超市、集市、工廠等需要實時檢測的場所,進行質量監(jiān)控。
[1]Carmichael W W. The Cyanotoxins[J]. Advances in Botanical Research,1997,27:211-256.
[2]徐瀟穎,劉柱,梁晶晶,等. 全自動固相萃取-高效液相色譜法同時測定飲用水中3種微囊藻毒素[J]. 食品工業(yè)科技,2016,37(18):60-62.
[3]Arzate-Cárdenas M A,Olvera-Ramírez R,Martínez-Jerónimo F. Microcystis,toxigenic strains in urban lakes:a case of study in Mexico City[J]. Ecotoxicology,2010,19(19):1157-1165.
[4]Peng F,Xue H H,Chen W C,et al. Investigation on simultaneous determination of deltamethrin,carbaryl,microcystin-LR and benzo[a]pyrene by online SPE-HPLC method[J]. Advanced Materials Research,2014,1073-1076:575-578.
[5]梁麗麗,弓愛君,李紅梅,等. 高效液相色譜法檢測水體中微囊藻毒素[J]. 分析化學,2010,38(5):740-742.
[6]周宏敏,歐惠超,任鵬,等. 利用SPR技術測定湖水中微囊藻毒素[J]. 中國環(huán)境科學,2012,32(7):1284-1287.
[7]Yamamura S,Bartram J,Csanady M,et al. Drinking water Guidelines and standards[C]. World Health Organization,Geneva,Switzerland,2004.
[8]Yu T,Xie P,Dai M,et al. Determinations of MC-LR and[Dha7]MC-LR concentrations and physicochemical properties by liquid chromatography-tandem mass spectrometry[J]. Bulletin of Environmental Contamination & Toxicology,2009,83(5):757-760.
[9]Nagata S. Development and application of highly sensitive anti-immune complex ELISAs for microcystins in tap water[J]. Food & Agricultural Immunology,2010,12(3):231-241.
[10]Li S P,Zhong J G. Simultaneous amplitude-contrast and phase-contrast surface plasmon resonance imaging by use of digital holography[J]. Biomedical Optics Express,2012,3(12):3190-3202.
[11]Espiritu R A,Matsumori N,Murata M,et al. Interaction between the marine sponge cyclic peptide theonellamide a and sterols in lipid bilayers as viewed by surface plasmon resonance and solid-state 2H nuclear magnetic resonance[J]. Biochemistry,2013,52(14):2410-2418.
[12]Homola J,Lu H B,Yee S S. Dual-channel surface plasmon resonance sensor with spectral discrimination of sensing channels using dielectric overlayer[J]. Electronics Letters,1999,35(13):1105-1106.
[13]Nelson B P,Grimsrud T E,Liles M R,et al. Surface plasmon resonance imaging measurements of DNA and RNA hybridization adsorption onto DNA microarrays[J]. Analytical Chemistry,2001,73(1):1-7.
[14]Yuk J S,Kim H S,Jung J W,et al. Analysis of protein interactions on protein arrays by a novel spectral surface plasmon resonance imaging[J]. Biosensors and Bioelectronics,2006,21(8):1521-1528.
[15]齊攀,鐘金鋼,李瑩,等. 用于食品安全檢測的便攜式表面等離子體共振生物傳感器[J]. 光電工程,2014(3):22-27.
[16]Schasfoort R B M,Tudos A J. Handbook of surface plasmon resonance[M]. Royal Society of Chemistry,2008.
[17]Karlsson R. SPR for molecular interaction analysis:a review of emerging application areas[J]. Journal of Molecular Recognition,2004,17(3):151-161.
[18]王曉萍,詹舒越,羅昭鋒,等. 地表水微囊藻毒素的表面等離波子共振免疫檢測方法研究[J]. 光學學報,2012,32(2):0212005-1-0212005-6.
[19]郭偉,黑亮,楊燕婷,等.固相萃取-高效液相色譜法優(yōu)化測定飲用水中的微囊藻毒素[J]. 廣東農業(yè)科學,2014,1:146-148.
Research of the surface plasmon resonance immunosensor for rapid detection of microcystin
LI Ying1,2,ZHONG Jin-gang1,3,MA Xiao1,3,LI Shi-ping1,3,QI Pan4,*
(1.Laboratory of Optoelectronic Information and Sensing Technologies of Guangdong Higher Education Institutes,Jinan University,Guangzhou 510632,China;2.Pre-university,Jinan University,Guangzhou 510610,China;3.Department of Optoelectronic Engineering,Jinan University,Guangzhou 510632,China;4.Department of Electronics Engineering,Guangdong Communication Polytechnic,Guangzhou 510650,China)
As the existing pesticide detection methods were complicated,would pollute the environment by marking,with precious instrument,and not conducive to on-site rapid detection,the self-developed surface plasmon resonance biological chip detector was used in the detection of microcystin(MC-LR),a method for rapid detection of microcystin by inhibiting type SPR biological chip was proposed. The competitive inhibition immunoassay was preceded in MC-LR with concentrations of 3.5,2.5,1.5,1,0 μg/L. The experimental results showed that the detection limit could be 1 μg/L which could meet the needs of the World Health Organization(WHO)for detecting the minimum content of MC-LR in drinking water and surface water environmental quality standards in China. The detection of 1 sample would take about 8 min by this method,compared with the traditional methods such as high performance liquid chromatography(HPLC)and enzyme linked immunosorbent assay(ELISA),the rapid and quantitative was the biggest advantage of this method. The established device and method could be used for food quality monitoring and on-site real-time detection.
surface plasmon resonance;biochip;label free rapid detection;microcystin
2016-08-26
李瑩(1976-),女,博士,教授,主要從事生物醫(yī)學信息技術研究,E-mail:916407691@qq.com。
*通訊作者:齊攀(1982-),男,博士,副教授,主要從事光電檢測技術方面的研究,E-mail:82381299@qq.com。
國家自然科學基金項目(61605063和41206081);廣東省自然科學基金項目(2014A030310483和2015A030310458);廣東省高等職業(yè)院校珠江學者崗位計劃資助項目(2016年度)。
TS207.3
A
1002-0306(2017)05-0304-5
10.13386/j.issn1002-0306.2017.05.049

