喹賽多及其兩種代謝產物在大鼠體內消除規律研究
斯琴朝克圖黃玲利袁宗輝?
(1.湖北工程學院生命科學技術學院,湖北省植物功能成分利用工程技術研究中心,湖北孝感432000;2.國家獸藥殘留基準實驗室(HZAU)/農業部食品安全評價重點開放實驗室,國家獸藥安全評價實驗室,華中農業大學動物醫學院,武漢430070)
喹賽多及其兩種代謝產物在大鼠體內消除規律研究
斯琴朝克圖1,2,黃玲利2,袁宗輝2?
(1.湖北工程學院生命科學技術學院,湖北省植物功能成分利用工程技術研究中心,湖北孝感432000;2.國家獸藥殘留基準實驗室(HZAU)/農業部食品安全評價重點開放實驗室,國家獸藥安全評價實驗室,華中農業大學動物醫學院,武漢430070)
通過喹賽多(Cyadox,CYX)在大鼠體內消除規律研究,了解其對食品安全的影響,并為今后的藥理學和毒理學研究提供較為詳細的數據基礎,研究建立了喹賽多及其兩種主要代謝產物脫二氧喹賽多(BDCYX)和喹噁啉-2-羧酸(QCA)的提取和HPLC檢測方法,并以大鼠作為研究載體,按推薦劑量連續混飼給藥7 d后,研究喹賽多及其兩種代謝物在血漿、肌肉、肝臟中消除規律;一次性灌胃給藥后研究喹賽多及其兩種代謝物在排泄物中的消除規律特點。結果表明,CYX和BDCYX在0~24 h和24~48 h時間段的糞便中可大量檢出,在血漿、肌肉、肝臟和尿液中未檢出;QCA在6 h的肌肉中有少量殘留,在肝臟中一直到72 h還有一定量的殘留,在血漿和糞便中未發現其存在。本研究結果為今后喹賽多在體內處置研究提供了可直接借鑒的技術手段和理論基礎。
喹賽多;脫二氧喹賽多;喹噁啉-2-羧酸;消除規律
喹賽多(Cyadox,CYX),化學名為2-喹噁啉亞甲肼基氰基乙酸-1,4-二氧化物,卡巴氧、喹乙醇等同屬于喹噁啉-N-1,4-二氧化物的衍生物[1],是一種新型的具有抗菌促生長類飼料添加劑,是喹乙醇的換代產品,用于豬、牛、禽類養殖生產[2]。卡巴氧和喹乙醇等同類藥物已經被不同文獻報道證明有較強的毒副作用,已被不同國家和地區限制和禁止使用[3]。喹賽多是喹噁啉類藥物的新品種,大量研究證明,喹賽多可以促進畜禽的生長[4-6],且與同類藥物相比毒性小,安全性好[7-9],是一種比較理想的抗菌藥物促生長劑。目前CYX在動物體內吸收、分布、代謝和排泄特點不明確,對食用其可食性組織的人體產生的藥理學毒理學相關研究亦不完整,其食品動物中的合理應用方面的參考數據不充分。本文以大鼠作為研究載體,針對CYX原形及其已經擁有權威對照品的兩種重要代謝產物脫二氧喹賽多(BDCYX)和喹噁啉-2-羧酸(QCA)建立定量分析方法,采用推薦劑量連續混飼給藥7 d和一次性灌胃給藥的方法,研究喹賽多及其代謝產物在大鼠血漿、肌肉、肝臟和排泄物中消除規律。旨在為CYX藥理學和毒理學評價提供可以借鑒的檢測方法和相關消除規律特性的研究數據。
1 材料與方法
1.1 儀器與設備 Waters高效液相色譜系統:由Waters 600 controller,717plus Autosampler和2996 Photodiod Array detector組成(美國Waters公司);高速冷凍離心機,HITACHICR21G型(日本日立公司);固相萃取裝置(美國安捷倫公司)。
1.2 藥物與試劑 CYX(純度99.8%;批號20070806),由華中農業大學獸藥研究所合成;BD?CYX(純度99.8%;批號20080721),由華中農業大學獸藥研究所合成;QCA(純度97%;批號2010CJ)美國SIGMA-ALDRICH公司。
偏磷酸甲醇溶液:稱取偏磷酸100 g,加入水,加熱沸騰至溶解,冷卻后加入甲醇200 m L,然后再加水定容至1000 mL,混勻,配置成5%偏磷酸10%甲醇水溶液。
磷酸緩沖液(0.01 mol/L):稱取磷酸氫二鉀(K2HPO4·3H2O)2.28 g,置于1000 m L容量瓶中,加入900 mL水溶解,濃磷酸調pH值至7.0,加水定容至1000 mL。
1.3 試驗動物 成年W istar大鼠30只(購自湖北省疾病預防控制中心,中國武漢),公母各半,開始給藥時的大鼠體重為202±18.10 g。每只大鼠分別在不銹鋼代謝籠內適應飼養一周,環境溫度控制在20~26℃,相對濕度40~70%,維持12 h光照,非給藥期間自由采食不含藥物的全價日糧,觀察大鼠每日健康狀況。
1.4 樣品提取與凈化
1.4.1 血漿中CYX和BDCYX的提取與凈化血樣4000 rpm離心10min,取上層血漿0.3mL,加入甲醇0.3mL,旋渦混合3min,10000 rpm,4℃離心10 min,取上清液20μL供HPLC檢測。
1.4.2 組織樣品和排泄物中CYX和BDCYX的提取與凈化 精密稱取勻漿后的組織樣品和糞便2 g、尿液2mL,加蒸餾水1mL后混勻。另加入乙酸乙酯4mL,旋渦混合3min,超聲約1min,靜置10min,10000 rpm離心10min,取上清液。殘渣用上述提取步驟重復兩次,合并三次抽提液,在50℃水浴中氮氣吹干。加入乙腈2 mL溶解殘渣,旋渦混合1~2 min,分別加正己烷3 mL,旋渦混合1~2 min,靜置5 min,去脂肪層,重復去脂2~3次。乙腈層50℃水浴中氮氣吹干,20%乙腈/水1.0mL溶解殘渣,旋渦混合1~2min,靜置。上清液供HPLC檢測。
1.4.3 血漿、組織樣品和排泄物中QCA的提取與凈化 稱取勻漿肌肉組織2 g置于具塞離心管中,加5%偏磷酸10%甲醇溶液8 mL,旋渦混合2~3 min,在25℃下6000 rpm離心15 min,取出上清液,然后再向組織樣品中加5%偏磷酸10%甲醇溶液8 mL重復提取一次,合并2次上清液。上清液中加乙酸乙酯8 mL,旋渦混合1 min,8000 rpm離心10 min,取有機相層,再加乙酸乙酯8 mL重復提取,合并2次有機相。有機相中加磷酸鹽緩沖液6 mL,旋渦混和2~3 min,放置10 min,使下層清晰,收集水相。另用磷酸鹽緩沖液6 mL提取乙酸乙酯相一次。使水相清晰,合并2次水提取液。
稱取勻漿肝臟樣品2 g(血漿和尿液2 mL,糞便2 g)置于具塞離心管中,加5%偏磷酸10%甲醇溶液8 mL,旋渦混合2~3 min,在25℃下6000 rpm離心15 min,取出上清液,然后再向組織樣品中加5%偏磷酸10%甲醇溶液8 mL重復提取一次,合并2次上清液。于上清液中加乙酸乙酯8 mL,旋渦混合2~3 min,8000 rpm離心10 min,取有機相層,再加乙酸乙酯8 mL重復提取,合并2次有機相。其余步驟同肌肉樣品處理方法。
MAX柱依次用甲醇3mL、水3mL活化。加樣品提取液至MAX柱中,控制流速小于3 mL/min,先后用0.05 mol/L NaOH 3 mL,甲醇3 mL淋洗,抽干,2%甲酸甲醇溶液3 mL洗脫,洗脫液置45~50℃水浴氮氣吹干,加20%乙腈/水1.0 mL溶解殘渣,旋渦混勻,待測。
1.5 色譜條件 色譜柱為Agilent Eclipse XDB-C18,5μm,250 mm×4.6 mm。流動相為乙腈-水(20∶80 V/V)分離CYX和BDCYX。乙腈-1%甲酸水溶液(20∶80 V/V)分離QCA。波長為CYX 305 nm,BDCYX 280 nm,QCA 320 nm。流速為1.0 mL/min。進樣量CYX和BDCYX為20μL,QCA為40μL,柱溫:30℃。
1.6 喹賽多,脫二氧喹賽多和喹噁啉-2-羧酸的消除規律研究
1.6.1 血漿、肌肉和肝臟中消除規律研究 20只大鼠分成5組,每組4只,公母各半,按促生長作用最大推薦劑量混飼(100 mg/kg)連續給藥7 d。另設空白組4只大鼠,公母各半,每只大鼠單獨放入代謝籠內,同法給空白飼料,飼養條件同上。停藥后,在6 h,1 d,3 d,7 d和14 d等時間點隨機放血宰殺一組動物,血液收集于含有1%肝素生理鹽溶液0.1 mL的10 mL離心管內,稱重,離心,取血漿,動物解剖后收集其肌肉和肝臟,稱重后立即用HPLC檢測。
1.6.2 排泄規律研究 6只大鼠,公母各半,每只大鼠單獨放入代謝籠內,用0.5%羧甲基纖維素鈉(CMC)將CYX配制成2 mg/mL的混懸液,按每只大鼠10 mg/kg bw(相當于按促生長最大推薦劑量混飼給藥100 mg/kg的一日藥物攝入量),分別一次性灌胃給藥。給藥后,分別在0~12、12~24、24~48、48~72、72~96、96~120、120~144和144~168 h時間段收集尿液和糞便,每次收集后稱重,立即用上述方法制樣,檢測。另3只大鼠不給藥,分別收集未給藥大鼠糞便和尿液作為空白樣。
2 結 果
2.1 定量分析方法確定
2.1.1 色譜分離 經流動相的組成,比例、柱溫、檢測波長等進行篩選和優化,確定了CYX、BDCYX和QCA的色譜分離條件,均以二極管陣列方法掃描,結果顯示,CYX、BDCYX和QCA的最大吸收波長分別為305、280和320 nm;保留時間分別為6.8、22.2和6.6min。其標準溶液色譜圖見圖1。
2.1.2 線性范圍、回歸方程、檢測限及定量限分別取CYX,BDCYX,QCA標準貯備液適量,用流動相稀釋成濃度為0.01、0.02、0.04、0.08、0.16、0.32、0.64、1.00、2.00μg/mL的標準工作液,進行HPLC測定,每個濃度的標準工作液測定3次。不同時間內重復上述操作3次。將各濃度與對應峰面積均值作線性回歸,即得線性方程。結果表明,CYX、BDCYX和QCA標準溶液線性范圍為0.02~2.00μg/mL時,其線性方程分別為:y=122100x+1978.8(r=0.9996)、y=81486x+1415.2(r=0.9996)、y=82807x-1831.1(r=0.9997)。
通過測定不同濃度三種化合物的信噪比(S/N),確定其檢測限(S/N=3)和定量限(S/N=10)。CYX、BDCYX和QCA在血漿、肌肉和肝臟中的最低檢測限均為10μg/kg,最低定量限分別為20、25、20μg/kg;三種化合物在尿液和糞便樣品中的最低檢測限均為100μg/kg,最低定量限分別為250、250、200μg/kg。

圖1 CYX(1.00μg/m L)、BDCYX(1.00μg/m L)和QCA(0.10μg/m L)標準溶液色譜圖
2.1.3 回收率與精密度 向空白組織樣品中加入適量標準溶液,使三種化合物在血漿、肌肉、肝臟中的濃度分別為20、40、80μg/kg,尿液和糞便中的濃度分別為250、500、1000μg/kg,按照樣品制備方法處理后經HPLC檢測。回收率采用單點校正法計算。同一天內每個濃度5個平行,取平均值,計算日內相對標準偏差;每種組織重復5 d,計算日間相對偏差。CYX、BDCYX和QCA在大鼠血漿、肌肉、肝臟、尿液和糞便中的添加回收率和日間相對標準偏差見表1。當QCA的回收率在72%~106%,批內標準偏差為3.64%~10.23%,批間標準偏差為4.67%~9.57%;CYX的回收率范圍在72%至85%之間,批內標準偏差為2.94%~8.56%,批間標準偏差為4.60%~10.23%;BDCYX的回收率范圍在73%~88%之間,批內標準偏差為2.99%~9.51%,批間標準偏差為3.94%~11.04%;均滿足定量分析方法需要。
2.2 連續混飼給藥7 d停藥后血漿和組織中三種化合物消除規律 大鼠連續混飼給藥7 d,停藥后CYX、BDCYX和QCA在血漿肌肉和肝臟中的濃度見表2。檢測結果表明,大鼠連續混飼CYX 7 d停藥后,血漿、肌肉和肝臟中未檢測到CYX原形,BDCYX濃度低于檢測限。停藥后6 h的肌肉中檢到微量QCA(16.68μg/kg),其含量在定量限以下(圖2);肝臟中一直能檢測到72 h(圖3);在血漿中未檢測到QCA。
2.3 一次性灌服CYX后排泄物中三種化合物的消除規律 大鼠一次性灌服CYX后CYX、BDCYX和QCA在排泄物中的濃度見表3。檢測結果表明,給藥后0~24 h和24~48 h時間段的尿液中大量檢出QCA(圖4),之后時間段的QCA含量均在檢測限以下。尿液中始終未檢測到CYX原形,BDCYX的含量在檢測限以下。糞便中0~24 h和24~48 h均能檢測到大量CYX和BDCYX(圖5),之后,CYX和BDCYX均在檢測限以下。糞便中未檢測到QCA。
3 討 論
3.1 代謝產物檢測方法的確定 本研究的主要研究對象為CYX原形及其兩種主要代謝產物BD?CYX及QCA。CYX原形及其脫氧代謝產物的提取檢測方法相關報道都基本相似[2,5,10]。血漿提取方法是加入同體積甲醇,離心沉淀蛋白,取上清液直接用HPLC檢測。可食性組織用乙酸乙酯或乙腈提取,正己烷去脂。糞便用乙酸乙酯或乙腈提取,薄層板分離純化。如黃麗娜[11]建立了雞蛋中CYX和BDCYX的提取方法。勻漿雞蛋中依次加入濃鹽酸溶液混合,用乙腈/氯仿(1∶4,V/V)提取,正己烷去脂。在已有報道的基礎上,本研究綜合CYX和BDCYX等化合物的性質,建立了大鼠體內代謝產物的提取檢測方法。血漿中的提取方法仍采取已有方法,加入同體積甲醇,離心沉淀蛋白,取上清液直接檢測。采用此方法的樣品中,包涵了與蛋白質緊密結合的代謝產物之外的所有游離代謝產物,可在后期利用放射性示蹤方法進行CYX在體內的處置研究。其它組織采取乙酸乙酯提取,正己烷去脂的方法。尿液和糞便中加入同重量的甲醇/水(1∶1,V/V)混合,乙酸乙酯提取,用正己烷去脂,適當稀釋后直接用乙腈-水(20∶80V/V)作為流動相,分離CYX和BDCYX,可省去薄層板分離純化步驟,方法簡便,而且得到了很好的檢測效果。
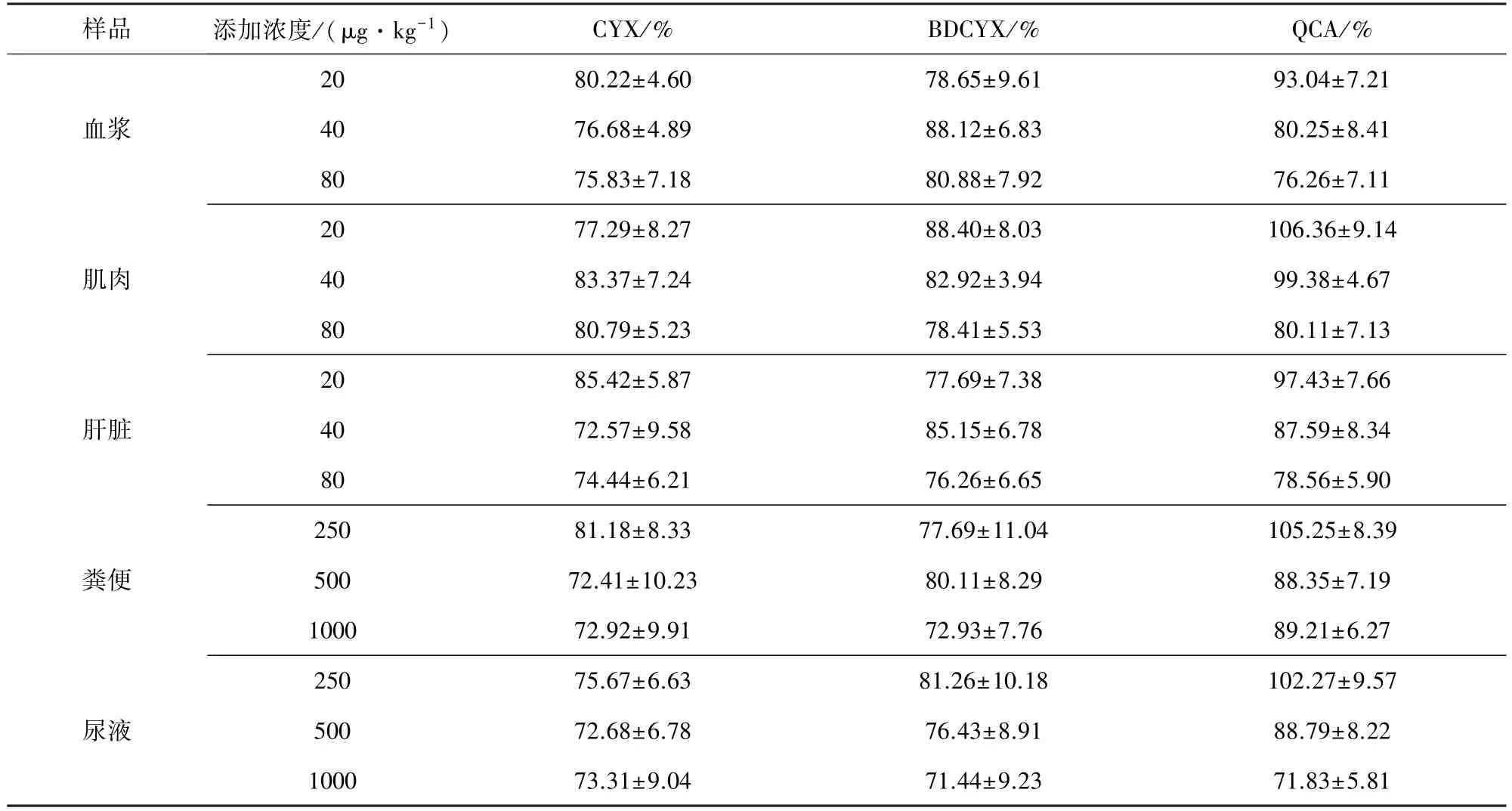
表1 CYX、BDCYX和QCA在大鼠血漿、肌肉、肝臟和排泄物中的添加回收率(n=5)
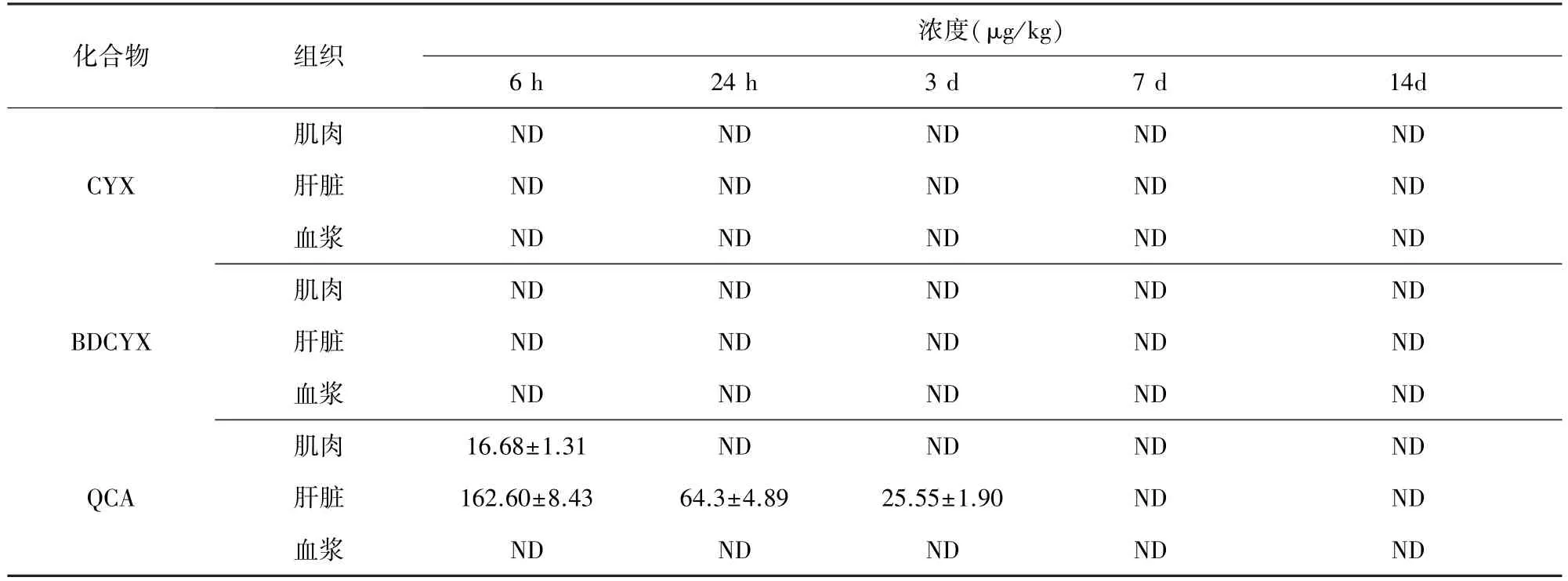
表2 大鼠連續混飼給藥7 d停藥后CYX、BDCYX和QCA在血漿、肌肉和肝臟中的濃度(n=6)
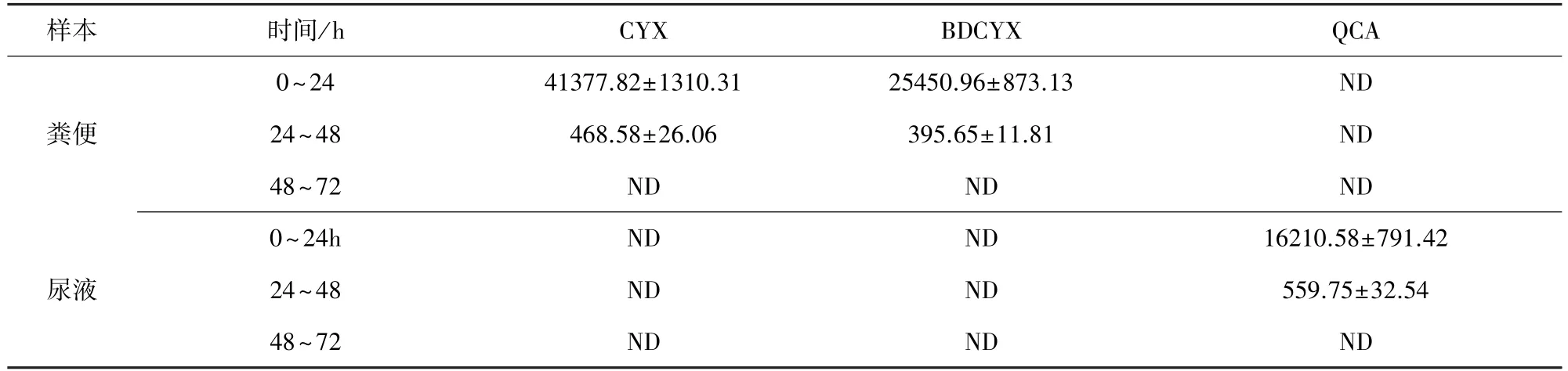
表3 大鼠一次性灌服CYX后CYX、BDCYX和QCA在排泄物中的濃度(μg/kg)
圖2 在停藥后6 h宰殺的大鼠肌肉中QCA色譜圖(A:6 h;B:空白)
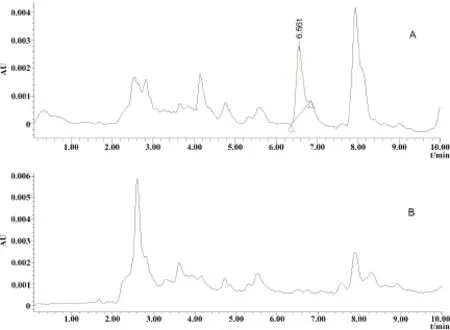
圖3 在停藥后6 h宰殺的大鼠肝臟中QCA色譜圖(A:6 h;B:空白)
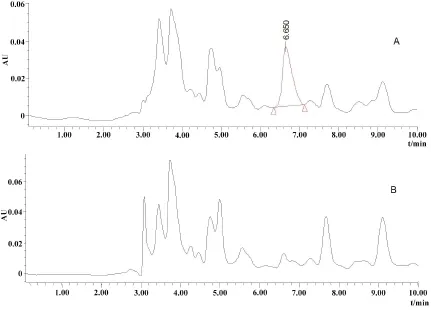
圖4 在給藥后0~24 h的大鼠尿液中QCA色譜圖(A:6 h;B:空白)
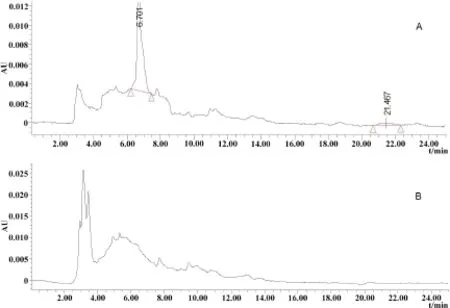
圖5 在給藥后0~24 h的大鼠糞便中CYX和BDCYX色譜圖(A:6 h;B:空白)
對于QCA的提取和檢測方法,Sestakova等[12]采用極譜法分析豬體內喹賽多及其代謝產物,未直接檢測到QCA,卻檢測到了喹噁啉-2-甲酰基-甘氨酸。說明QCA是以結合態存在。因此,之后的研究方法中先水解結合態物質,再針對QCA建立提取凈化和檢測方法。如,2002年Hutchinson等[13]采用熱堿性條件下水解樣品45 min以上,然后經濃鹽酸酸化后,用乙酸乙酯可提取到豬肝臟中的QCA。2004年Sin等[14]建立了豬肝臟組織中QCA的GC-MS分析方法,采用偏磷酸甲醇溶劑在酸性環境下水解,乙酸乙酯提取,耗時較短。2003年邱銀生[10],2005年黃玲利[5]均采用濃NaOH水解,濃鹽酸酸化后,用乙酸乙酯提取,離子交換層析柱純化的方法,此方法耗時,步驟復雜。2005年Hutchinson等[15]采用酶解方法,破壞組織樣品中氨基酸與QCA的結合,再用乙酸乙酯提取樣品,但耗時長,一般需要16 h以上。Wu Y等[16]采用了5%偏磷酸10%甲醇提取方法提取了QCA。試驗證明,5%偏磷酸10%甲醇提取QCA方法操作簡便,回收率穩定。綜合上述提取方法的優缺點和本文研究目的,用5%偏磷酸10%甲醇提取,MAX柱分離雜質,采用與CYX和BDCYX基本相同的色譜系統,用乙腈-1%甲酸水溶液(20∶80V/V)分離QCA。在后期用放射性示蹤方法研究CYX在體內處置特點時,相關結合產物的分離和檢測均可借鑒此方法。
當排泄物前處理方法與血漿、組織前處理方法不同時,造成多種樣品的批量處理過程耗時又耗料。因此,為了盡量避免繁瑣的前處理方法,CYX和BDCYX還是沿用了組織中的提取檢測方法。對于排泄物中QCA的提取和檢測方法,采取了與肝臟組織相同的提取程序和檢測條件,且能夠滿足本研究要求。
3.2 CYX,BDCYX和QCA消除規律
邱銀生[10]給豬單次灌服CYX(40 mg/kg bw),用HPLC法測定。糞便中可檢出原形藥物,未檢出任何其它代謝產物,尿中未檢出原形藥物及其脫二氧代謝產物,卻檢出QCA的結合物。仔豬連續混飼CYX(100 g/1000 kg)2個月,停藥后12 h肝臟、腎臟、肌肉和脂肪等組織中未檢出CYX和BDCYX,可檢出QCA,且體內殘留時間最長。黃玲利[5]研究表明,30日齡艾維茵商品肉雞連續混飼100 mg/kg CYX 10 d后,采用HPLC法檢測,停藥后6 h各組織中CYX和BDCYX消除至檢測限量(0.025μg/kg)以下,肝、腎組織中僅檢出QCA。
本研究采用連續混飼給藥7 d,檢測大鼠體內血漿、肌肉和肝臟,以及一次性灌胃給藥后的尿液和糞便中CYX、BDCYX和QCA的消除規律。檢測結果表明,連續混飼給藥7 d后的血漿、肌肉和肝臟中未檢測到CYX和BDCYX。停藥后6 h的肌肉中檢測到微量QCA,肝臟72 h內均可檢測到QCA,血漿中未檢測到QCA。一次性灌胃給藥后的尿液中0~24 h大量檢出QCA,48 h以后無法檢測到QCA。糞便中檢測不到QCA,卻在前24 h檢測到大量CYX和BDCYX。本研究建立了CYX及其兩種代謝產物BDCYX和QCA的提取凈化和HPLC檢測方法,為確證體內生成的多種代謝產物的存在形式提供了提取方法和色譜分離技術,并通過研究喹賽多及其代謝產物在大鼠血漿、肌肉、肝臟和排泄物中消除規律,為后期體內外處置研究提供了初步理論基礎。
[1]Vries H D,Bojarski J,Donker A A,et al.Photochemical reac?tions of quindoxin,olaquindox,carbadox and cyadox with protein,indicating photoallergic properties[J].Toxicology,1990,63(1):85-95.
[2]Graaf G J,Spierenburg T J.Liquid chromatographic determination of cyadox in medicated feeds and in the contents of the porcine gastrointestinal tract with fluorescence detection.[J].Journal of Chromatography A,1988,447(1):244-248.
[3]Qian C,Tang SS,Xi J,et al.Investigation of the genotoxicity of quinocetone,carbadox and olaquindox in vitro using Vero cells.[J].Food&Chemical Toxicology An International Journal Published for the British Industrial Biological Research Association,2008,47(2):328-334.
[4]Wang Y,Yuan Z,Zhu H,et al.Effect of cyadox on growth and nutrient digestibility in weanling pigs.[J].South African Journal of Animal Science,2005,35(2):117-125.
[5]黃玲利.喹賽多在肉雞的有效性與安全性研究[D].華中農業大學,2005.
[6]Ding MX,Yuan Z H,Wang Y L,et al.Olaquindox and cyadox stimulate growth and decrease intestinalmucosal immunity of piglets orally inoculated with Escherichia coli.[J].Journal of Animal Physiology and Animal Nutrition,2006,90(5-6):238-243.
[7]He Q,Fang G,Wang Y,etal.Experimental evaluation of cyadox phototoxicity to Balb/c mouse skin.[J].Photodermatology Photoimmunology&Photomedicine,2006,22(2):100-104.
[8]Wang X,He Q H,Wang Y L,et al.A chronic toxicity study of cyadox in Wistar rats.[J].Regulatory Toxicology&Pharmacology,2010,59(2):324-333.
[9]Fang G,He Q,Zhou S,etal.Subchronic oral toxicity study with cyadox in Wistar rats.[J].Food&Chemical Toxicology An Inter?national Journal Published for the British Industrial Biological Research Association,2006,44(1):36-41.
[10]邱銀生.喹賽多在豬體內的藥動學和殘留研究[D].華中農業大學,2003.
[11]黃麗娜.喹賽多在蛋雞的有效性與安全性研究[D].華中農業大學,2008.
[12]Sestakova I,Skarka P,Manousek O.Determination of QCA in porcine liver by polar-graphic.[J].Journal of Biologicl Chemistry,1988,16:29-32.
[13]Hutchinson MJ,Young P Y,Hewitt S A,et al.Development and validation of an improved method for confirmation of the carbadoxmetabolite,quinoxaline-2-carboxylic acid,in porcine liver using LC-electrospray MS-MS according to revised EU criteria for veterinary drug residue analysis.[J].Analyst,2002,127(3):342-346.
[14]Sin DW M,Chung L P K,Lai MMC,et al.Determination of quinoxaline-2-carboxylic acid,themajormetabolite of carbadox,in porcine liver by isotope dilution gas chromatography-electron capture negative ionization mass spectrometry[J].Analytica Chimica Acta,2004,508(2):147-158.
[15]Hutchinson MJ,Young P B,Kennedy D G.Confirmation of carbadox and olaquindoxmetabolites in porcine liver using liquid chromatography–electrospray,tandem mass spectrometry[J].Journal of Chromatography B Analytical Technologies in the Biomedical&Life Sciences,2005,816(1-2):15-20.
[16]Wu Y,Huan Yu,Wang Y,et al.Development of a high-per?formance liquid chromatography method for the simultaneous quantification of quinoxaline-2-carboxylic acid and methyl-3-quinoxaline-2-carboxylic acid in animal tissues.[J].Journal of Chromatography A,2007,1146:1-7.
(編輯:陳希)
The Elim ination of Cyadox and Its Two Major Metabolites in Rats
HARNUD Sechenchogt1,2,HUANG Ling-li2,YUAN Zong-hui2?
(1.College of Plant Science and Technology ofHubei Engineering University,The Hubei Engineering Technology for Utilization of Botanical Functional Ingredients,Xiaogan432000,China;2.National Reference Laboratory of Veterinary Drug Residues(HZAU)and MOA Key Laboratory for the Detection of Veterinary Drug Residues in Foods,Huazhong Agricultural University,Wuhan430070,China)
The elimination characteristic of cyadox(CYX)and its twomajormetabolites,1,4-bisdesoxycyadox(BDCYX)and quinoxalie-2-carboxylic acid(QCA)were investigated in rats for its study on pharmacology,toxicology and food safety concerns.In this study,established a HPLC method for the determination of CYX,BDCYX and QCA,Following a five groups ofWistar rats(20 rats/group/sex)were fed with the diets containing CYX(100 mg/kg)7 consecutive days and another group was a single oral gavage of CYX(10 mg/kg bw).The results showed that CYX and BDCYX were non-detectable in plasma,muscle,liver and urine,while detectable at 0~24 h and 24~48 h in feces.QCA was detected in muscle for 6h,and detected to 72h in liver while no detectable in plasma and feces。These results provide comprehensive information for the food safety evaluation ofCYX and will improve the understanding of the pharmacology and toxicology of CYX in animals.
CYX;BDCYX;QCA;Elimination
2016-11-09
A
1002-1280(2017)04-0042-08
S859.79
國家重點基礎研究發展“973”計劃項目(2009CB118800)
斯琴朝克圖,博士,從事獸醫藥理學與毒理學、獸藥殘留與食品安全方面研究。
袁宗輝。E-mail:yuan5802@mail.hzau.edu.cn

