新型雙- 1,4- 二氫吡啶的水相微波輔助合成
白少飛, 王進敏, 樊強文, 閆 紅*
(1. 北京工業大學 生命科學與生物工程學院,北京 100124; 2. 北京四環制藥有限公司,北京 101113)
新型雙- 1,4- 二氫吡啶的水相微波輔助合成
白少飛1, 王進敏2, 樊強文1, 閆 紅1*
(1. 北京工業大學 生命科學與生物工程學院,北京 100124; 2. 北京四環制藥有限公司,北京 101113)
采用微波輔助合成法,以四叔丁基溴化銨(TBAB)為催化劑,水為溶劑,3,3- 二乙氧基丙酸乙酯,胺和二醛(或醛和二胺)為原料,經Hantzsch反應合成了11個雙- 1,4- 二氫吡啶化合物(I- 1~I- 7和II- 1~II- 4),其中I- 3~I- 7和II- 2~II- 4為新化合物,其結構經1H NMR,13C NMR和HR- MS(ESI)表征。以I- 1的合成為例,考察了相轉移催化劑、微波功率、反應溫度和反應時間對產率的影響。在最佳條件[TBAB 2.5 mol%,于100 W, 60 ℃微波反應30 min]下,I和II產率分別為70.9%~92.5%和79.8%~95.5%。
雙- 1,4- 二氫吡啶; 微波輔助; 合成; 相轉移催化; 條件優化
1,4- 二氫吡啶是一類含有平行雙鍵的雜環己二烯類化合物,也是很多生物活性藥物的基本結構單元,廣泛存在于天然產物中。1,4- 二氫吡啶具有良好的生物藥理活性,在醫藥、化工和生物等領域發揮了重要作用[1-4]。如1,4- 二氫吡啶類鈣拮抗劑可使鈣通道不被激活,阻礙鈣離子進入細胞內,從而降低細胞內鈣離子的含量,進而起到治療高血壓、心絞痛、動脈粥狀硬化等血管性疾病的作用[5-6]。1,4- 二氫吡啶可作為原料合成吡啶類化合物,作為亞胺還原試劑,應用于還原氨化反應。此外,由于1,4- 二氫吡啶含有平行的不飽和雙鍵,可在光照下發生光環合反應,生成籠型化合物[7-10]。
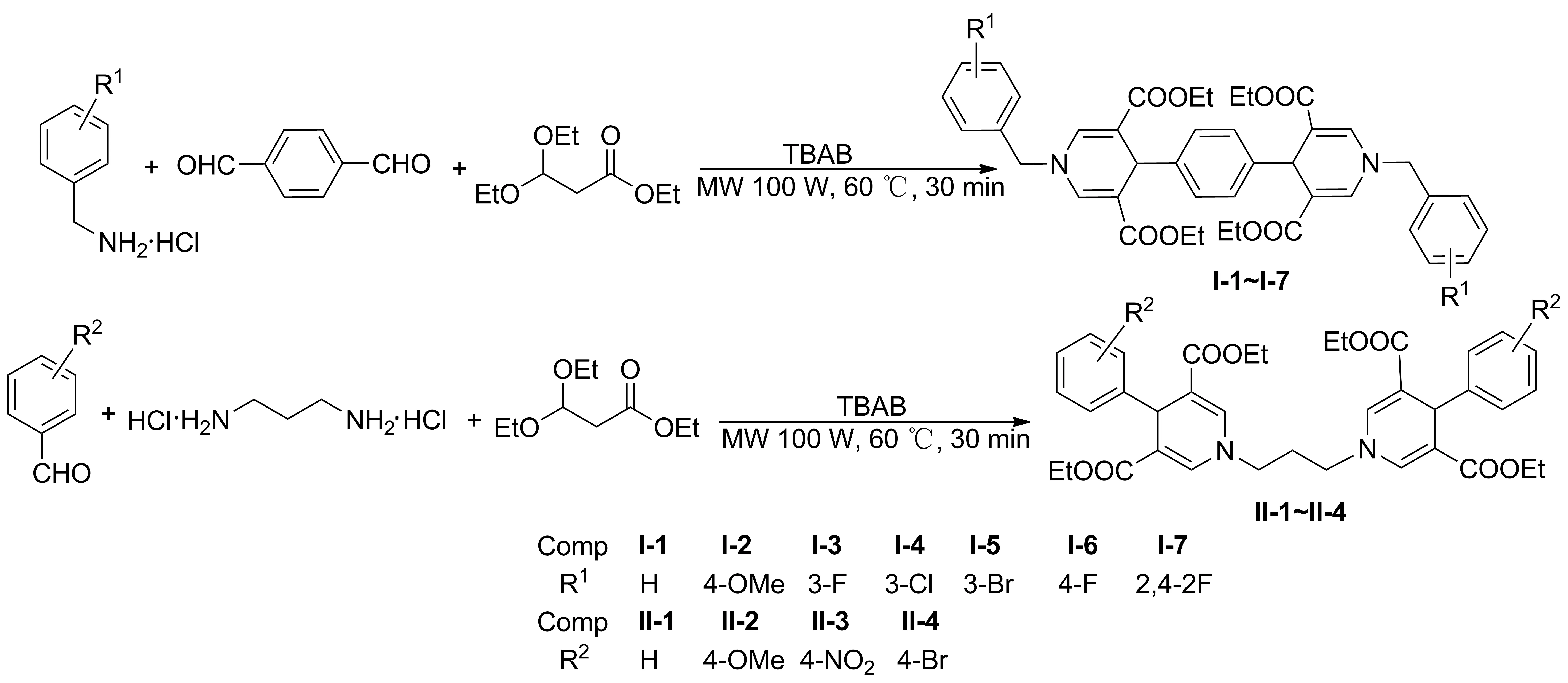
Scheme 1
雙- 1,4- 二氫吡啶與1,4- 二氫吡啶具有結構相似性。由于連接兩個二氫吡啶環的基團性質不同,可賦予1,4- 二氫吡啶類衍生物不同的生物藥理活性。因此,對雙- 1,4- 二氫吡啶的合成方法進行研究,有利于拓展1,4- 二氫吡啶類化合物在醫藥、化工和生物等領域的應用范圍。
雙- 1,4- 二氫吡啶的合成反應機理與1,4- 二氫吡啶的Hantzsch合成反應機理大致相同[11],均為醛和胺與β- 二羰基化合物發生親核加成- 消除反應生成中間體;中間體再經過邁克爾加成- 消除反應和分子內環化反應得到最終產物。不同點在于:合成雙- 1,4- 二氫吡啶時使用的原料為雙官能團醛或胺[12-15],如對苯二甲醛、間苯二甲醛和1,3- 丙二胺等。Sueki等[16]以1,3- 丙二胺鹽酸鹽或芐胺鹽酸鹽為氮源,將對苯二甲醛和3,3- 二乙氧基丙酸乙酯溶于DMSO中,于90 ℃反應6~17 h,合成了雙1,4- 二氫吡啶。該合成方法存在使用有機溶劑,反應時間較長,產率偏低,產物分離純化過程繁瑣等缺點。
水作為有機反應介質,具有無毒、環保和價廉易得等優點。以水作反應介質,還能通過調節反應體系的pH或添加相轉移催化劑等方式以促進反應[17]。此外,由于有機產物大多在水中的溶解度較低,能從較大程度上降低產物損失,提高反應產率。
微波輔助反應方式已經被廣泛應用于化工、醫藥和環保等領域[18-20]。微波促進有機合成反應具有低能耗、快速高效和產率高等優點。使用微波合成法優化雙- 1,4- 二氫吡啶類衍生物的合成具有較大的研究意義。
鑒于此,本文采用微波輔助合成法,以四叔丁基溴化銨(TBAB)為催化劑,水為溶劑,3,3- 二乙氧基丙酸乙酯,胺和二醛(或醛和二胺)為原料,經Hantzsch反應合成了11個雙- 1,4- 二氫吡啶化合物(I- 1~I- 7和II- 1~II- 4, Scheme 1),其中I- 3~I- 7和II- 2~II- 4為新化合物,其結構經1H NMR,13C NMR和HR- MS(ESI)表征。以I- 1的合成為例,考察了相轉移催化劑、微波功率、反應溫度和反應時間對產率的影響。
1 實驗部分
1.1 儀器與試劑
X- 5型顯微熔點儀;Bruker ARX 400 MHz型核磁共振儀(CDCl3為溶劑,TMS為內標);Agilent G3250AA LC/MSD TOF system型高分辨質譜儀;Discover型微波合成儀。
所用試劑均為分析純。
1.2 I和II的合成(以I- 1為例)
在單口燒瓶中加入芐胺鹽酸鹽2.86 g(20 mmol),蒸餾水50 mL,對苯二甲醛1.34 g(10 mmol), 3,3- 二乙氧基丙酸乙酯9.5 g(50 mmol)和TBAB 25 mol%,攪拌使其混合均勻;于100 W, 60 ℃微波反應30 min。用CH2Cl2萃取,有機相用少量H2O洗滌,用無水Na2SO4干燥,過濾,濾餅用乙酸乙酯和石油醚重結晶得淡黃色固體1,4- 雙- (1- 芐基- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯)苯(I- 1)5.68 g,產率80.8%, m.p.165.0~166.3 ℃;1H NMRδ: 1.14(t,J=7.0 Hz, 12H), 4.02~4.10(m, 8H), 4.57(s, 4H), 4.85(s, 2H), 7.13(s, 4H), 7.25~7.42(m, 14H)。
用類似的方法合成I- 2~I- 7和II- 1~II- 4。
1,4- 雙[1- (4- 甲氧基- 芐基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]苯(I- 2): 黃色固體,產率70.9%, m.p.168.2~169.9 ℃;1H NMRδ: 1.12(t,J=7.01 Hz, 12H), 3.84(s, 6H), 3.99~4.10(m, 8H), 4.50(s, 4H), 4.83(s, 2H), 6.93~6.95(d,J=8.40 Hz, 4H), 7.11(s, 4H), 7.20~7.28(q,J=7.72 Hz, 8H)。
1,4- 雙[1- (3- 氟- 芐基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]苯(I- 3): 黃色固體,產率84.5%, m.p.170.5~172.8 ℃;1H NMRδ: 1.20(t,J=7.02 Hz, 12H), 4.04~4.15(m, 8H), 4.60(s, 4H), 4.94(s, 2H), 6.84~6.88(t,J=8.02 Hz, 2H), 6.98~7.00(d,J=8.02 Hz, 4H), 7.04~7.23(m, 8H), 7.27~7.38(t,J=7.30 Hz, 2H);13C NMRδ: 14.2, 37.2, 57.7, 60.2, 108.9, 113.2, 114.2, 115.0, 115.3, 122.7, 123.8, 129.2,130.9, 137.6, 138.6, 148.8, 161.9, 164.4; HR- MS(ESI)m/z: Calcd for C42H42N2O8F2{[M+Na]+}793.290 9, found 793.291 8。
1,4- 雙[1- (3- 氯- 芐基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]苯(I- 4): 黃色固體,產率83.6%, m.p.174.6~176.8 ℃;1H NMRδ: 1.15(s, 12H), 3.98~4.15(m, 8H), 4.54(s, 4H), 4.85(s, 2H), 7.15(s, 4H), 7.22(s, 2H), 7.27(s, 4H), 7.33(s, 2H), 7.34(s, 4H);13C NMRδ: 14.1, 36.8, 57.5, 60.0, 109.5, 125.2, 127.3, 127.9, 128.5, 130.4, 135.0, 137.2, 138.3, 144.4, 166.9; HR- MS(ESI)m/z: Calcd for C42H42N2O8Cl2{[M+H]+}773.231 8, found 773.235 5。
1,4- 雙[1- (3- 溴- 芐基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]苯(I- 5): 黃色固體,產率82.8%, m.p.175.5~177.8 ℃;1H NMRδ: 1.14(s, 12H), 3.98~4.14(m, 8H), 4.56(s, 4H), 4.85(s, 2H), 6.98~7.00(d,J=7.61 Hz, 2H), 7.05~7.07(d,J=7.61 Hz, 4H), 7.14(s, 4H), 7.22(s, 4H), 7.35~7.41(d,J=7.20 Hz, 2H);13C NMRδ: 14.1, 36.8, 57.6, 60.0, 109.5, 114.0, 114.2, 115.2, 115.4, 122.7, 127.9, 130.7, 130.8, 137.3, 138.8, 144.4, 161.9, 164.4, 166.9; HR- MS(ESI)m/z: Calcd for C42H42N2O8Br2{[M+H]+}861.231 8, found 861.232 0。
1,4- 雙[1- (4- 氟- 芐基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]苯(I- 6): 黃色固體,產率87.2%, m.p.178.3~179.8 ℃;1H NMRδ: 1.14(t,J=7.21 Hz), 4.00~4.10(m, 8H), 4.57(s, 4H), 4.85(s, 2H), 6.98~7.00(d,J=8.80 Hz, 2H), 7.06~7.07(s, 4H), 7.14(s, 4H), 7.22(s, 4H), 7.36~7.41(q,J=7.21 Hz, 2H);13C NMRδ: 14.1, 36.8, 57.6, 60.0, 109.5, 114.0, 114.2, 115.2, 115.4, 122.7, 130.8, 137.2, 138.8, 144.4, 161.9, 164.4, 166.9; HR- MS(ESI)m/z: Calcd for C42H42N2O8F2{[M+Na]+}793.290 9, found 793.293 0。
1,4- 雙[1- (2,4- 二氟- 芐基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]苯(I- 7): 黃色固體,產率92.5%, m.p.190.6~192.8 ℃;1H NMRδ: 1.14(t,J=7.00 Hz, 12H), 3.99~4.12(m, 8H), 4.57(s, 4H), 4.81(s, 2H), 6.88~6.94(m, 4H), 7.06(s, 4H), 7.14~7.23(m, 6H);13C NMRδ: 14.1, 36.8, 51.7, 60.0, 104.5, 109.5, 111.8, 11.20, 114.2, 115.2, 122.7, 127.7, 130.3, 137.0, 138.8, 144.4, 159.5, 161.7, 162.2, 164.3, 166.8; HR- MS(ESI)m/z: Calcd for C42H40N2O8F4{[M+Na]+}799.272 1, found 799.274 9。
1,3- 雙- (4- 苯基- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯)丙烷(II- 1): 淡黃色固體,產率82.2%, m.p.169.0~172.3 ℃;1H NMRδ: 1.19(t,J=7.00 Hz, 12H), 2.13~2.17(t,J=7.21 Hz, 2H), 3.48~3.50(t,J=4.01 Hz, 4H), 4.04~1.14(m, 8H), 4.92(s, 2H), 7.04~7.30(m, 14H)。
1,3- 雙- [4- (4- 甲氧苯基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]丙烷(II- 2): 黃色固體,產率79.8%, m.p.175.9~177.8 ℃;1H NMRδ: 1.20(t,J=7.01 Hz, 12H), 2.12~2.15(t,J=6.02 Hz), 3.48~3.52(t,J=8.01 Hz, 4H), 3.76(s, 6H), 4.07~1.14(m, 8H), 4.86(s, 2H), 6.81~6.83(d,J=8.01 Hz, 4H), 7.18(s, 4H), 7.20~7.22(d,J=8.01 Hz, 4H);13C NMRδ: 14.2, 30.9, 36.4, 51.8, 55.1, 60.1, 109.6, 113.4, 129.1, 136.5, 138.9, 158.2, 166.8; HR- MS(ESI)m/zCalcd for C39H46N2O10{[M-H]+}703.315 2, found 703.307 3。
1,3- 雙- [4- (4- 硝基苯基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]丙烷(II- 3): 黃色固體,產率95.5%, m.p.173.8~175.3 ℃;1H NMRδ: 1.15(t,J=7.20 Hz, 12H), 2.22~2.25(t,J=6.61 Hz), 3.62~3.66(t,J=6.61 Hz, 4H), 4.02~4.11(m, 8H), 5.03(s, 2H), 7.28(s, 4H), 7.44~7.46(d,J=8.00 Hz, 2H), 7.72~7.73(d,J=7.61 Hz, 2H), 8.02~8.04(d,J=8.00 Hz, 2H), 8.13(s, 2H);13C NMRδ: 14.1, 30.6, 37.5, 51.8, 60.4, 108.6, 121.7, 123.0, 128.8, 134.6, 137.5, 148.4, 148.6, 166.2; HR- MS(ESI)m/z: Calcd for C37H40N4O12{[M-H]+}731.264 3, found 731.258 6。
1,3- 雙- [4- (4- 溴苯基)- 1,4- 二氫吡啶- 3,5- 二羧酸乙酯]丙烷(II- 4): 黃色固體,產率85.8%, m.p.170.5~172.8 ℃;1H NMRδ: 1.19(t,J=7.21 Hz, 12H), 2.11~2.15(t,J=6.80 Hz), 3.48~3.52(t,J=7.01 Hz, 4H), 4.08~1.12(m, 8H), 4.89(s, 2H), 7.17~7.19(d,J=8.02 Hz, 8H), 7.40(s, 4H);13C NMRδ: 14.2, 30.7, 36.3, 51.5, 55.6, 60.1, 109.5, 110.1, 113.4, 129.1, 136.5, 137.3, 158.2, 166.8, 166.9; HR- MS(ESI)m/zCalcd for C37H40N2O8Br2{[M-H]+}798.115 1, found 798.116 6。
2 結果與討論
2.1 合成反應條件優化
以I- 1的合成為例,考察了相轉移催化劑,微波功率,反應時間和反應溫度對產率的影響。
(1) 相轉移催化劑
表1為相轉移催化劑對I- 1產率的影響。由表1可見,相轉移催化劑對I- 1產率影響較為顯著。不使用相轉移催化劑,反應難以進行;以環糊精和冠醚作相轉移催化劑,催化效果不明顯;季銨鹽類相轉移催化劑對反應的催化效果較好,TBAB和芐基三甲基溴化銨(BAB)催化下,產率分別為80.8%和78.5%,遠高于文獻產率(48.0%[16])。因此,選擇TBAB為相轉移催化劑。
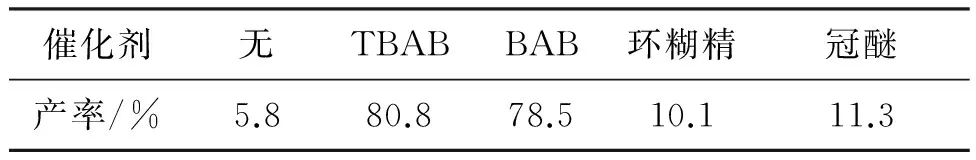
表1 催化劑種類對I- 1產率的影響aTable 1 The effect of catalysts on the yield of I- 1
a反應條件同1.2。
此外,我們還研究了TBAB用量對I- 1產率的影響,結果見表2。由表2可見,當催化劑用量為2.5 mol%時,產率80.8%,用量超過2.5 mol%,產率基本維持不變。因此,TBAB的最佳用量為2.5 mol%。
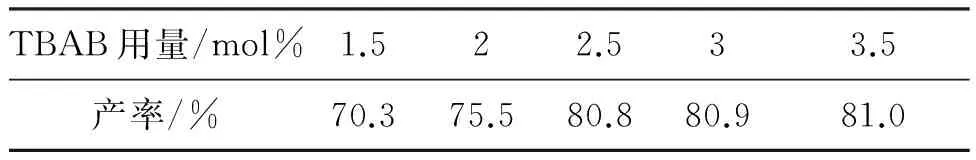
表2 催化劑用量對I- 1產率的影響aTable 2 The amount of catalyst on the yield of I- 1
aTBAB為催化劑,其余反應條件同表1。
(2) 微波功率和反應溫度
表3為微波功率和反應溫度對I- 1產率的影響。由表3可見,當反應溫度為30 ℃時,產率較低(50%左右);溫度升高,產率顯著提高,最高產率達75.6%。由表3還可見,提高反應功率,產率也隨之上升,當微波功率為20 W時,產率小于50%;當微波功率為100 W時,最低收率也大于60%。因此,最佳反應溫度為60 ℃,微波功率為100 W。

表3 微波功率和反應溫度對I- 1產率的影響aTable 3 The effects of reaction temperature and microwave power on the yield of I- 1
a微波反應時間為10 min,其余反應條件同表2。
(3) 反應時間
表4為反應時間對I- 1產率的影響。由表4可見,延長反應時間,產率提高;當反應時間為30 min時,產率80.8%;繼續延長反應時間,產率趨于穩定。因此,最佳反應時間為30 min。

表4 反應時間對I- 1產率的影響aTable 4 The effect of reaction time on the yield of I- 1
a反應溫度為60 ℃,微波功率為100 W,其余反應條件同表3。
綜上所述,I- 1的最佳合成條件為:TBAB 2.5 mol%,于100 W, 60 ℃微波反應30 min, I- 1產率80.8%。
2.2 最佳合成條件的反應拓展
(1) I的合成
表5為最佳合成條件在I- 2~I- 7的合成中的拓展結果。由表5可見,本文所用的合成方法的產率遠高于文獻值[16],且只需經萃取、濃縮和重結晶后即可得到終產物。由表5還可見,I的產率與芐胺上取代基的類型與位置有直接關系。當R為供電子基時,I的產率較低,如I- 1(R=H)產率為80.8%, I- 2(R=4- OMe)產率為70.9%;當R為吸電子基時,I的產率較高。吸電子基團的吸電子能力越強,產率越高。吸電子基團位于苯環的2- , 4- 位時,對產率的影響大于3- 位。如I- 6(R=4- F)產率為87.2%, I- 3(R=3- F)產率為84.5%。

表5 最佳合成條件在I- 2~I- 7合成反應中的拓展Table 5 Development of optimized conditions on the synthesis of I- 2~I- 7
(2) II的合成
表6為將最佳合成條件在II- 2~II- 7的合成中的拓展結果。由表6可見,用本文方法合成II- 1,產率高達82.2%,遠高于文獻值(49%)[16]。后處理時僅涉及萃取、濃縮、重結晶等簡單步驟即可得到產物II,不需要使用柱層析純化。由表6還可見,II的產率與芳香醛上取代基的電負性有直接關系。當R為供電子基團時,II產率降低。如II- 1(R=H)產率為82.2%, II- 2產率降至79.8%。當R為吸電子基團時,II產率隨著基團吸電子能力的增強而提高。當R為吸電子能力較弱的Br時,II產率提高了約4%;當R為吸電子能力較強的NO2時,II產率提高13%以上。這可能是因為處于芳香醛對位的吸電子基團能夠通過誘導效應和共軛效應降低醛基碳的電子云密度,增大碳原子的正電性,有利于親核反應的進行;而對位取代的供電子基團通過誘導效應和共軛效應使碳原子的電子云密度增大,不利于親核取代反應的進行,從而導致產率下降。
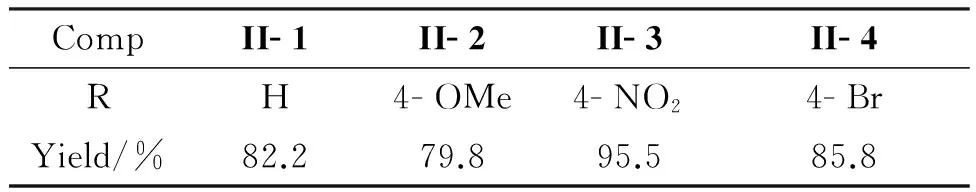
表6 最佳合成條件在II- 1~II- 4合成反應中的拓展Table 6 Development of optimized conditions on the synthesis of II- 1~II- 4
采用微波輔助合成法,以四叔丁基溴化銨(TBAB)為催化劑,水為溶劑,3,3- 二乙氧基丙酸乙酯,胺和二醛(或醛和二胺)為原料,經Hantzsch反應合成了11個雙- 1,4- 二氫吡啶化合物(I- 1~I- 7和II- 1~II- 4, 其中I- 3~I- 7和II- 2~II- 4為新化合物)。在最佳條件[TBAB 2.5 mol%,于100 W, 60 ℃微波反應30 min]下,I和II產率分別為70.9%~92.5%和79.8%~95.5%。該方法具有綠色環保,后處理簡單,產率較高等優點。
[1] Kappe C O. Biologically active dihydropyrimidones of the Biginelli- type- a literature survey[J].European journal of medicinal chemistry,2000,35(12):1043-1052.
[2] Gordeev M F, Patel D V, Gordon E M. Approaches to combinatorial synthesis of heterocycles:A solid- phase synthesis of 1,4- dihydropyridines[J].The Journal of Organic Chemistry,1996,61(3):924-928.
[3] Mannhold R, Jablonka B, Voigt W,etal. Calcium- and calmodulin- antagonism of elnadipine derivatives:Comparative SAR[J].European journal of medicinal chemistry,1992,27(3):229-235.
[4] Mager P, Coburn R, Solo A,etal. QSAR,diagnostic statistics and molecular modelling of 1,4- dihydropyridine calcium antagonists:A difficult road ahead[J].Drug design and discovery,1992,8(4):273-289.
[5] Rafieepour S, Saghaie L, Fassihi A. Conformationalproperties of novel 1,2,3,4- tetrahydro- pyrimidinone (thione) derivatives:A DFT study[J].Journal of Reports in Pharmaceutical Sciences(J Rep Pharm Sci),2013,1(2):118-126.
[6] Peri R, Padmanabhan S, Rutledge A,etal. Permanently charged chiral 1,4- dihydropyridines:Molecular probes of L- type calcium channels:Synthesis and pharmacological characterization of methyl (ω- trimethylalkylammonium) 1,4- dihydro- 2,6- dimethyl- 4- (3- nitrophenyl)- 3,5- pyridinedicarboxylate iodide,calcium channel antagonists[J].Journal of medicinal chemistry,2000,43(15):2906-2914.
[7] Kempson J, Spergel S H, Guo J,etal. Novel tricyclic inhibitors of IκB kinase[J].Journal of medicinal chemistry,2009,52(7):1994-2005.
[8] Itoh T, Nagata K, Miyazaki M,etal. A selective reductive amination of aldehydes by the use of Hantzsch dihydropyridines as reductant[J].Tetrahedron,2004,60(31):6649-6655.
[9] Zhu X, Li W, Yan H,etal. Triplet phenacylimidazoliums- catalyzed photocycloaddition of 1,4- dihydropyridines:An experimental and theoretical study[J].Journal of Photochemistry and Photobiology A:Chemistry,2012,241:13-20.
[10] 朱曉鶴,倪成良,宋秀慶,等. 3,9- 二氮雜四星烷類化合物的合成研究[J].有機化學,2010,30(2):276-281.
[11] Hantzsch A. Ueber die synthese pyridinartiger verbindungen aus acetessig?ther und aldehydammoniak[J].Justus Liebigs Annalen der Chemie,1882,215(1):1-82.
[12] Mukherjee A, Akhtar M S, Sharma V L,etal. Syntheses and bioevaluation of substituted dihydropyridines for pregnancy- interceptive activity in hamsters[J].Journal of medicinal chemistry,1989,32(10):2297-2300.
[13] Ghorbani C A, Zolfigol M A, Hajjami M,etal. Nano aluminium nitride as a solid source of ammonia for the preparation of Hantzsch 1,4- dihydropyridines and bis- (1,4- dihydropyridines) in waterviaone pot multicomponent reaction[J].Journal of the Brazilian Chemical Society,2011,22(3):525-531.
[14] Salehi H, Guo Q X. Synthesis ofsubstituted 1,4- dihydropyridines in water using phase- transfer catalyst under microwave irradiation[J].Synthetic communications,2004,34(23):4349-4357.
[15] Abdel L F, Mashaly M, Mekheimer R,etal. Heterocycle syntheses through ternary condensation of terephthalaldehyde with malononitrile and some nucleophiles[J].Zeitschrift für Naturforschung B,1993,48(6):817-820.
[16] Sueki S, Takei R, Zaitsu Y,etal. Synthesis of 1,4- dihydropyridines and their fluorescence properties[J].European Journal of Organic Chemistry,2014,(24):5281-5301.
[17] 何艷,齊紅. 相轉移催化反應[J].長春師范學院學報,2005,(7):37-38.
[18] Khadilkar B M, Gaikar V G, Chitnavis A A. Aqueous hydrotrope solution as a safer medium for microwave enhanced hantzsch dihydropyridine ester synthesis[J].Tetrahedron Letters,1995,36(44):8083-8086.
[19] 孫納新. 微波技術及其應用[J].醫藥化工,2006,(4):44-50.
[20] Tu S, Miao C, Gao Y,etal. A novel cascade reaction of aryl aldoxime with dimedone under microwave irradiation:The synthesis ofN- hydroxylacridine[J].Synlett,2004,(2):255-258.
Synthesis of Novel Bis- 1,4- dihydropyridines Assisted by Microwave in Aqueous Phase
BAI Shao- fei1, WANG Jin- min2, FAN Qiang- wen1, YAN Hong1*
(1. College of Life Science and Biotechnology, Beijing University of Technology, Beijing 100124, China; 2.Sihuan Pharmaceutical Co., Ltd., Beijing 101113, China)
Eleven bis- 1,4- dihydropyridines(I- 1~I- 7 and II- 1~II- 4) were synthesized by Hantzsch reaction under the assistance of microwave in aqueous phase, using TBAB as the catalyst, 3,3- ethoxypropionate, amine and dialdehyde(or aldehyde and diamine) as the raw materials. Among them, I- 3~I- 7 and II- 2~II- 4 were novel compounds. The structures were characterized by1H NMR,13C NMR and HR- MS(ESI). The effects of the phase transfer catalyst, microwave power, temperature and time on the yield were investigated, using I- 1 as the example. The yields of I and II were 70.9%~92.5% and 79.8%~95.5%, respectively, under the optimized reaction condition[TBAB 2.5 mol%, irradiation at 100 W and 60 ℃ for 30 min].
bis- 1,4- dihydropyridine; microwave assistant; synthesis; phase transfer catalysis; condition optimization
2017- 01- 08;
2017- 04- 28
北京市自然科學基金重點項目(KZ201510005007)
白少飛(1990-),男,漢族,河北秦皇島人,碩士研究生,主要從事有機合成的研究。 E- mail: 1164092499@qq.com
閆紅,教授, E- mail: hongyan@bjut.edu.cn
O623.6; O623.7
A
10.15952/j.cnki.cjsc.1005- 1511.2017.05.17003

