朱頂紅花梗與子房組織培養技術研究
王 宇 江 黎 (上海町碩花卉有限公司,上海市浦東新區 201302)
朱頂紅花梗與子房組織培養技術研究
王 宇 江 黎 (上海町碩花卉有限公司,上海市浦東新區 201302)
為探索適合朱頂紅組織培養的方法,從而為朱頂紅工廠化生產提供技術依據,以朱頂紅花梗和子房為外植體,探究了不同培養基對愈傷組織誘導的影響、不同激素配比對不定芽誘導的影響、不同激素配比對試管苗繼代增殖的影響、不同基質對組培苗成活的影響。結果表明,朱頂紅花梗最適誘導培養基配方為1/2 MS+2.0 mg/L 6-BA+0.5 mg/L NAA+0.5 g/L AC,子房最適誘導培養基配方為1/2 MS+4.0 mg/L 6-BA+0.5 mg/L NAA+0.5 g/L AC。繼代增殖培養基配方為1/2 MS+4.0 mg/L 6-BA+0.2 mg/L NAA+2.0~4.0 mg/L PP333+0.5 g/L AC。移栽基質為純沙∶田園土=1∶1。
朱頂紅;花梗;子房;組織培養;技術研究
朱頂紅別名朱頂蘭、孤挺花、華胄蘭、百子蓮,為單子葉亞綱石蒜科朱頂紅屬多年生具鱗莖的觀賞植物。雜種朱頂紅花大色艷、高貴美觀,具有極高的觀賞價值;再加上朱頂紅商品球容易運輸、栽培相對簡單,隨著網絡購物的發展,成為了網絡園藝店主的首推品種,雜交朱頂紅商品種球的需求也越來越大[1]。
目前,國產的朱頂紅種球數量極少且質量較差,生產中多依賴于進口,價格昂貴;同時,朱頂紅鱗莖的自然繁殖率較低,多數雜交品種不產子球。因此,建立優質高效的朱頂紅種球繁殖技術體系是提高其種球數量和質量的關鍵。近年來,國內外已廣泛采用鱗莖扦插和刻傷法進行朱頂紅繁殖,但鱗莖扦插和刻傷法操作程序繁瑣、成本高、生根率低、扦插苗長勢弱、成苗率低。組織培養技術是目前植物快繁的有效方法之一,具有繁殖系數高、成苗時間短和便于商品化和產業化生產的優勢。
目前,雖然國內外關于朱頂紅組織培養的研究一直不斷,且在用朱頂紅鱗莖盤和雙鱗片誘導不定芽等方面取得了良好的效果,但使用鱗莖為外植體代價太大、污染嚴重、死亡率和褐化率較高[2、3],對比傳統的鱗莖扦插沒有太大優勢[4]。除鱗莖盤和雙鱗片外,也有關于用朱頂紅花梗和子房作外植體誘導植株成功的報道研究,但均未成系統、再現性差[5-7]。為此,本試驗在總結前人研究的基礎上,以朱頂紅花梗和子房為外植體,探究了不同培養基對愈傷組織誘導的影響、不同激素配比對不定芽誘導的影響、不同激素配比對試管苗繼代增殖的影響、不同基質對組培苗成活的影響,以期系統地探索適合朱頂紅組織培養的方法,旨在通過組織培養提高朱頂紅的繁殖速度,為朱頂紅工廠化生產提供技術依據。
1 材料與方法
1.1 試驗材料與地點
本試驗所用材料為荷蘭朱頂紅雜交品種“花孔雀”。試驗設在上海町碩花卉有限公司園藝場進行。
1.2 試驗設計
從朱頂紅母株上采集未開放的花蕾,放入燒杯中用自來水沖洗10 min,然后在超凈工作臺上,把材料放入75%酒精中消毒30 s,再用0.1%HgCl2處理8 min,然后用無菌水沖洗5次。用無菌刀將花蕾剝開,將花序分開,把花梗和子房分別切成1 mm左右切片(以1朵花序平均具4朵花計算,大概可切得100~120片),用鑷子將切片平鋪在培養基上,每瓶接種5片。
1.2.1 不同處理對朱頂紅外植體褐變的抑制效果
組培過程中外植體褐變現象嚴重,為抑制褐變程度,在采取不定芽誘導的同時,結合暗培養48 h,在培養基中分別添加不同濃度的Vc與活性炭(AC),以不添加作對照,觀察外植體褐變情況與生長狀態,Vc濃度分別為0.2、0.5、1.0 g/L;活性炭濃度分別為0.2、0.5、1.0 g/L。每個培養基配方中均添加瓊脂粉5.2 g/L、蔗糖30 g/L,pH為5.8~6.0。每個處理接種10瓶,每處理重復3次。
1.2.2 不同培養基對朱頂紅花梗、子房誘導不定芽的影響
誘導不定芽試驗采用的3種基本培養基分別為MS、1/2 MS、B5,NAA設0.1、0.5、1.0 mg/L三個水平,6-BA設0.5、1.0、2.0、4.0 mg/L四個水平。每個培養基配方中均添加瓊脂粉 5.2 g/L、蔗糖 30 g/L、活性炭0.5 g/ L,pH為5.8~6.0。培養溫度24 ℃,先暗培養48 h,再進行光照培養(光照時間為16 h/d,光照強度為1500 Lx)。每個處理接種10瓶,每處理重復3次。
1.2.3 不同激素配比對朱頂紅繼代增殖培養的影響
以1/2 MS為基本培養基,研究不同濃度6-BA、NAA、多效唑(PP333)對朱頂紅繼代增殖培養的影響。NAA設0.1、0.2、0.5 mg/L三個水平,6-BA設1.0、2.0、4.0 mg/L三個水平,PP333設1.0、2.0、4.0、6.0 mg/L四個水平。每個培養基配方中均添加蔗糖45 g/L、瓊脂粉5.2 g/L,pH為5.8~6.0。
1.2.4 不同基質對朱頂紅移栽的影響
選擇繼代增殖獲得的朱頂紅生根苗移到大棚,開蓋煉苗3 d,然后取出洗凈根部培養基,浸入多菌靈1000倍液中消毒3 mim,稍晾干,移栽至3種基質中(純沙,蛭石,純沙∶田園土=1∶1)。保證苗床溫度在22~28 ℃,適當遮陰,光強強度為10000 Lx,每2 d澆水1次。4周后觀察朱頂紅幼苗生長情況。
2 結果與分析
2.1 不同處理對朱頂紅外植體褐變的抑制效果
據觀察,朱頂紅花梗和子房在接種1 d后,培養基上部的外植體表層會出現輕微的褐化現象,顏色呈淺黃色,而與培養基接觸的部位未變色;到第3天,鱗莖盤外層褐化加重,與培養基接觸的部位也出現輕微褐色。由表1可知,朱頂紅外植體褐變現象嚴重,在不添加附加物的條件下,褐變死亡率達64.2%。添加不同濃度的Vc與AC,對外植體褐變均有一定的抑制效果,其中添加1.0 g/L Vc和1.0 g/L AC處理的褐變死亡率明顯低于對照,分別為16.3%和0,添加1.0 g/L AC處理的褐變死亡率雖為最低,但外植體生長狀態較對照緩慢,誘導率明顯降低;而Vc控制褐化效果不佳,且容易導致愈傷組織玻璃化,降低誘導率。因此,以在培養基中加入0.5 g/L AC為宜,可取得理想的褐變抑制效果。
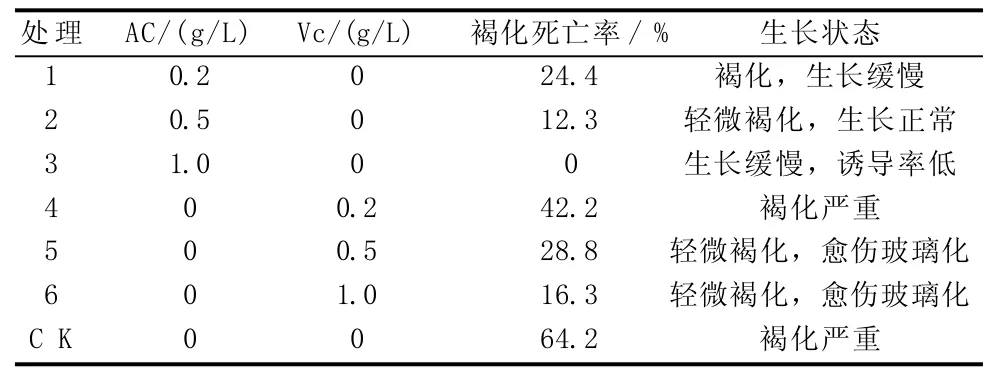
表1 不同處理對朱頂紅外植體褐變的抑制效果
2.2 不同培養基配方對朱頂紅花梗、子房誘導不定芽的影響
朱頂紅花梗和子房在接種1周后,有的外植體開始膨大、變綠,到第3周時,有的外植體變褐死亡,有的開始出現玻璃化,有的繼續膨大形成綠色突狀物,到第5周時,部分外植體開始長出根或不定芽,于第8周統計各處理的不定芽誘導率、平均不定芽數量。
2.2.1 對花梗誘導不定芽的影響
由表2可知,以花梗為外植體,在基本培養基1/2 MS中,不定芽誘導率達48.1%、不定芽數量為4.1個,明顯高于在MS和B5培養基。
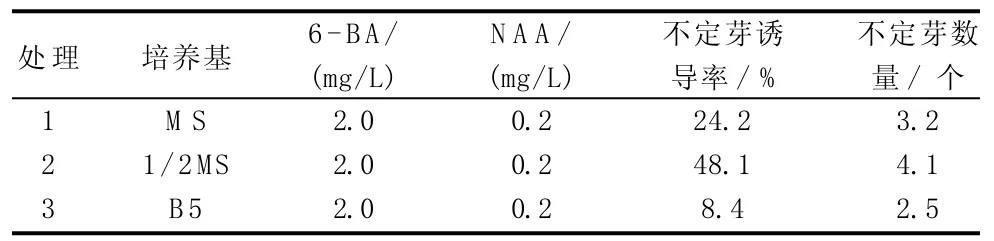
表2 不同培養基配方對朱頂紅花梗誘導不定芽的影響
由表3可知,在NAA濃度一定時,隨著6-BA濃度的增大,平均不定芽增殖數量增大。以0.5 mg/L NAA、4.0 mg/L 6-BA時不定芽增殖數量最大,達7.2個,但此處理不定芽誘導率不是最高。以0.5 mg/L NAA、2.0 mg/L 6-BA時不定芽誘導率最高,達84.3%,表明6-BA繼續增加濃度會導致不定芽誘導率下降。當NAA濃度為1.0 mg/ L時,不定芽誘導率、不定芽增殖數量均很低。綜合考慮,最佳組合為2.0 mg/L 6-BA、0.5 mg/L NAA。

表3 不同激素配比對朱頂紅花梗誘導不定芽的影響
2.2.2 對子房誘導不定芽的影響
由表4可知,以子房為外植體,在基本培養基1/2 MS中,不定芽誘導率達52.6%、不定芽數量為6.4個,明顯高于MS和B5培養基。
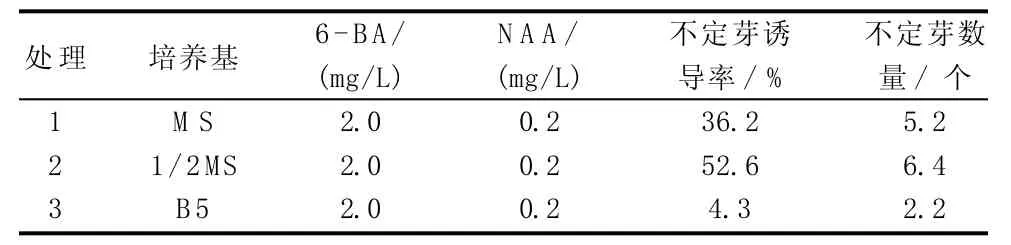
表4 不同培養基配方對朱頂紅子房誘導不定芽的影響
由表5可知,在NAA濃度為0.5 mg/L時,隨著6-BA濃度的增大,平均不定芽誘導率增大,于6-BA濃度為4.0 mg/L時,達到最高值(86.2%),此時不定芽數量也較大(8.2個),均高于NAA濃度為0.1、1.0 mg/L的處理。因此,最佳組合為4.0 mg/L 6-BA與0.5 mg/L NAA。
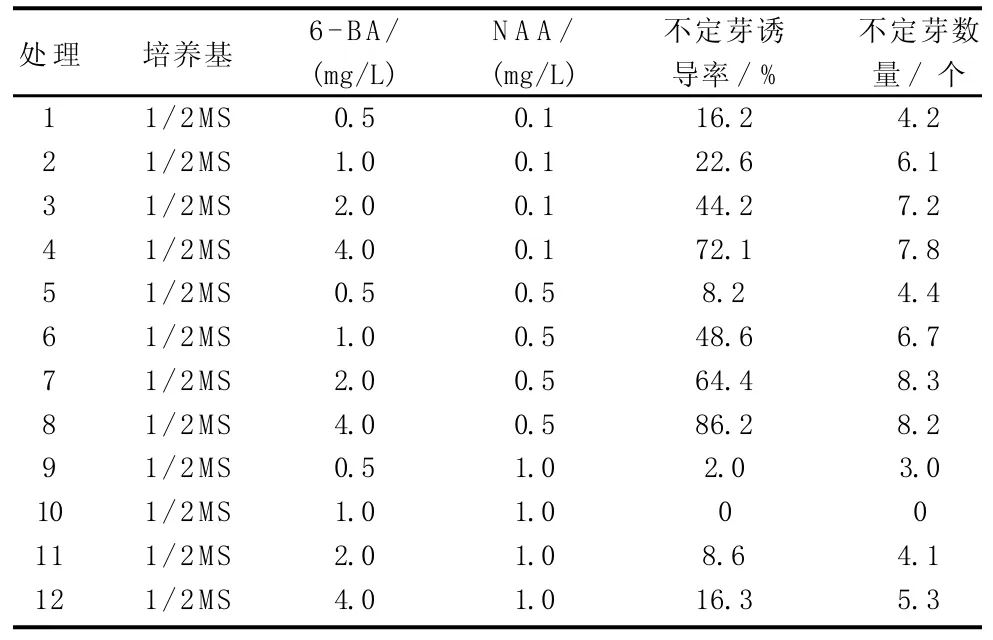
表5 不同激素配比對朱頂紅子房誘導不定芽的影響
2.3 不同激素配比對朱頂紅繼代增殖培養的影響
2.3.1 6-BA、NAA不同濃度配比對朱頂紅繼代增殖培養的影響
通過初代培養,從花梗和子房外植體誘導出的朱頂紅小鱗莖需要進一步切割進行繼代增殖培養,以獲得更多無菌植株。將小鱗莖對半切成0.5 cm2大小的方塊,接種到6-BA、NAA不同濃度配比的培養基中,培養30 d后統計結果(見表6)。在NAA濃度一定時,隨著6-BA濃度的增加,增殖系數明顯增加,均以6-BA濃度為4.0 mg/L時達最佳。NAA濃度為0.1 mg/L、0.2 mg/L間增殖系數差異不明顯,而NAA濃度為0.5 mg/L時,增殖系數急劇下降,這是因為小鱗莖長了很多愈傷組織,抑制了小鱗莖的產生。

表6 不同濃度6-BA、NAA配比對朱頂紅繼代增殖培養的影響
2.3.2 不同濃度PP333對朱頂紅繼代增殖培養的影響
薛寒青在百合組培試驗中得出,PP333能改變同化物的分配,將同化物運輸到正在生長的球莖上,促進百合球莖或鱗莖的形成與生長[8,9]。由表7可知,PP333對朱頂紅的鱗莖生長有明顯促進作用,對朱頂紅鱗莖的分化與形成也有一定促進作用。其中處理(2)、(3)相比對照,鱗莖直徑和增殖系數均明顯增加,但當PP333濃度超過4.0 mg/L時,鱗莖直徑和增殖系數明顯下降,根系變短且少,表明過大濃度的PP333會抑制葉片和根的生長,從而對鱗莖的形成和生長產生抑制作用。因此,PP333最適濃度為2.0~4.0 mg/L。
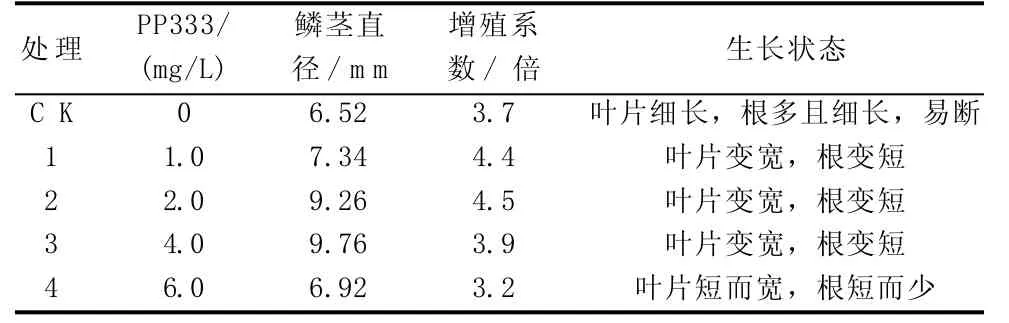
表7 不同濃度PP333對朱頂紅繼代增殖培養的影響
2.4 不同基質對朱頂紅移栽的影響
朱頂紅生根苗移栽至3種基質中,據4周后觀察結果(見表8),朱頂紅生根苗在純沙中成活率最低,但也達87.3%,表明朱頂紅移栽成活較容易;在純沙與田園土混合基質中,朱頂紅生根苗生長情況最好,生長量最大,葉片長度達12.2 cm、鱗莖直徑達19.2 mm。分析其原因是純砂透水性好,但保濕性差,干燥后結構緊實,會對根部造成擠壓,使根系不容易往下伸展,而田園土與純沙混和,則能有效利用田園土中的養分,同時拌合了純沙,能提高基質的透水性,更有利于植株的旺盛生長。蛭石透水性、保水性適中,但本身不含營養,只能維持植株的一般性生長。
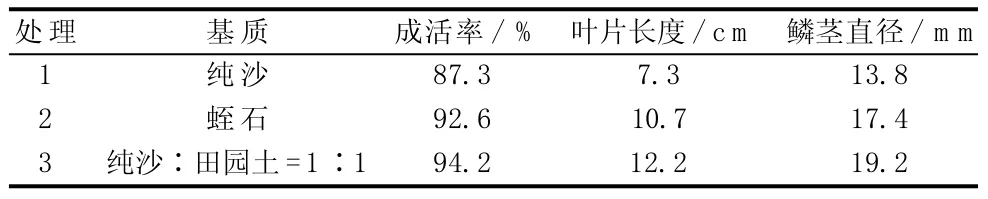
表8 不同基質對朱頂紅移栽的影響
3 結論與討論
試驗結果表明,采用未開放的朱頂紅花序作外植體進行消毒,因為其外層有未展開的花瓣包裹,消毒后污染率接近0。與其它部位外植體相比,花器官不需要破壞種球,且子房和花梗平均可切得100~120片外植體,而1個直徑20 cm的種球最多只能切得60片左右雙鱗片或鱗莖盤外植體[3]。因此,利用子房和花梗作外植體成本優勢明顯。對于外植體褐化的抑制效果,王培軍[10]在外植體接種5 d后,取出刮去外層褐色部分,轉接到新的培養基里,每5 d轉接1次,連續轉接3次,可基本控制褐變。而本文通過暗培養48 h與添加0.5 g/L的活性炭也能有效控制外植體褐化現象,但Vc的褐化抑制效果不明顯,且易導致外植體玻璃化,這與李萍等[11]人對牡丹使用防褐劑的研究一致。同時,在繼代增殖培養中,采用0.5 g/L活性炭能在抑制褐變的同時,有利于根系的生長,省去了生根的環節。朱頂紅生根苗的移栽只要保證適宜的溫度(22~28 ℃)、避免過強的光照(光照強度≤10000 Lx)和定期澆水,無論在純沙、蛭石還是純沙與田園土混合基質中,成活率都較高,其中以純沙與田園土比例為1∶1混合的基質最有利于生長。
綜合考慮,得出結論如下:朱頂紅花梗最適誘導培養基配方為1/2MS+2.0 mg/L6-BA+0.5 mg/L NAA+0.5 g/L AC,子房最適誘導培養基配方為1/2MS+4.0 mg/L 6-BA+0.5 mg/L NAA+0.5 g/LAC。繼代增殖培養基配方為1/2MS+4.0 mg/L 6-BA+0.2 mg/L NAA+2.0~4.0 mg/ L PP333+0.5 g/L AC。移栽基質為純沙∶田園土=1∶1。
[1] 馬媛媛,吳沙沙,焦雪輝,等.朱頂紅的栽培與應用[J].農業工程技術·溫室園藝,2010(8):55-61.
[2] 婁曉鳴,周玉珍,孔賢,等.雜交朱頂紅鱗莖不定芽誘導研究[J].安徽農業科學,2009,37(34):16769-16770.
[3] 原雅玲,張延龍,趙錦麗,等.朱頂紅鱗莖切塊的繁殖方法[J].西北農林科技大學學報(自然科學版),2008,36(9):108-112.
[4] 王賢,熊敏,衛尊征,等.朱頂紅研究綜述[J].農業科技與信息:現代園林,2014(8):49-54.
[5] EN O'Rourke, WM Fountain, S Sharghi.Propagation of Hippeastrum from floral tissues by invitroculture[J].Herbertia, 1991,47(1/2):51-52.
[6] 原雅玲,張亞玲.朱頂紅組織培養最佳繁殖途徑的研究[C]//中國園藝學會觀賞園藝專業委員會年會.2006:628-636.
[7] 姜明蘭,鐘文田.朱頂紅愈傷組織的誘導和植株再生[J].植物生理學報,1984(1):37-40.
[8] 薛寒青.PP333在百合組織培養中的作用[J].河北林業科技, 2007(3):25-26.
[9] 劉冬云,史寶勝,李銀華,等.不同碳源及PP(333)、GA3對山丹組培苗鱗莖增大的影響[J].河北農業大學學報,2005,28(2):32-35.
[10] 王培軍.不同培養基對朱頂紅愈傷組織誘導影響的研究[J].科技創新與生產力,2005(S2):45-47.
[11] 李萍,成仿云,張穎星.防褐劑對牡丹組培褐化發生、組培苗生長和增殖的作用[J].北京林業大學學報,2008,30(2):71-76.
2016-12-22
上海市科委星火富民項目《大花朱頂紅種球國產化繁育與推廣》(編號:153919178000)。

