產3-羥脯氨酸重組菌的構建及發酵優化
姚雪娜, 張震宇*, 孫付保, 陳 昶, 黃建華, 沈 松
(1.江南大學 生物工程學院,江蘇 無錫 214122;2.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122;3.江南大學 糖化學與生物技術教育部重點實驗室,江蘇 無錫214122)
產3-羥脯氨酸重組菌的構建及發酵優化
姚雪娜1,2,3, 張震宇*1,2,3, 孫付保1,2,3, 陳 昶1,2,3, 黃建華1,2,3, 沈 松1,2,3
(1.江南大學 生物工程學院,江蘇 無錫 214122;2.江南大學 工業生物技術教育部重點實驗室,江蘇 無錫214122;3.江南大學 糖化學與生物技術教育部重點實驗室,江蘇 無錫214122)
順式-3-羥基-L-脯氨酸(順式-3-羥脯氨酸)可用于合成多種抗癌藥物,具有重要的商業價值,目前大多通過添加IPTG來誘導表達脯氨酸-3-羥化酶,采用兩步法生物合成順式-3-羥脯氨酸。作者通過目的基因優化設計,引入強啟動子色氨酸串聯啟動子(Ptrp2)來避免異源表達時的誘導劑使用,構建重組質粒pES-Ptrp2-P3H,成功構建了重組大腸桿菌BL21(DE3)/ pET21a-Ptrp2-P3H,優化后的脯氨酸-3-羥化酶基因(P3H)改變了168個堿基,GC含量由原來的64.83%降低到49.31%。該菌在初步優化培養基(葡萄糖1 g/dL,甘油0.125 g/dL,胰蛋白胨1.6 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO41 mmol/L,MgSO40.5 g/dL,CaCl20.015 g/dL,脯氨酸10 g/L,pH 7.5)上能一步法原位合成順式-3-羥脯氨酸,搖瓶發酵24 h,產量0.8 g/L,比優化前提高一倍以上,為進一步開展順-3-羥脯氨酸產業化提供了依據。
脯氨酸-3-羥化酶;順式-3-羥脯氨酸;密碼子優化;重組菌構建;發酵優化
羥基-L-脯氨酸 (Hydroxyproline,Hyp,羥脯氨酸)為亞氨基酸,是L-脯氨酸羥基化后的產物。根據羥脯氨酸的羥基所在位置不同,可形成4種立體異構體,分別是反式-4-羥脯氨酸、順式-4-羥脯氨酸、反式-3-羥脯氨酸和順式-3-羥脯氨酸。其中反式-4-羥脯氨酸最為常見,對哺乳動物骨膠原合成至關重要[1],已被廣泛應用于動物飼料、營養和美容業等許多行業;其次為反式-3-羥脯氨酸,它在I、II和III型骨膠原中含量較多,能通過脯氨酰-3-羥化酶的催化形成。相對地,順式羥脯氨酸比較少見,比如稀有的順式-3-羥脯氨酸[2],現有資料證明它存在于產放線菌素、宜他霉素和遠霉素等次級代謝物的微生物中[3]。
而為數不多的資料表明,順式-3-羥脯氨酸在許多領域均具有重要的應用價值。在醫藥領域,順式-3-羥脯氨酸可以直接作為治療腫瘤和膠原蛋白障礙的藥物[4],并且該種氨基酸作為重要的手性合成子能夠用于合成許多藥物,如選擇性雄性受體調節劑BMS-564929[5]、碳氫霉烯類抗生素、血管緊張肽轉化酶抑制劑和解痙攣制劑等[6]。此外也可用于合 成 DNA 促 旋 酶 抑 制 劑 , 如 plusbacin、cyclothialidine和tripropeptins等。在化學合成領域,順式-3-羥脯氨酸已用作重要的手性分子來合成倒千里光裂堿和流涎胺等。在不對稱合成領域,它還被直接用作有機催化劑。另外,順式-3-羥脯氨酸衍生物,如卡泊芬凈和Pneumocandin B0,還能作為抗真菌藥物使用[1]。但是由于順式-3-羥脯氨酸在自然界中含量極為稀少,導致其價格相當昂貴(約3 800元/g),嚴重限制了在各領域的應用,尤其在醫藥領域,很多以順式-3-羥脯氨酸為前體合成的抗癌藥物才處于臨床試驗階段,并不能滿足人類的需求。因此各國科研工作者都在研究順式-3-羥脯氨酸的生產方法。
目前,羥脯氨酸的生產方法主要有3種:水解法、化學合成法以及微生物轉化法。由于順式-3-羥脯氨酸在骨膠原中含量極少,因而無法通過常見的水解法獲得。已有報道顯示,可通過化學全合成或者差向異構化反應生成[6]。Surajit Sinha等人通過夏普勒斯不對稱環氧化反應從丙氨酸出發,經過十多步反應合成順式-3-羥脯氨酸[2];Navnath B.等人從D-谷氨酸出發,通過一系列化學反應最終合成順式-3-羥脯氨酸,轉化率不足30%[4]。目前,這些化學法存在明顯不足:1)合成工序較為繁瑣和產率低;2)反應過程中會用到一些有毒試劑;3)分離純化工藝復雜。因此,經濟效益欠佳,難以工業化生產。
隨著微生物資源的開發和利用,研究者們逐步發現一些能夠合成順式-3-羥脯氨酸的微生物。1996年 HIDEO MORI等 人 發 現 鏈 霉 菌(Streptomyces sp.)TH1能夠產一種脯氨酸-3-羥化酶,該酶能夠將游離的L-脯氨酸羥基化為順式-3-羥脯氨酸,接著他們發現脯氨酸-3-羥化酶還存在于包括產遠霉素的鏈霉菌和芽孢桿菌等多種微生物體內[8],這也是在微生物中發現脯氨酸-3-羥化酶的首次報道。進一步研究發現,該酶的羥基化活性需要2-酮戊二酸和O2的存在,把它歸為2-酮戊二酸依賴性加雙氧酶類。并且以發酵3 d的鏈霉菌TH1為酶源,在含L-脯氨酸、2-酮戊二酸、硫酸亞鐵、L-抗壞血酸和100 mmol/L TES buffer(pH 7.5)的反應體系里能夠催化產生約174 μmol/L的順式-3-羥脯氨酸[9]。2009年,Robert M.等通過重組菌的構建,實現了脯氨酸-3-羥化酶在大腸桿菌中的異源表達,20 L發酵罐發酵8 h后,加入IPTG誘導,以收集的菌體為酶源,在10 L的反應體系中60 h能夠催化產生約9.1 g/L的順式-3-羥脯氨酸[5]。2011年,德國研究者Christian klein等人直接向發酵液中添加底物L-脯氨酸,800 mL培養基發酵3 d后能夠產生約305 mg的順式-3-羥脯氨酸[6]。在對脯氨酸-3-羥化酶基因(P3H)克隆后,異源表達時還需加入昂貴且有毒性的誘導劑IPTG,這并不適用于藥物蛋白質和食用氨基酸的大規模生產[10]。而且,這些微生物發酵生產順式-3-羥脯氨酸主要采用分步法,即通過大規模的發酵培養獲得能夠產脯氨酸-3-羥化酶的菌體,以這樣的菌體為酶源,加入到合適的反應體系中,催化L-脯氨酸為順式-3-羥脯氨酸。這種分步法可能是為了高產順式-3-羥脯氨酸,但生產工序偏長,投資和運行成本偏高,且染菌風險增加。
作者嘗試開展微生物一步法合成順式-3-羥脯氨酸的研究工作,首先對脯氨酸-3-羥化酶基因進行設計優化,然后通過引入強啟動子色氨酸串聯啟動子(Ptrp2)來避免異源表達時誘導劑使用,接著構建重組大腸桿菌,最后探討利用該菌株在發酵液中原位催化游離脯氨酸來一步法合成順式-3-羥脯氨酸的可行性。
1 材料與方法
1.1 實驗材料
1.1.1 菌株和質粒 菌株 E.coli BL21(DE3)、E.coli JM109:作者所在實驗室保存;克隆載體PES:購于上海旭冠公司;表達載體pUC19、pET28a和pET21a:作者所在實驗室保存。
1.1.2 酶和試劑 限制性內切酶EcoRI、HindⅢ和BamHI:寶生生物工程有限公司;T4 DNA連接酶、1 kb DNA Marker、Premixed Protein Marker、DNA膠回收試劑盒和質粒小量抽提試劑盒:上海生物工程有限公司。
1.1.3 培養基 種子培養基LB:胰蛋白胨1 g/dL,酵母膏0.5 g/dL,NaCl 1 g/dL,pH 7.0。初始發酵培養基:葡萄糖1 g/dL,甘油0.5 g/dL,胰蛋白胨1 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO43 mmol/L,MgSO40.02 g/dL,CaCl20.015 g/dL,脯氨酸46 g/L,pH 7.0。
1.2 實驗方法
1.2.1 脯氨酸-3-羥化酶基因的優化 脯氨酸-3-羥化酶基因密碼子使用頻率分析由數據庫(http:// www.kazusa.or.jp/codon)完成。通過同義替換的方法消除一些在大腸桿菌中使用頻率低的密碼子,調整脯氨酸-3-羥化酶基因的GC含量,使其接近大腸桿菌的GC含量。利用密碼子優化軟件Java Codon Adaptation Tool(JCAT)來對基因進行評估。為便于基因操作,分別在脯氨酸-3-羥化酶基因的5’端設計了EcoRI、HindⅢ,3’端設計了BamHI酶切位點。同時利用RNAstructure軟件對其mRNA的二級結構進行優化,保證起始密碼子ATG及其后的數個堿基組成的密碼子呈開環狀態,降低核糖體結合到mRNA上的能勢,使得核糖體能夠順利地沿著起始密碼子向后翻譯。優化后的基因序列提交給上海旭冠公司合成。
1.2.2 重組質粒的構建 合成的基因連接到質粒pES上 (pES-P3H),含色氨酸串聯啟動子的質粒pUC19-Ptrp2-Hyp(作者所在實驗室構建)經EcoRI和HindⅢ酶切后,回收Ptrp2片段,與經過同樣雙酶切的質粒pES-P3H連接,構建重組質粒pESPtrp2-P3H。構建過程見圖1。

圖1 pES-Ptrp2-P3H重組質粒的構建Fig.1 Construction of the expression vector pES-Ptrp2-P3H
重組質粒pES-Ptrp2-P3H經EcoRI和BamHI雙酶切后,回收Ptrp2-P3H片段,將該片段分別連接到pUC19、pET21a和pET28a質粒上,構建不同的重組質粒pUC19-Ptrp2-P3H、pET21a-Ptrp2-P3H和pET28a-Ptrp2-P3H。對重組質粒酶切驗證正確后轉化至E.coli BL21(DE3)、E.coli JM109。
1.2.3 重組大腸桿菌的培養 重組大腸桿菌培養在含有相應抗生素的平板上,37℃培養約10 h后長出單菌落,挑取單菌落,接種到含有相應抗生素的30 mL(250 mL搖瓶)種子培養基LB中,220 r/min、37℃培養8 h,再按4%的接種體積分數接種到30 mL(250 mL搖瓶)的初始發酵培養基中,于220 r/min、30℃培養12 h,測定發酵液中順式-3-羥脯氨酸的質量濃度。
1.2.4 蛋白質表達分析 取1 mL發酵液,8 000 g離心2 min,去上清液,用100 μL的去離子水重懸細胞。取上述細胞懸浮液10 μL,加入5×上樣緩沖液,混勻后,于沸水中煮約10 min,使細胞充分破碎,破碎的細胞在12 000 r/min離心2 min,取10 μL樣品進行SDS-PAGE分析。
1.2.5 全細胞酶活測定 取發酵液離心2 min(4℃、8 000 g),取10 g/dL細胞懸浮于5 mL、50 mmol/ L磷酸鹽緩沖液(pH 7.9)中,細胞懸浮液加入到50 mL的酶反應液 (5 mmol/L L-抗壞血酸,1 mmol/L FeSO4·7H2O,90 mmol/L 2-酮戊二酸,90 mmol/L L-脯氨酸)中,30℃培養30 min后,轉移到100℃水浴中加熱2 min終止酶反應,測定順式-3-羥脯氨酸的質量濃度。
一個酶活單位 (U)定義為每分鐘催化得到1 nmol順式-3-羥脯氨酸的酶量。全細胞酶活是每毫克干菌體的酶活,單位為U/g,其中細胞干重DCW(g/L)=0.54×OD600。
1.2.6 發酵優化單因素實驗 按照1.2.3培養方法,對培養基的成分進行優化。優化的培養基的成分包括:底物L-脯氨酸添加質量濃度(1、5、10、20、40 g/L),不同有機氮源(酵母提取物、胰蛋白胨和玉米漿,質量濃度分別為4、8、12、16、20 g/L),碳源(葡萄糖質量濃度為10、15、20、25、30 g/L;甘油濃度為1、1.25、2.5、5 g/L),亞鐵離子質量濃度(0、1、5、10 mmol/L)以及鎂離子質量濃度(0.1、0.5、1、2 g/dL)。不同因素間進行單獨研究,不考慮不同成分之間的交互影響。
1.2.7 順式-3-羥脯氨酸濃度測定 通過2,4-二硝基氟苯(DNFB)柱前衍生法[11]測定順式-3-羥脯氨酸的質量濃度。發酵液離心后取上清液作為樣品。標準品或樣品用衍生緩沖液溶解,取待測樣品2 mL于10 mL棕色容量瓶中,加入1 mL衍生試劑,60℃避光水浴1 h,冷卻至室溫后用平衡緩沖液定容至10 mL。用0.45 μm的水系濾膜過濾。
HPLC系統包括:日立HPLC系統(輸液泵、紫外檢測器,柱溫箱,進樣器,數字記錄及處理裝置),安捷倫ZORBA SB-Aq(150 mm×4.6 mm,5 μm),操作時柱溫控制在27℃。流動相A:乙酸鈉緩沖液(pH 6.5~6.8),流動相B:50%的乙腈水溶液。洗脫過程采用梯度洗脫:0~6 min,16%的 B相;6~7 min,40%的B相;7~15 min,100%的B相;15~16 min,40%的B相,16~25 min,16%的B相。
2 結果與分析
2.1 脯氨酸-3-羥化酶基因的優化設計和合成
在大腸桿菌中進行異源蛋白表達時,同義密碼子的使用頻率與基因的異源表達水平相關[15]。因此,首先通過基因優化策略,將稀有密碼子替換為大腸桿菌常用密碼子,控制GC含量及脯氨酸-3-羥化酶基因mRNA二級結構,設計合成了一個適合在大腸桿菌中表達的脯氨酸-3-羥化酶基因,進而確保脯氨酸-3-羥化酶的表達效率。脯氨酸-3-羥化酶基因序列的原始序列見GenBank:AF003371.1,脯氨酸-3-羥化酶基因全長873 bp,編碼290個氨基酸。在優化脯氨酸-3-羥化酶基因前,通過Codon Usage Database數據庫對其進行密碼子使用頻率分析,并比較其與大腸桿菌密碼子的使用頻率。結果顯示,來源于鏈霉菌TH1的脯氨酸-3-羥化酶基因部分密碼子使用頻率在大腸桿菌中都有不同程度的降低,如起始密碼子后的CGC,在鏈霉菌TH1中的使用頻率為34.4%,在大腸桿菌中的使用頻率為18.8%;TCG在鏈霉菌TH1中的使用頻率為13.7%,在大腸桿菌中的為 11.4%;CAC在鏈霉菌 TH1中為41.2%,在大腸桿菌中為7.2%。并且從5′端開始就出現了密碼子使用頻率差異較大的情況,不利于脯氨酸-3-羥化酶基因序列的翻譯表達。數據庫的分析結果還顯示,脯氨酸-3-羥化酶基因的GC含量為64.83%,高于大腸桿菌的GC含量(50.80%)。
基因優化結果見表1。首先,通過同義替換的方法改變了稀有密碼子,脯氨酸-3-羥化酶基因的GC含量從64.83%降低到51.78%,更接近大腸桿菌的GC含量。在蛋白質的表達過程中,基因序列5′末端的二級結構會對蛋白質的翻譯產生影響[12],同時RNA 5′末端形成二級結構所需要的能量也影響基因產物的產量。因此利用RNA二級結構預測軟件RNAstructure 5.3對其二級結構進行預測,發現脯氨酸-3-羥化酶基因的mRNA5′末端會形成莖環結構,不利于翻譯的進行。通過同義替換改變27個密碼子,使得脯氨酸-3-羥化酶基因的mRNA5′末端呈打開狀態,見圖2。自由能ΔG由開始的-243.5 kcal/ mol降低到-230.5 kcal/mol,促進核糖體結合到mRNA上,并且順利地進行翻譯。經過優化,共改變了187個脯氨酸-3-羥化酶的堿基,172個密碼子發生了變化,GC含量從64.83%降低到49.31%,更接近于大腸桿菌的GC含量。圖3為鏈霉菌TH1的脯氨酸-3-羥化酶基因序列與優化后的脯氨酸-3-羥化酶基因序列的對比結果。

表1 脯氨酸-3-羥化酶基因優化結果Table 1 Codon optimization process
2.2 重組大腸桿菌的構建
2.2.1 組成型色氨酸串聯啟動子的引入 目前,順式-3-羥脯氨酸微生物合成過程用到的啟動子為IPTG誘導型啟動子,這不利于順式-3-羥脯氨酸作為前體用于合成藥物蛋白產品。因此,作者嘗試采用引入了一個強的啟動子 (色氨酸串聯啟動子)來提高mRNA產量,該策略避免使用有毒誘導劑IPTG同時,也有助于降低生產成本。作者所在實驗室設計合成的色氨酸串聯啟動子Ptrp2全長237 bp,5′端為EcoRI酶切位點,3′端為HindⅢ酶切位點。將色氨酸串聯啟動子Ptrp2插入到目的基因的上游后,轉化至E.coli JM109中,提取重組質粒pES-Ptrp2-P3H。Ptrp2重組質粒pES-Ptrp2-P3H經EcoRI和BamHI雙酶切后,得到1 117 bp和2 716 bp兩個片段,電泳結果見圖4。
經DNA測序后,序列結果正確。

圖2 脯氨酸-3-羥化酶基因mRNA 5’末端二級結構預測結果Fig.2 Potential mRNA secondary structures around the ATG start codon of the unadjusted gene and the adjusted gene

圖3 脯氨酸-3-羥化酶基因優化前(上)與優化后(下)的序列比對Fig.3 Alignment of nucleotide sequences between wild-type gene(upper)and the synthetic optimized(lower)
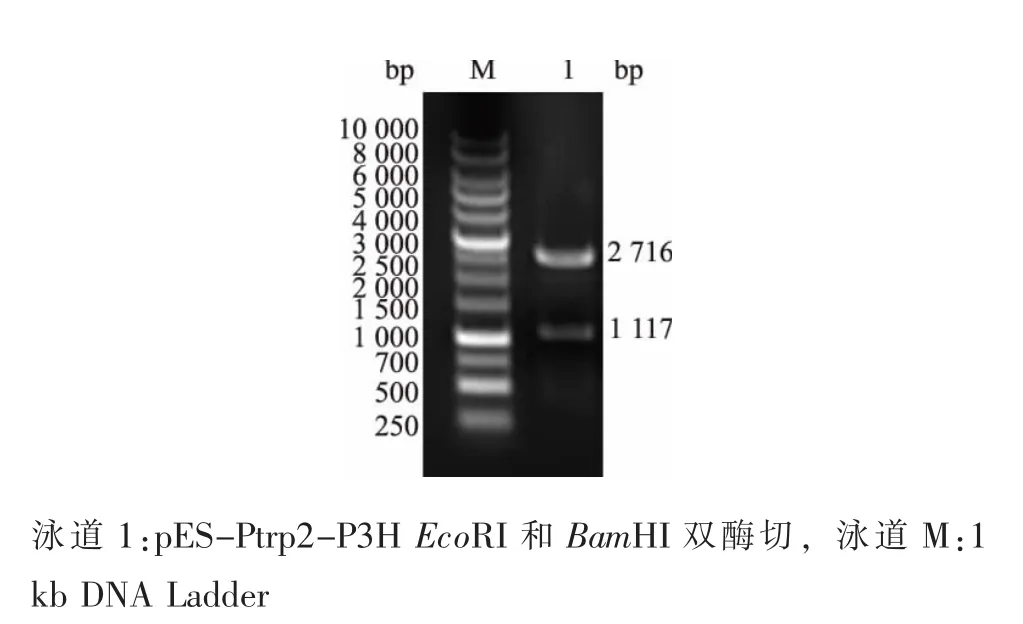
圖4 pES-Ptrp2-P3H雙酶切電泳結果Fig.4 EcoRI-BamHI Double digestion of pES-Ptrp2-P3H
2.2.2 重組大腸桿菌的構建 外源基因在原核生物中高效表達除了要有合適的啟動子外,合適的質粒也是影響蛋白質表達的一個重要因素。為了得到高產順式-3-羥脯氨酸重組大腸桿菌,將連有色氨酸串聯啟動子的脯氨酸-3-羥化酶基因片段分別連接到質粒pUC19、pET21a、pET28a上,構建不同的重組質粒pUC19-Ptrp2-P3H、pET21a-Ptrp2-P3H、pET28a-Ptrp2-P3H,然后將重組質粒轉化至E.coli BL21中,構建不同的重組大腸桿菌。重組大腸桿菌經過一段時間的發酵后,取上清液進行SDS-PAGE分析,結果見圖5。在約33 500的位置出現了目的條帶,表明在重組大腸桿菌中該酶得到了表達。

圖5 SDS-PAGE結果Fig.5 SDS-PAGE
2.2.3 質粒載體的優化 宿主菌細胞類型對質粒穩定性有一定影響,質粒的穩定性又直接影響目的蛋白質的表達。因此合適的質粒是實現目的蛋白質高效表達的一個重要因素。構建4種不同的重組大腸桿菌,通過比較它們酶活高低,尋找到合適的宿主菌與質粒的搭配。取發酵后的菌體,離心后收集菌體,在酶反應緩沖液中30℃反應30 min,測定4種不同重組大腸桿菌的酶活,結果見表2。從表2可以看出,重組大腸桿菌BL21/pET21a-Ptrp2-P3H的酶活最高,達到了722.807 U/g,與H Mori[8]等人的研究結果相比,酶活提高了約7倍。

表2 不同重組菌脯氨酸-3-羥化酶全細胞活性Table 2 Whole cell enzyme activity of different recombinant strains
2.3 重組菌一步法生產順式-3-羥脯氨酸的搖瓶發酵
2.3.1 重組大腸桿菌生長曲線的測定 種子培養是為了獲得足夠多生長代謝旺盛的活菌體。在本研究中,以酶活最高的重組大腸桿菌BL21(DE3)/ pET21a-Ptrp2-P3H為出發菌株,挑取一環單菌落接種于LB中,按1.2.3所述方法進行種子培養。橫坐標為種子的培養時間,縱坐標為種子液OD600,生長曲線見圖6。

圖6 重組大腸桿菌BL21(DE3)/pET21a-Ptrp2-P3H生長曲線Fig.6 Growth curve of recombinant E.coli BL21(DE3)/ pET21a-Ptrp2-P3H
從圖6可以看出,菌種接入種子培養基LB中4 h前后,開始進入對數期,6~10 h為種子的對數期。一般在對數生長期內菌體細胞的代謝活性、酶活性高而穩定,因而對數生長期中后期的菌種為最佳。此后的發酵搖瓶試驗,均選擇種齡為8 h的菌種接入發酵培養基。
2.3.2 搖瓶發酵單因素優化 細菌的生長需要碳源、氮源、無機鹽等營養物質。葡萄糖為菌體細胞的快速碳源,它的過量會形成TCA流溢現象,導致乙酸的過量累積[13],抑制大腸桿菌的生長。同時碳源和氮源的比例[14]也會影響細胞生長和蛋白質表達,最終影響順式-3-羥脯氨酸的產量。此外,各種離子的濃度對菌體生長、酶的表達都有不同的影響,順式-3-羥脯氨酸的產量還會隨著培養條件的變化而變化。因此,必須重視培養基各組分的含量。圖7為各單因素優化結果。
其中圖7(a)為對底物L-脯氨酸優化結果,結果顯示,當底物在1~10 g/L的范圍內時,順式-3-羥脯氨酸的產量隨著底物質量濃度的升高而升高,但當繼續增加底物時,順式-3-羥脯氨酸增幅明顯減小,因此底物適宜的添加量為10 g/L。
圖7(b)為氮源的種類和質量濃度的優化結果。結果顯示,以胰蛋白胨為有機氮源時,順式-3-羥脯氨酸產量高于其他兩組有機氮源,其中16 g/L胰蛋白胨為最優,繼續增加胰蛋白胨質量濃度,順式-3-羥脯氨酸質量濃度反而下降。
圖7(c)為葡萄糖質量濃度的優化結果。當葡萄糖質量濃度低于15 g/L時,順式-3-羥脯氨酸的產量隨著葡萄糖質量濃度的增加而增加;當葡萄糖質量濃度大于15 g/L時,順式-3-羥脯氨酸的積累量開始下降。與葡萄糖相比,甘油的運輸速度更低,使葡萄糖降解過程中碳通量降低,乙酸生成量大幅度降低。因此通過加入遲效氮碳源能夠達到既保證重組菌的生長速度,又高效控制目的蛋白質的表達。以10 g/L的葡萄糖質量濃度為速效碳源,對甘油質量濃度進行優化,結果見圖7(d)。可以看出,當甘油添加量為1.25 g/L時,順式-3-羥脯氨酸的累積量最大。

圖7 單因素優化結果Fig.7 Optimization of the concentration of L-proline,nitrogen sources,carbon source,glycerinum,ferrous ion and magnesium ion
由于脯氨酸-3-羥化酶要發揮羥基化活性需要一種重要的離子作為酶的輔助因子,即亞鐵離子,因此對亞鐵離子的濃度進行優化,結果見圖7(e)。當發酵液中不添加亞鐵離子時,順式-3-羥脯氨酸的累積量能達到約250 mg/L左右,可能是由于胰蛋白胨中含有一定濃度的Fe2+。隨著Fe2+濃度的升高,順式-3-羥脯氨酸的累積量不斷升高,當Fe2+濃度為1 mmol/L時,順式-3-羥脯氨酸的質量濃度最高,繼續增加Fe2+濃度,順式-3-羥脯氨酸累積量逐漸減小。
重組大腸桿菌的發酵曲線表明,順式-3-羥脯氨酸的產量與菌體的濃度偶聯,適當濃度的鎂離子能明顯促進菌體的生長。因此,在重組大腸桿菌發酵過程中,補充適當濃度的鎂離子對順式-3-羥脯氨酸的累積非常重要。鎂離子的濃度優化結果見圖7(f)。鎂離子質量濃度在0.01~0.05 g/dL間,順式-3-羥脯氨酸的質量濃度隨鎂離子質量濃度的增加而增加,當鎂離子質量濃度大于0.5 g/dL時,產酸隨著鎂離子質量濃度的增加而減小。
優化的培養基為:葡萄糖1 g/dL,甘油0.125 g/dL,胰蛋白胨 1.6 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO41 mmol/L,MgSO40.5 g/dL,CaCl20.015 g/dL,脯氨酸10 g/L。
2.3.3 重組大腸桿菌發酵生產順式-3-羥脯氨酸按上述培養基對重組大腸進行搖瓶發酵,以時間為橫坐標,產酸和OD600為縱坐標繪制曲線,見圖8。可以看出,發酵24 h順式-3-羥脯氨酸能夠累積約0.80 g/L,產量提高了約2倍。

圖8 重組大腸桿菌發酵曲線Fig.8 Fermentation process curve of recombinant E.coli
3 結語
為了生產適用于藥物蛋白合成的順式-3-羥脯氨酸,作者通過引入色氨酸串聯啟動子成功構建了一株高產順式-3-羥脯氨酸的重組大腸桿菌。該菌在初步優化培養基(葡萄糖1 g/dL,甘油0.125 g/dL,胰蛋白胨1.6 g/dL,(NH4)2SO40.5 g/dL,K2HPO40.1 g/dL,NaCl 0.2 g/dL,FeSO41 mmol/L,MgSO40.5 g/dL,CaCl20.015 g/dL,脯氨酸 10 g/L,pH 7.5)上能一步法原位合成順式-3-羥脯氨酸,搖瓶發酵24 h順式-3-羥脯氨酸0.80 g/L,比優化前發酵產量提高一倍以上,實現了“一鍋法”直接生產順式-3-羥脯氨酸,具有較好的工業化生產前景。
[1]BACH T M H,TAKAGI H.Properties,metabolisms,and applications of L-proline analogues[J].Appl Microbiol Biotechnol,2013,97:6623-6634.
[2]WENG Lushui,CHEN Fen,XIAO Guoying.Optimization and functionalverification ofCry2Aa gene[J].Journal of Agricultural Biotechnology,2013,21(11):1261-1269.(in Chinese)
[3]SHIBASAKI T,MORI H,OZAKI A.Cloning of an isozyme of proline 3-hydroxylase and its purification from recombinant Escherichia coli[J].Biotechnology Letters,2000,22:1967-1973.
[4]KALAMKAR N B,KASTURE V M,DHAVALE D D.Total synthesis of natural cis-3-hydroxy-L-proline from D-glucose[J]. Tetrahedron Letters,2010,51:6745-6747.
[5]JOHNSTON R M,CHU L N,LIU M,et al.Hydroxylation of L-proline to cis-3-hydroxy-L-proline by recombinant Escherichia coli expressing a synthetic L-proline-3-hydroxylase gene[J].Enzyme and Microbial Technology,2009,45:484-490.
[6]KLEINlein C,HUTTEL W.A simple procedure for selective hydroxylation of L-proline and L-pipecolic acid with recombinantly expressed proline hydroxylases[J].Advanced Synthesis&Catalysis,2011,353:1375-1383.
[7]GORRES K L,RAINES R T.Prolyl 4-hydroxylase[J].Critical Reviews in Biochemistry and Molecular Biology,2010,45(2):106-124.
[8]MORIori H,SHIBASAKI Y,OCHIAI K,et al.Detection of novel proline 3-hydroxylase activities in streptomyces and Bacillus spp.by regio-and stereospecific hydroxylation of L-proline [J].Applied and Environmental Microbiology,1996,62:1903-1907.
[9]MORI H,SHIBASAKI Y,YANO K.Purification and cloning of a proline 3-hydroxylase,a novel enzyme which hydroxylates free L-proline to cis-3-hydroxy-L-proline[J].Journal of Bacterilogy,1997,179:5677-5683.
[10]MIROUX B,WALKER J E.Over-production of proteins in Escherichia coli:mutant hosts that allow synthesis of some membrane proteins and globular proteins at high levels[J].Journal of Molecular Biology,1996,260(3):289-298.
[11]LI Dong,SUN Jiayi.Determination of 18 kinds of amino acids by HPLC with precolumn 2,4-dinitrofluorobenzene derivatization [J].Chemical Analysis and Meterage,2004,13(1):289-298.(in Chinese)
[12]ZHENG Zhongcheng.RNA secondary structure prediction algorithms[J].Chemical of Life,2000,20(4):176-178.(in Chinese)
[13]HAN K,LIM H C,HONG J.Acetic acid formation in Escherichia coli fermentation[J].Biotechnology and Bioengineering,1992,39(6):663-671.
[14]CHEN G,STREVETT K A.Impact of carbon and nitrogen condition on E.coli surface thermodynamics[J].Colloids and Surfaces B:Biointerfaces,2003,28(2-3):135-146.
Construction of Recombinant Escherichia coli Strains Producing cis-3-Hydroxyproline and Preliminary Optimization of the Fermentation Conditions
YAO Xuena1,2,3, ZHANG Zhenyu*1,2,3, SUN Fubao1,2,3, CHEN Chang1,2,3, HUANG Jianhua1,2,3, SHEN Song1,2,3
(1.SchoolofBiotechnology,Jiangnan University,Wuxi214122,China;2.Key Laboratory ofIndustrial Biotechnology,Jiangnan University,Wuxi 214122,China;3.Key Laboratory of Carbohydrate Chemistry and Biotechnology,Ministry of Education,Wuxi 214122,China)
The cis-3-hydroxy-L-proline can be used to synthesize many anticancer drugs with important commercial value.At present,cis-3-hydroxyproline is produced with IPTG-inducible recombinants in two steps.The subject of this study is to construct a recombinant with high proline-3-hydroxylase activity and generate cis-3-hydroxyproline without adding IPTG which is expensive and toxic.We constructed the recombinant plasmid pES-Ptrp2-P3H and transformed E.coli BL21 (DE3)successfully.Compared with the original gene sequence of proline 3-hydroxylase,168 nucleotides were changed and the GC percentage was reduced from 64.83%to 49.31%.The preliminarily optimized medium was 1 g/dL glucose,0.125 g/dL glycerinum,1.6 g/dLtryptone,0.5 g/dL(NH4)2SO4,0.1 g/dL K2HPO4,0.2 g/dL NaCl,1 mmol/L FeSO4,0.5 g/dL MgSO4,0.015 g/dL CaCl2,10 g/L L-proline,and pH valve at 7.5.At shaking flask level,cis-3-hydroxyproline was accumulated to about 0.8 g/L in 24 h,which was one times higher than before.It provides the basis for the industrialization of cis-3-hydroxyproline bioproduction.
proline-3-hydroxylase,cis-3-hydroxyproline,codon optimization,construction of recombinant Escherichia coli,fermentation optimize
Q 815
A
1673—1689(2017)03—0243—09
2015-02-15
國家自然科學基金項目(30800018;30970058);江蘇省自然科學基金項目(BK2012554);高等學校博士學科點專項科研基金項目(200802951036);工業生物技術教育部重點實驗室主任基金項目(KLIB-ZR200801)。
*通信作者:張震宇(1976—),男,江蘇張家港人,理學博士,教授,碩士研究生導師,主要從事微生物產品的制備技術和發酵工藝方面的研究。E-mail:zhangzy@jiangnan.edu.cn
姚雪娜,張震宇,孫付保,等.產3-羥脯氨酸重組菌的構建及發酵優化[J].食品與生物技術學報,2017,36(03):243-251.

