副溶血弧菌TDH的原核表達及單克隆抗體的制備
黎晶晶, 黎珊珊, 于艷麗
(1.浙江醫藥高等專科學校 生物與制藥學院,浙江 寧波 315000;2.天津市河北區疾病防疫控制中心,天津300100;3.浙江大學明州醫院,浙江 寧波315000)
副溶血弧菌TDH的原核表達及單克隆抗體的制備
黎晶晶1, 黎珊珊2, 于艷麗3
(1.浙江醫藥高等專科學校 生物與制藥學院,浙江 寧波 315000;2.天津市河北區疾病防疫控制中心,天津300100;3.浙江大學明州醫院,浙江 寧波315000)
為實現副溶血性弧菌tdh基因的原核表達,采用TCBS選擇培養基從貝類中篩選副溶血性弧菌疑似菌株;根據GenBank上已有的tdh基因序列,設計并人工合成引物,通過PCR技術鑒定副溶血性弧菌并擴增tdh基因;酶切后定向插入到pET-28a表達載體中,構建重組表達質粒pET-28a-tdh,轉入E.coli Rosetta中,在IPTG誘導下進行TDH蛋白表達。為制備耐熱直接溶血毒素TDH單克隆抗體,用純化的蛋白作為免疫原免疫BALB/c小鼠,成功用原核載體表達的TDH蛋白為免疫原,制得一株能穩定分泌單克隆抗體的雜交瘤細胞,命名為T9N10。獲取腹水并經Ni-NTA Resin親和柱純化,其穩定分泌的單克隆抗體經鑒定為IgG1,相對分子質量約為146 000,并表現出較強的特異性。本研究為開發副溶血弧菌免疫學快速檢測和深入的研究奠定良好的物質基礎。
副溶血性弧菌;耐熱直接溶血毒素;原核表達;單克隆抗體;制備
近年來,由感染引起的食物中毒已經成為了嚴重的食源性公共衛生問題。副溶血性弧菌(Vibrio Parahaemolyticus,VP)是一種嗜鹽性細菌,主要存在于近海岸的魚類、貝類等海產品中,人食用污染有該致病菌的海產品后可引起胃腸炎,嚴重時還會引起敗血癥[1]。沿海地區檢測出多起由VP引起的食物中毒事件[2-5]。浙江沿海地區海水養殖的大量魚、蝦、貝類,副溶血性弧菌也是主要病原,每年由此菌引起的弧菌病給養殖業也造成嚴重的損失[6-7]。
溶血毒素是副溶血性弧菌致病的主要原因。研究表明,副溶血弧菌的溶血毒素主要有耐熱直接溶血毒素(TDH)、相對耐熱直接溶血毒素(TRH)和不耐熱溶血毒素(TLH)。研究者發現,TDH幾乎全部由臨床分泌株分泌,只有5%的環境分離株能產生TDH[8]。已發現寧波地區引起感染性腹瀉的副溶血性弧菌,tdh基因攜帶率達到98.59%[9],TDH可以作為副溶血性弧菌毒性的標志。目前,國內外針對TDH檢測副溶血性弧菌的研究,大多采用PCR技術[10-11],利用免疫學法的研究較少。因此,建立一種副溶血性弧菌TDH快速、靈敏的免疫學檢測技術,對環境監測與食品安全檢測具有重要的意義。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株和細胞株 副溶血性弧菌VP1-3:分離自寧波地區菜市場購買海產品;大腸桿菌(Escherichia coli)、枯草桿菌(Bacillus subtilis)、金黃葡萄球菌(Staphylococcus aureus):作者所在實驗室保存;副溶血性弧菌ATCC 33846、非致病性副溶血性弧菌:浙江大學明州醫院饋贈;E.Coli DH5α、E. Coli Rosetta、pET-28a質粒和小鼠骨髓瘤SP/20細胞:中國藥科大學微生物與生化藥學實驗室饋贈。
1.1.2 培養基、試劑 DNA提取試劑盒(140711):北京博凌科為生物科技有限公司;TCBS瓊脂:北京陸橋生物有限公司;HRP標記二抗、OPD、HAT、HT選擇培養基、抗體類型試劑盒、IPTG、無血清DMEM等:南京建成生物工程研究所。BamHI和EcoRI限制性內切酶、DNA Marker DL2000、DL15000、蛋白質相對分子質量Marker、T4 DNA連接酶、SDS、PAGE、Ni-NTA Resin親和柱等:寶生物工程(大連)有限公司。
1.1.3 試驗動物 8周BALB/c清潔級雌性小鼠:上海萊克斯實驗動物有限公司。
1.2 方法
1.2.1 副溶血性弧菌的分離和培養 參照國家標準GM/T4789.7-2008《食品衛生微生物學檢驗副溶血弧菌檢驗》方法處理貝類[12]。從平板上挑取有特征的單克隆菌落再接種于TCBS瓊脂平板上,37℃培養24 h。挑取19株疑似菌落接種于5 mL牛肉浸膏培養基中,37℃、180 r/min培養12 h后,做下一步鑒定。
1.2.2 PCR檢測
1)細菌總DNA提取:按照DNA提取試劑盒說明書操作。
2)PCR檢測:從GenBank上獲得副溶血弧菌tdh基因的 DNA序列 (GenBank accession no. M10069),應用Premier 5.0軟件設計了一對引物如下:
R1:5’-GCGGATCCATGAAACACCAATATTTT GC-3’(含BamHI酶切位點)
R2:5’-CGGAATTCTTATTTTTATTGTTGATGT-3’(含EcoRI酶切位點)
以21株疑似細菌基因組DNA為模板,通過PCR擴增tdh基因片段。反應程序:95℃預變性5 min,94℃變性 30 s,55℃退火 45 s,72℃延伸 1 min,重復35個循環,72℃保持10 min。產物用1 g/dL瓊脂糖凝膠電泳進行檢測,DNA回收試劑盒回收目的片段。
1.2.3 TDH蛋白在大腸桿菌中的誘導表達
1)tdh基因原核表達載體的構建及鑒定:將載體pET-28a分用限制性內切酶(BamHI和EcoRI)進行酶切,用T4-DNA連接酶與目的片段在16℃連接,構建表達載體pET-28a-tdh,將連接產物轉化至大腸桿菌DH5α感受態細胞中,用LB瓊脂平板(含kanamycin 100 μg/mL)篩選。篩選陽性克隆,提取質粒DNA,用BamHI和EcoRI雙酶切后送上海生工生物工程有限公司測序鑒定。
2)pET-28a-tdh在大腸桿菌Rosetta中的誘導表達:將構建的重組表達質粒pET-28a-tdh轉入大腸桿菌Rosetta中,挑取陽性克隆接種于LB液體培養基(含kanamycin 100 μg/mL)中,37℃、180 r/min搖床培養至OD600nm為0.4~0.6后,加入IPTG(終濃度為0.5 mmol/L)進行誘導表達,3~6 h后收集菌體,按文獻[13]表達蛋白質的SDS-PAGE電泳操作進行分析。
1.2.4 重組TDH的純化 按1.2.3方法,加入IPTG誘導,至OD600nm值最大時收集菌體沉淀,沉淀加入含尿素的緩沖液,超聲20 min,于4℃、12 000 r/min離心20 min,收集上清液,經0.45 μm微孔濾膜過濾,濾液按照ProteinPure-Ni-NTA Resin親和柱的操作手冊,蛋白質純化后進行SDS-PAGE電泳分析。
1.2.5 免疫動物 免疫8周齡BALB/c小鼠,取純化的TDH 10 μg與弗氏完全佐劑充分混合后,通過腹腔注射進行首次免疫,隔周用5 μg TDH加強免疫,3次后取小鼠尾靜脈血用間接ELISA法作抗體效價測試,呈明顯陽性的小鼠5 μg TDH加強免疫,3 d后取脾細胞作細胞融合。
1.2.6 細胞融合 融合前1周復蘇凍存的小鼠骨髓瘤SP2/0細胞。取小鼠脾細胞,置于無菌篩網上,充分研磨脾臟,收集脾細胞。取SP/20細胞與脾細胞(1∶5),用無血清的DMED培養液清洗,1 000 r/min離心5 min后,棄上清液。沉淀中加入1 mL PEG1500溶液,充分混勻;靜置10 min后加入25 mL無血清DMED培養液以終止PEG作用;1 000 r/min離心5 min,棄上清液;沉淀用含15%胎牛血清的HAT選擇培養液混勻,轉移至96孔板中,每孔加樣100 μL,置37℃細胞培養箱中培養。
1.2.7 雜交瘤細胞的篩選與克隆 按文獻[14]方法篩選陽性雜交瘤細胞。保存對目標抗原具有特異性的陽性雜交瘤細胞株。
1.2.8 腹水的制備與純化 選取8周大小的BALB/c小鼠,每只腹腔注射300 μL液體石蠟,5 d后腹腔注射陽性雜交瘤細胞,每只小鼠注射1×106個細胞,8~10 d后收集腹水。抗體的純化采用辛酸硫酸銨沉淀法[15-16],用SDS-PAGE分析獲得抗體的純度。
1.2.9 間接ELISA檢測單克隆抗體特異性 將大腸桿菌、金黃葡萄球菌、沙門桿菌和非致病性副溶血性弧菌進行液體增菌培養,37℃、24 h后分別吸取菌液上清液100 μL包被96孔板,用PBS作空白對照;以待檢測雜交瘤細胞上清液為一抗進行單克隆抗體特異性鑒定。
2 結果與分析
2.1 副溶血性弧菌的分離與培養
副溶血性弧菌疑似株在TCBS選擇培養基上培養24 h后,菌落呈藍綠色、邊緣整齊、濕潤有黏性、半透明的菌落,直徑約2~4 mm,共分離出19株疑似菌株。
2.2 副溶血弧菌的PCR鑒定
分別以19株疑似菌株DNA為模板,以R1、R2為引物進行PCR擴增,電泳結果見圖1。共有3個樣品在570 bp附近有條帶,與tdh基因大小相符,命名為VP1-3,檢出率為15.79%。

圖1 19株疑似菌株tdh基因PCR擴增結果Fig.1 PCR amplification products of tdh gene from 19 suspected strains
2.3 TDH蛋白在大腸桿菌中的誘導表達和純化
將膠回收的PCR產物及表達載體pET-28a經BamHI和EcoRI雙酶切,連接、轉化至大腸桿菌5Hα感受態細胞。提取質粒,質粒再經雙酶切后經鑒定出現兩條帶,一條約5 300 bp,另一條約為570 bp,結果見圖2。測序結果表明,該質粒中含有目的基因片段,且讀碼框正確,獲得重組表達質粒pET-28a-tdh。
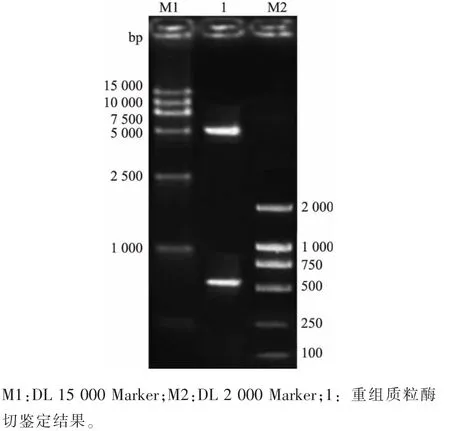
圖2 重組質粒pET-28a-tdh的酶切鑒定結果Fig.2 Restriction enzyme analysis of pET-28a-tdh
獲得的pET-28a-tdh重組質粒轉化到大腸桿菌DH5α感受態細胞,經IPTG誘導培養,經SDSPAGE電泳發現,誘導菌體在約23 000處出現了一條蛋白質帶,分別取上清液和沉淀進行SDS-PAGE檢測,結果顯示目的蛋白質主要在沉淀中,說明目的蛋白質呈包涵體表達。表達產物經ProteinPure-Ni-NTAResin親和柱純化后得到純化蛋白質,見圖3。
2.4 TDH單克隆抗體的制備與鑒定
經過3次免疫后的小鼠血清進行間接ELISA測定,1號和4號小鼠的血清抗體效價均在1∶105以上,均可選擇其脾細胞進行下一步細胞融合。選擇1號和4號小鼠脾細胞與SP2/0骨髓瘤細胞融合后,經選擇培養和間接ELISA篩選,獲得3株具有抗體分泌能力的雜交瘤細胞,經3次有限稀釋亞克隆及擴大培養后,獲得能穩定分泌的雜交瘤細胞1株,經小鼠單克隆抗體亞型快速鑒定試劑盒檢測為IgG1,輕鏈屬Kappa型,命名為T9N10。
利用腹水制備抗體,收集到的腹水通過ELISA法進行效價檢測,效價大于1∶105。采用辛酸硫酸銨沉淀法純化抗體,SDS-PAGE電泳結果見圖4。純化效果良好,抗體重鏈大約為50 000,輕鏈約為25 000。
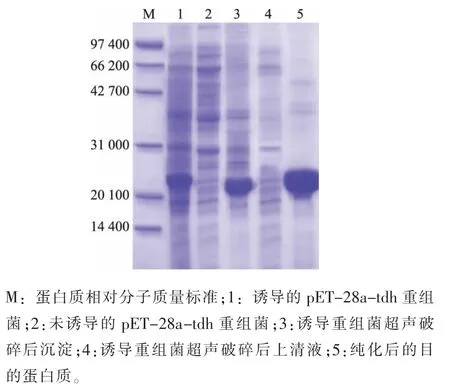
圖3 pET-28a-tdh表達產物的SDS-PAGE分析Fig.3 Analysis of pET-28a-tdh products by SDS-PAGE
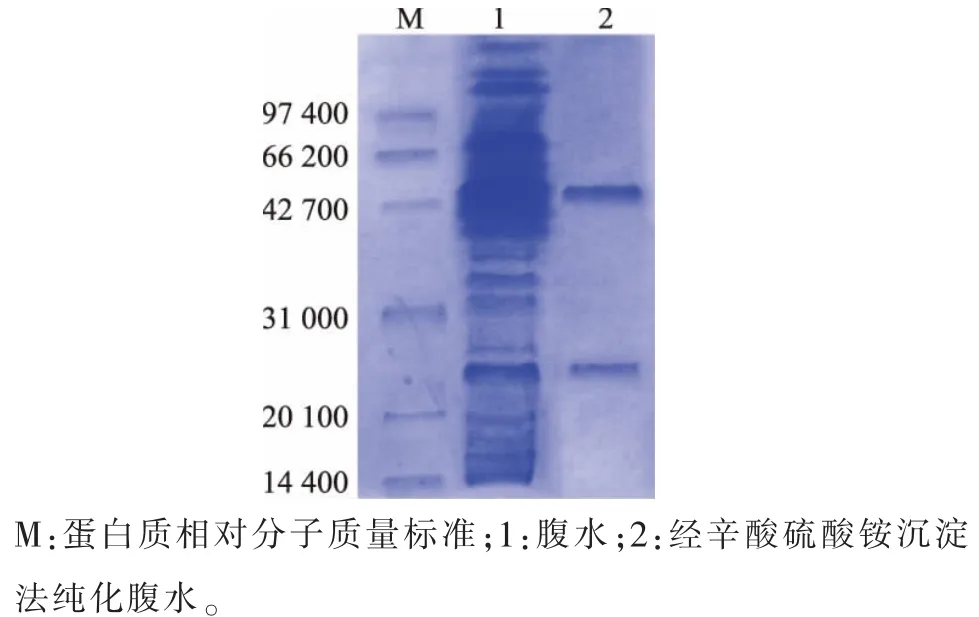
圖4 小鼠腹水純化電泳圖Fig.4 SDS-PAGE figure for purification of ascites from BALB/c mice
2.5 單抗的特異性分析
用大腸桿菌、金黃葡萄球菌、枯草桿菌、非致病性副溶血性弧菌(無TDH)和ATCC33846的菌液包被96孔板,同時用TDH做陽性對照,結果見表1。間接ELISA結果表明,T9N10只與TDH反應呈陽性,與其他菌液都呈現陰性,不發生交叉反應,故判斷T9N10具有良好的抗體特異性。
3 結語
國家食源性疾病監測網顯示,副溶血性弧菌引起的食物中毒,居衛生性食物中毒首位。浙江沿海地區尤為突出,目前研究認為副溶血性弧菌產生的耐熱性溶血毒(TDH)是主要的致病因子[18],因此制備出特異性針對副溶血性弧菌TDH的單克隆抗體有助于開發免疫學快速檢測方法。
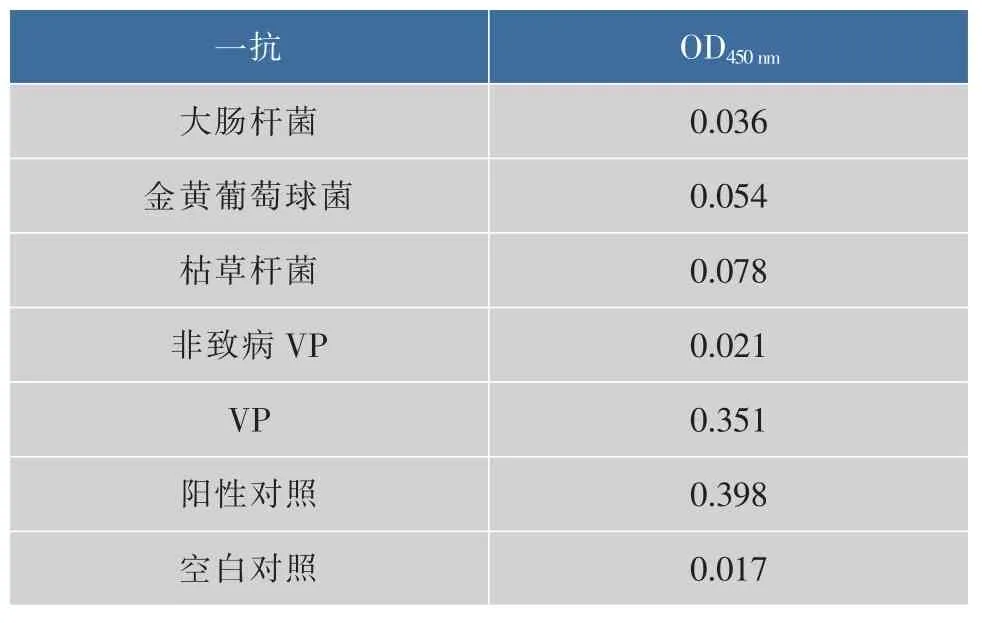
表1 單抗的特異性試驗結果Table 1 Specific test results of monoclonal antibodies
作者利用PCR技術從實驗室篩得的疑似副溶血性弧菌的基因組DNA中成功克隆了tdh基因序列,并成功構建了pET-28a-tdh原核表達的載體;經IPTG誘導,外源基因可在原核生物中表達,SDSPAGE分析證實重組蛋白的相對分子質量約為23 000,與推測的理論產物大小一致。外源基因在原核表達系統中以融合蛋白的形式表達,避免了細菌蛋白酶降解;同時運用pET-28a表達載體,表達產物中含有6×His標簽,利用Ni-NTA Resin親和柱與His結合的特異性可直接純化目的蛋白。
用本實驗室制備的TDH蛋白制備的單克隆抗體即可以特異性識別純化的TDH蛋白,也可識別副溶血性弧菌分泌的TDH蛋白,具有良好的免疫特異性,為后續建立免疫學檢測方法和深入的研究奠定良好的物質基礎。
[1]ALTEKRUSE S F,BISHOP R D,BALDY L M,et al.Vibrio gastroenteritis in the US gulf of mexico region:the role of raw ostrea [J].Epidemiol Infect,2000,124:489-495.
[2]ZHOU Xiaohong,HE Yufang,XI Shengjun,et al.Investigation of food poisoning caused by vibro O4K8[J].Zhejiang Preventive Medicine,2011,23(1):52-55.
[3]WU Kui,WU Qingping,ZHANG Jumei,et al.Genetic diversity and pathogenicity research on Vibrio parahaemolyticus strains isolated from pearl river delta district[J].Modern Food Science and Technology,2015,31(7):283-293.(in Chinese)
[4]ZHAO Yanrong,WANG Zhen,LIU Biyao,et al.Epidemiology of food poisoning in Zhejiang province,2006-2011[J].Disease Surveillance,2012,27(4):307-310.(in Chinese)
[5]ZHENG Wenlong,WANG Zhuo,DONG Jie,et al.Vibrio parahaemolyticus contamination and pathogenicity in aquatic products in Tianjin:a cross-sectional study[J].Journal of Environment and Health,2015,32(6):540-543.(in Chinese)
[6]MAO Zhijuan,LIU Guoyong,CHEN Changfu.Isolation and identification of phthogenic bacteria causing ulcerosis in large yellow craker(Pseudosciaena crocea)[J].Journal of Anhui Agricultural University,2002,29(2):178-181.(in Chinese)
[7]LI Xiangping,MAO Zhijuan,HU Dayan,et al.Isolation and identification vibrio parahaemolyticus in mariculture seashells from Ningbo area[J].Journal of Huazhong Agricultural University,2008,27(2):273-278.(in Chinese)
[8]LI Yi,ZHU Xinqiang.The research of Vibrio parahaemolyticus and its hemolytic toxin[J].Chinese Journal of Health Laboratory Technology,2008,18(12):2835-2849.(in Chinese)
[9]XIE Hongyi,ZHOU Fangman,HAN Dongsheng,et al.Phenotypic and molecular characteristics of Vibrio parahaemolyticus associated with acute diarrhea in Ningbo,Zhejiang province,China[J].Chinese Journal of Clinical Laboratory Science,2013,31(10):792-794.(in Chinese)
[10]RIZVI A V,BEJ A K.Multiplexed real-time PCR amplification of tld,tdh and trh genes in Vibrio parahaemolyticus and its rapid detection in shellfish and gulf of Mexico water[J].Antonie Van Leeuwenhoek,2010,98(3):279-290.
[11]GONG Yujiao,HE Zheng,CHEN Jiandong,et al.Detection of viable but non-culturable Vibrio parahaemolyticus in frozen food by reverse transcription PCR[J].China Preventive Medicine,2010,11(10):988-990.(in Chinese)
[12]ZHANG Junxian,GUO Ailing,ZHANG Huaying.Investigation on contamination of Vibrio parahaemolyticus in aquatic products in Wuhan city[J].Chinese Journal of Health Laboratory Technology,2011,21(3):718-719.(in Chinese)
Expression of TDH from Vibrio parahaemolyticus and Preparation of Monoclonal Antibody against TDH
LI Jingjing1, LI Shanshan2, YU Yanli3
(1.Biology and Pharmaceutical Department,Zhejiang Pharmaceutical School,Ningbo 315000,China;2.Tianjin Hebei Center for Disease Control and Prevention,Tianjin 300100,China;3.Zhejiang University Mingzhou Hospital,Ningbo 315000,China)
To express of tdh gene in E.coli,TCBS medium was used to select the suspected strains of Vibrio parahaemolyticus(VP).Primers were designed and synthesized to identify VP and amplify tdh gene based on the gene sequence from GenBank.The PCR gene product was ligated into prokaryotic expression vector pET-28a,and then the recombinant plasmids pET-28a-tdh was transformed into E.coli Rosetta.TDH protein was expressed by IPTG induction.To prepare monoclonal antibody against TDH (thermostable direct hemolysin)produced by VP,the purified TDH was used to immune BALB/c mice.The hybrid tumor cells named as T9N10 were prepared to secrete monoclonal antibodies by conventional prepared techniques.The secreted monoclonalantibodies are IgG1,which was 146 000 weight,and showed strong specificity.Results provide new insights to immunological rapid detection and research.
Vibrio parahaemolyticus,VP,TDH (thermostabledirecthemolysin),prokaryotic expression,monoclonal antibody,preparation
R 392.12
A
1673—1689(2017)03—0331—05
2015-03-22
浙江醫藥高等專科學校教學科研項目(2012024)。
黎晶晶(1981—),女,內蒙古呼倫貝爾人,微生物與生化藥學專業博士研究生。E-mail:pingljj@126.com
黎晶晶,黎珊珊,于艷麗.副溶血弧菌TDH的原核表達及單克隆抗體的制備[J].食品與生物技術學報,2017,36(03):331-335.

