結直腸癌患者術后服用十全大補湯聯合化療對血清TGF-β1水平的影響
王本軍,白克運,李云霞
(1山東中醫藥大學附屬醫院,濟南250014;2濟南市槐蔭人民醫院)
結直腸癌患者術后服用十全大補湯聯合化療對血清TGF-β1水平的影響
王本軍1,白克運1,李云霞2
(1山東中醫藥大學附屬醫院,濟南250014;2濟南市槐蔭人民醫院)
目的 觀察結直腸癌根治術患者術后口服十全大補湯聯合化療對血清TGF-β1水平的影響。方法 將60例施行結直腸癌根治術患者隨機分為觀察組和對照組各30例,術后第14天行第1周期化療,采用FOLFOX4化療方案治療12個周期;觀察組術后第7天開始口服十全大補湯,直至化療結束。術后第1周、6個月以及12個月采用ELISA法檢測血清TGF-β1,觀察術后1年復發情況。結果 兩組術后第1周血清TGF-β1水平無統計學差異,術后第6、12個月時血清TGF-β1水平均較術后第1周下降(P均<0.01),且同時點觀察組血清TGF-β1水平低于對照組(P均<0.01)。術后1年內觀察組復發1例(3.33%),對照組復發4例(13.33%);兩組復發率比較,P<0.01。結論 結直腸癌根治術患者術后服用十全大補湯聯合化療可降低血清TGF-β1水平,從而降低結直腸癌患者術后復發。
結直腸癌;十全大補湯;中藥;化學療法;轉化生長因子β1;腫瘤復發
轉化生長因子β1(TGF-β1)是具有強大作用的免疫抑制因子,對腫瘤逃避正常的免疫監視起到非常重要的作用,同時可促進腫瘤新生血管生成,誘導上皮間質轉化致腫瘤轉移,與腫瘤的發生、發展、轉移等關系密切[1~3]。在以往的研究中,十全大補湯的抗癌療效已經獲得肯定,可增強人體的免疫監控能力,從人體整體角度減少癌細胞的免疫逃逸作用已得到初步認識;但是,在多靶點調控TGF-β1表達減少結直腸癌根治性切除術后復發和轉移等方面,尚未見相關報道。我們對30例結直腸癌患者術后應用十全大補湯口服聯合化療,觀察其血清TGF-β1水平變化,旨在探討十全大補湯減少結直腸癌根治術后復發轉移的價值。
1 資料與方法
1.1 臨床資料 入選標準:①年齡18~80歲;②經結腸鏡和術后病理證實為原發性結直腸癌;③術前均未行放化療及生物治療等抗腫瘤治療者;④排除有廣泛腫瘤轉移,合并病情較重的貧血、糖尿病、心腦血管疾病以及肝、腎、造血系統等疾病,以及合并急性腸梗阻、消化道大出血、穿孔等急癥手術者;⑤順利實施結直腸癌根治術,均由同一組醫生完成;⑥能夠堅持使用FOLFOX4方案化療及中藥治療者。于山東中醫藥大學附屬醫院2013年6月~2015年6月選擇符合標準者60 例,男34 例、女26 例,年齡(58.53±13.09)歲;結腸癌22 例, 直腸癌38 例。將患者隨機分為觀察組和對照組各30例,其臨床資料具有可比性。本研究經醫院倫理委員會審核批準,患者或家屬均知情同意。
1.2 治療方法 兩組自術后第1天起,常規應用抗生素,靜脈營養支持,于術后第14天行第1周期化療,采用FOLFOX4化療方案治療。FOLFOX4方案:奧沙利鉑(LOHP) 85 mg/m2,靜脈滴注2 h,第1天;亞葉酸鈣(CF)200 mg/m2,靜脈滴注2 h,第1~2天;5-氟尿嘧啶(5-FU) 400 mg/m2,靜脈推注,第1~2天;5-FU 600 mg/m2,持續靜脈滴入22 h,第1~2天,14 d為1 個周期,共化療12個周期。觀察組術后第7天(患者胃腸功能恢復)開始口服十全大補湯,早、晚各1次,直至化療結束。十全大補湯組成及藥物用量:熟地30 g,茯苓30 g,人參12 g,炙甘草9 g,肉桂6 g,川芎15 g,白術30 g,當歸15g,白芍15g,黃芪30 g 。
1.3 血清TGF-β1檢測方法 分別于結直腸癌根治術后第1周、6個月以及12個月時,抽取清晨空腹外周靜脈血2 mL,以EDTA-Na2抗凝;4 ℃下3 000 r/min離心5 min,取血清-80 ℃冰箱保存待測。采用ELISA法檢測血清TGF-β1,操作嚴格按試劑盒說明進行。人TGF-β1檢測試劑盒由上海博蘊生物科技有限公司提供。
1.4 腫瘤復發觀察方法 術后均隨訪1年,如臨床懷疑腫瘤復發,復查血清CEA、CA19-9水平升高,行結腸鏡檢查、胸腹盆CT掃描,必要時可行PET-CT檢查來判定結直腸癌復發。
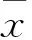
2 結果
2.1 兩組術后各時點血清TGF-β1水平比較 兩組術后第1周血清TGF-β1水平無統計學差異,表明二者在用藥治療前具有可比性;兩組術后第6、12個月時血清TGF-β1水平均較術后第1周下降(P均<0.01),且同時點觀察組血清TGF-β1水平低于對照組(P均<0.01)。見表1。
表1 兩組術后各時點血清TGF-β1水平比較
注:與同組要后第1周比較,*P<0.05;與對照組同時點比較,#P<0.05。
2.2 兩組術后1年內復發情況比較 術后1年內觀察組復發1例(3.33%),對照組復發4例(13.33%);兩組復發率比較,P<0.01。
3 討論
結直腸癌術后復發是影響患者術后生存率至關重要的因素,其過程非常復雜。對于術后復發的原因,目前有以下幾方面的論述:①腫瘤轉移基因如Bmi-1[4]、S100A4[5]在結直腸癌中表達普遍上調,且介導腫瘤的生物學行為,可促進腫瘤轉移。②癌癥復發和轉移不僅依靠新生血管形成,還與細胞外基質降解有關;復發轉移過程中,癌細胞須先突破細胞外基質,然后沿基底膜缺損和基質空隙向周圍生長,最終引起腫瘤的復發轉移[6]。③腫瘤炎性微環境通過調節上皮細胞向間充質細胞轉變來啟動腫瘤轉移,通過降解細胞外基質破壞細胞外基質膜促進腫瘤細胞侵襲;同時,炎性微環境可促進腫瘤血管新生,為腫瘤的發生、發展提供保障[7]。
TGF-β1是一種功能多樣的細胞因子,目前許多研究證實其可調節不同細胞的多種生物學過程,比如細胞的增殖、分化、凋亡以及運動[8],且具有雙向調節作用。研究[9,10]表明,在正常組織和腫瘤組織中TGF-β1具有完全不同的功能。在正常腸上皮細胞中和腫瘤的早期階段,TGF-β1信號通路通過抑制細胞增殖、促進分化和凋亡發揮抑制腫瘤作用;但在腫瘤發展的晚期,TGF-β1起到促進腫瘤復發、轉移和腫瘤干細胞的維護[11],這個開關可以觸發是因為腫瘤細胞利用了TGF-β1信號通路。此外有報道稱,TGF-β1可以實現誘導EMT的發生,此過程需要通過調控逆轉錄因子的表達來實現[12];同時該因子不僅可影響機體自身的腫瘤細胞來誘導 EMT ,也可經由旁分泌通過調節胞外基質的方式來實現[13]。潛在的TGF-β1復合體在惡性腫瘤不同分化和病理階段逐步增加,而且只有TGF-β1高水平才會降低癌癥患者生存率[14]。
近年來,盡管通過手術、放化療以及靶向治療對于結直腸癌的治療取得良好效果,但是仍然不能將癌細胞全部消滅[15]。中醫學認為,結直腸癌的發生多因憂思抑郁、氣滯血瘀、濕毒瘀滯凝結而成,然而病之根本乃正氣不足、氣血虧損,且隨著腫瘤的發展會加劇氣血耗損,故用藥當選固本培源、補益氣血之劑。十全大補湯以補氣之經典方四君子湯聯合補血之代表方四物湯,加黃芪甘溫補氣、肉桂大熱溫陽而成。諸藥相互配合,補氣與升陽并舉,養血不離溫通,共奏大補氣血、溫通升陽之功。本研究結果顯示,十全大補湯口服配合FOLFOX4方案化療對結直腸癌患者外周血清TGF-β1水平的降低程度大于單純化療者,且術后追蹤觀察1年發現該治療方法可降低結直腸癌術后復發率。與以往單純通過迅速殺滅、清除腫瘤細胞所采取的放療、化療等殺傷性很強的治療策略不同,十全大補湯能提高機體的免疫監控能力,減少腫瘤的免疫逃逸,多靶點、整體抑制腫瘤的浸潤與轉移,是治療結直腸癌的另一種提高療效的思路。
[1] Tian M, Neil JR, Schiemann WP, et al. Transforming growth factor-βand the hallmarks of cancer[J]. Cell Signal, 2011,23(6):951-962.
[2] Compton LA, Potash DA, Brown CB, et al. Coronary vessel development is dependent on the type III transforming growth factor beta receptor[J]. Circ Res, 2007,101(8):784-791.
[3] Eckert MA, Lwin TM, Chang AT, et al. Twist1- induced invadopodia formation promotes tumor metastasis[J]. Cancer Cell, 2011,19(3):372-386.
[4] 陳圣霖,陳念平.Bmi-1基因與惡性腫瘤相關性研究進展[J].中華實用診斷與治療雜志,2013,27(7):626-629.
[5] 羅亮,朱逸慜,曹宏,等.S100A4在腫瘤中研究進展[J].中華實用診斷與治療雜志,2013,27(6):530-532.
[6] 王永欣,周家德.細胞外基質降解相關因子與宮頸癌[J].安徽醫藥,2010,14(6):727-730.
[7] 李衛東,花寶金.腫瘤微環境中的炎性機制與腫瘤轉移[J].國際腫瘤學雜志,2011,38(12):911-913.
[8] Robson EJ, Khaled WT, Abell K, et al. Epithelial-to-mesenchymal transition confers resistance to apoptosis in three murine mammary epithelial cell lines [J]. Differentiation, 2006,74(5):254-264.
[9] Massague J. TGF beta in cancer[J]. Cell, 2008,134(2):215-230.
[10] Inman GJ. Switching TGF-β from a tumor suppressor to a tumor promoter[J]. Curr Opin Genet Deve, 2011,21(1):93-99.
[11] Liu Y, Zhou W, Zhong DW. Meta-analyses of the associations between four common TGF-β1genetic polymorphisms and risk of colorectal tumor[J]. Tumour Biology, 2012,33(4):1191-1199.
[12] Eckert MA, Lwin TM, Chang AT, et al. Twist1- induced invadopodia formation promotes tumor metastasis[J]. Cancer Cell, 2011,19(3):372-386.
[13] Beach JR, Hussey GS, Miller TE, et al. Myosin isoform switching mediates invasiveness after TGF-βinduced epithelial-mesenchymal transition[J]. Proc National Acad Sci USA, 2011,108(44):17991-17996.
[14] Hawinkels LJ, Verspaget HW, van der Reijden JJ, et al. Active TGF-beta1 correlates with myofibroblasts and malignancy in the colorectal adenoma-carcinoma sequence[J]. Cancer Sci, 2009,100(4):663-670.
[15] Ling S, Hu Z, Yang Z, et al. Extremely high genetic diversity in a single tumor points to prevalence of non-Darwinian cell evolution[J]. PNAS, 2015,112(47):6496-6505.
山東省自然科學基金資助項目(ZR2013HM43);山東省中醫藥科技發展計劃項目(2013ZDZK-029)。
白克運(E-mail: sdbky@126.com)
10.3969/j.issn.1002-266X.2017.10.013
R735.3
B
1002-266X(2017)10-0042-03
2016-10-23)

