半胱氨酸天冬氨酸蛋白酶3在亞洲帶絳蟲實驗感染乳豬肝組織的表達
許士剛,牟 榮,張 科,楊 林,郎書源,包懷恩
?
半胱氨酸天冬氨酸蛋白酶3在亞洲帶絳蟲實驗感染乳豬肝組織的表達
許士剛1,2,牟 榮1,2,張 科1,2,楊 林1,2,郎書源1,2,包懷恩1,2
目的 分析亞洲帶絳蟲實驗感染乳豬后囊尾蚴寄生處肝臟組織半胱氨酸天冬氨酸蛋白酶3(Cysteine aspartyl proteinase 3,Caspase-3)的表達變化情況,為探討Caspase-3在亞洲帶絳蟲感染致乳豬肝損傷中的作用提供基礎資料。方法 將采自貴州省都勻市良畝鄉的亞洲帶絳蟲孕節解剖后,以生理鹽水反復清洗并離心收集蟲卵。20 d齡約克施格雜交乳豬12 頭隨機分為實驗組和對照組各6 頭,實驗組以定量蟲卵15萬個/頭灌胃感染,于感染后第15 d 和第75 d 解剖乳豬,取實驗組囊尾蚴寄生處肝組織和對照組對應部位肝組織,運用實時熒光定量PCR和免疫印跡方法分別定性定量分析Caspase-3在實驗組和對照組中mRNA水平、蛋白水平的表達,并進一步運用免疫組織化學方法對Caspase-3在實驗組和對照組中的蛋白表達水平和蛋白表達部位進行分析和定位。結果 感染后第15 d,實時熒光定量PCR結果顯示實驗組Caspase-3 mRNA水平低于對照組(P=0.011),免疫印跡結果和免疫組化結果均顯示實驗組Caspase-3蛋白表達量低于對照組(P=0.008,P=0.004);此外,實驗組感染后第75 d的Caspase-3 mRNA水平、蛋白表達量均高于實驗組感染后第15 d 的樣本(P=0.018,P=0.003,P=0.002);免疫組織化學結果顯示Caspase-3陽性染色主要定位在肝細胞胞質中,呈黃色或棕黃色。感染后第75 d 實驗組和對照組各項結果差異均無統計學意義。結論 Caspase-3在亞洲帶絳蟲感染早期的乳豬肝組織中低表達,而感染晚期正常表達,提示Caspase-3可能參與了亞洲帶絳蟲致乳豬早期肝損傷的調節。
亞洲帶絳蟲;半胱氨酸天冬氨酸蛋白酶3;乳豬;肝臟
近40年來,我國臺灣學者范秉真[1]及國外學者Eom[2]、Zarlenga[3]、Bowles[4]及Ito[5]等發現并證實在亞太地區流行一種外形極似牛帶絳蟲的新蟲種,稱為亞洲帶絳蟲(Taeniaasiatica)。近年來,本課題組對采自中國大陸流行區的亞洲帶絳蟲進行了實驗動物感染等方面的研究[6-8],發現其實驗感染乳豬后可致乳豬肝損傷和肝細胞凋亡。正常的肝細胞凋亡在肝臟代謝中扮演重要角色,不受調控的持續性的病理性肝細胞凋亡在肝損傷的發生、發展中起了較為重要的作用[9]。半胱氨酸天冬氨酸蛋白酶(Caspase)家族是一類與細胞凋亡相關的蛋白酶家族,Caspase家族是細胞凋亡過程中的關鍵元件,其激活與超常表達均引起細胞凋亡,因此又稱死亡蛋白酶,可通過與眾多蛋白因子的相互作用調控細胞凋亡[10],其中Caspase-3是Caspase家族中最重要的凋亡執行者[11],是細胞凋亡過程中的主要效應因子,是多種凋亡刺激信號傳遞的匯聚點,負責對全部或部分關鍵性蛋白的酶切,使胞質、胞核及細胞骨架的重要蛋白酶失活,引發細胞凋亡。目前,國內外學者對寄生蟲感染宿主引起組織細胞Caspase-3表達變化進行了廣泛的研究,主要涉及衛氏并殖吸蟲[12]、豬帶絳蟲[13]、曼氏血吸蟲[14]、廣州管圓線蟲[15]、剛地弓形蟲[16]、細粒棘球絳蟲[17]和旋毛蟲[18]等,但尚無亞洲帶絳蟲感染對宿主組織細胞Caspase-3表達變化的研究。因此,本研究在已建立的亞洲帶絳蟲實驗感染乳豬動物模型基礎上,分別采用實時熒光定量PCR、免疫印跡和免疫組織化學方法檢測感染后第15 d和第75 d乳豬肝組織中Caspase-3的表達,為進一步深入研究亞洲帶絳蟲感染致乳豬肝損傷的分子病理機制提供基礎資料。
1 材料與方法
1.1 實驗材料
1.1.1 蟲體來源 蟲體采自貴州省都勻市良畝鄉絳蟲癥患者,經口服檳榔煎劑-生南瓜籽-硫酸鎂驅蟲,經形態學觀察和分子生物學鑒定,確定采集蟲體為亞洲帶絳蟲。
1.1.2 實驗動物 12頭20 日齡約克施格雜交乳豬購自貴州省龍里縣種豬養殖場,體重3.0~4.6 kg,體健,經糞檢和間接凝集實驗證實無寄生蟲感染。
1.1.3 主要試劑和儀器 主要試劑Trizol、熒光定量PCR試劑盒和cDNA合成試劑盒分別購自美國Sigma公司、日本Takara公司和北京康為世紀公司,PCR引物由上海生工生物工程有限公司合成,動物全蛋白提取試劑盒、BCA蛋白濃度測定試劑盒、聚偏二氟乙烯(polyvinylidene fluoride, PVDF)膜、3,3-二氨基聯苯胺(Diaminobenzidine, DAB)顯色試劑盒、BCA蛋白濃度定量試劑盒均購自美國Life Sciences公司,Caspase-3(SC-98785,兔抗豬)、β-actin(SC-47778,鼠抗豬)、IgG-HRP(SC-2005,羊抗鼠)和IgG-HRP(SC-2004,羊抗兔)均購自美國Santa-Cruz公司。主要儀器實時熒光定量PCR儀、凝膠成像系統均為美國Bio-Rad公司產品, 型號分別為CFX-96和ChemiDoc TMXRS+,Nikon科研級成像系統為日本Nikon公司產品,型號為Nikon DS-RI2。
1.2 方法
1.2.1 蟲卵收集和計數 取每條亞洲帶絳蟲的末段孕節,在生理鹽水中以注射器針頭沿縱軸劃破孕節使蟲卵溢出,并用生理鹽水反復淘洗,2 000 r/min,離心20 min,收集蟲卵備用。光學顯微鏡下觀察收集的蟲卵并分別反復計數5 次,取平均值,將1 mL生理鹽水中蟲卵數定量為15萬個,4 ℃冰箱保存備用。
1.2.2 實驗動物感染和標本采集 乳豬隨機分為實驗組和對照組各6頭,實驗組乳豬以定量蟲卵15萬個/頭通過胃管灌胃感染。感染之初2組乳豬分開飼養,7 d后混養,整個實驗過程中嚴格實行封閉飼養。于感染后第15 d和第75 d分別隨機處死實驗組和對照組乳豬各3 頭,采集實驗組和對照組肝組織。將剝除囊尾蚴的實驗組肝組織和對照組肝組織放入有或無1 mL Trizol的EP管內再置于-80 ℃冰箱保存備用,并將未剝除囊尾蚴的實驗組和對照組肝組織置于4%多聚甲醛固定后室溫保存備用。
1.2.3 實時熒光定量PCR 根據GenBank相關序列,使用Primer Express 5.0軟件設計Caspase-3和內參基因(β-actin)實時熒光定量PCR引物,并由上海生工生物公司合成(表1)。采用Trizol一步法提取各組乳豬肝組織總RNA,按試劑盒說明操作獲得cDNA。PCR反應條件:95 ℃預變性30 s,95 ℃變性5 s,59.4 ℃退火30 s,72 ℃延伸30 s,共40 個循環。記錄熒光定量PCR儀得出的各組Caspase-3和內參基因β-actin的CT值,重復3 次取平均值。計算目的基因Caspase-3的△△CT值,△△CT=(CT目的基因-CTβ-actin)-(CT對照組-CTβ-actin),采用2-△△CT法計算出各組目的基因的相對表達量。
表1 實時熒光定量PCR引物
Tab.1 Primers of quantitative real-time PCR
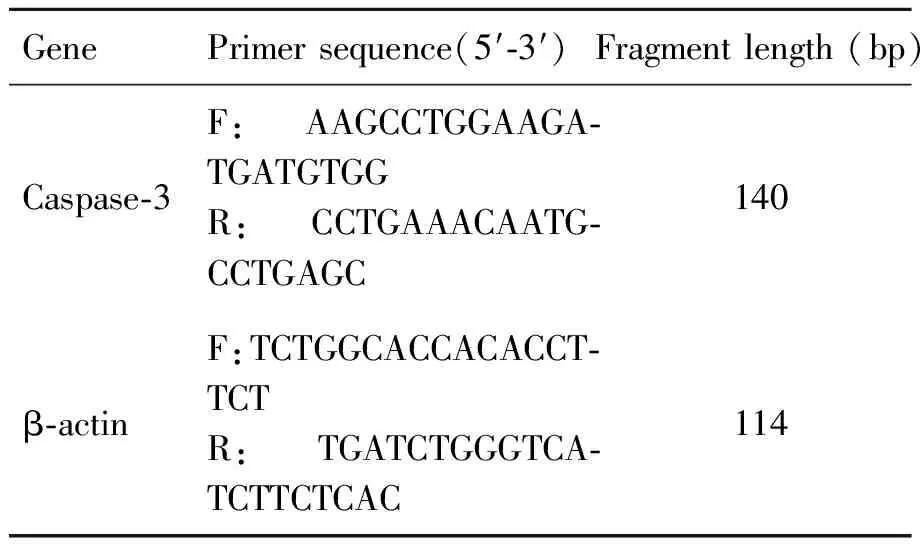
GenePrimersequence(5′?3′)Fragmentlength(bp)Caspase?3F:AAGCCTGGAAGA?TGATGTGGR:CCTGAAACAATG?CCTGAGC140β?actinF:TCTGGCACCACACCT?TCTR:TGATCTGGGTCA?TCTTCTCAC114
1.2.4 免疫印跡法 取-80 ℃冰箱保存的肝臟組織約90 mg,用動物蛋白提取試劑盒提取總蛋白,并用BCA蛋白濃度測定試劑盒測定蛋白濃度,各組樣品等量上樣,經SDS-PAGE電泳分離(積成膠電壓40 V, 分離膠電壓100 V)后將蛋白轉移至PVDF膜并封閉過夜,室溫下分別加入一抗Caspase-3(1∶200)和內參β-actin(1∶500),孵育2 h 后加入辣根過氧化物酶標記的二抗(1∶8 000)作用1 h,凝膠成像系統曝光,用IMAGEL3.0軟件(Bio-Rad公司)測定各條帶的光密度值,經內參β-actin校正后,取Caspase-3/β-Actin比值為蛋白的表達量。
1.2.5 免疫組織化學法 將保存于4%多聚甲醛中的肝組織進行石蠟包埋、切片、脫蠟、脫水、過氧化氫阻斷內源性過氧化物酶、蛋白酶K修復,然后加入一抗Caspase-3(1∶100) 4 ℃孵育過夜,辣根過氧化物酶標記的二抗(1∶500)37 ℃孵育30 min、DAB顯色60 s、蘇木素復染30 s、脫色30 s、中性樹膠封片后顯微鏡下觀察,PBS代替一抗作為陰性對照。結果判定:顯微鏡下觀察,Caspase-3陽性染色主要定位在肝細胞胞質中,呈黃色至棕黃色。感染后第15 d和75 d實驗組和對照組各取10個樣本,每個樣本取10個視野,觀察免疫組化陽性物的分布,使用Image Pro plus 6.0軟件測定每個樣品平均光密度值,即每個視野陽性物光密度值和陽性物區域面積的比值,平均光密度值和蛋白表達量呈正相關。
2 結 果
2.1 亞洲帶絳蟲蟲卵感染情況 亞洲帶絳蟲蟲卵能感染約克施格雜交乳豬,感染后第15 d,實驗組肝臟可見白色細小點狀結構,未見清晰囊尾蚴結構,見圖1A;感染后第75 d,實驗組大多數囊尾蚴鈣化,見圖1B。
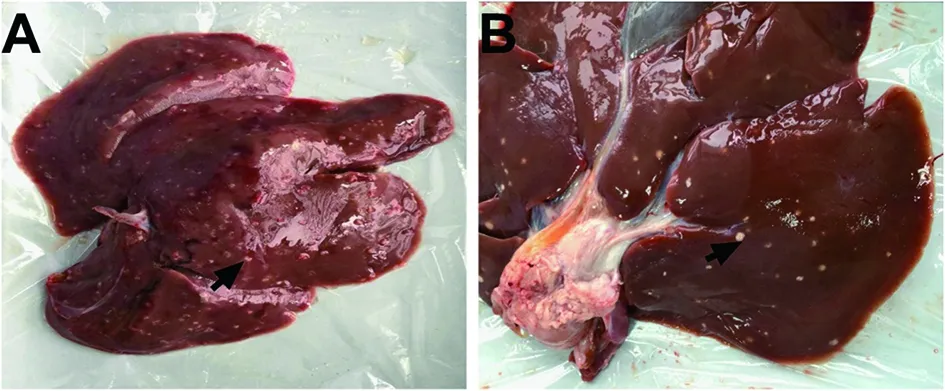
A:亞洲帶絳蟲囊尾蚴感染后第15 d乳豬肝臟,↑示未成熟的囊尾蚴;B:亞洲帶絳蟲囊尾蚴感染后第75 d的乳豬肝臟,↑示鈣化的囊尾蚴。A:Liver of porket at day 15 post-infection after oral challenge by T. asiatica,↑ indicated immature cysticercus; B:Liver of porket at day 75 post-infection after oral challenge by T. asiatica,↑ indicated calcified cysticercus.圖1 亞洲帶絳蟲囊尾蚴感染不同時間的約克施格雜交乳豬肝臟Fig.1 Liver of Yorkshire and Seghers hybrid porkets at day 15 and day 75 post-infection after oral challenge by T. asiatica
2.2 實時熒光定量PCR結果 感染后第15 d,實驗組Caspase-3 mRNA水平低于對照組,而實驗組感染后第75 d的Caspase-3 mRNA水平高于感染后第15 d,差異均有統計學意義(P=0.011,P=0.018);感染后第75 d,實驗組Caspase-3 mRNA水平相對正常組無明顯變化,差異無統計學意義(P=0.221),見圖2。
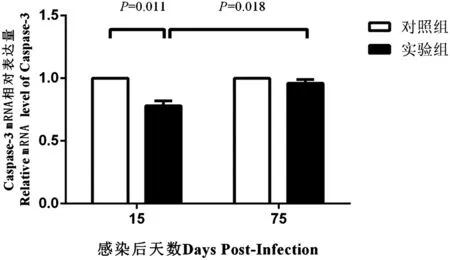
圖2 實時熒光定量PCR檢測亞洲帶絳蟲感染后第15 d和第75 d乳豬肝組織Caspase-3的mRNA水平Fig.2 mRNA level of Caspase-3 of liver tissues from porkets of experimental and control groups by quantitative real time PCR at day 15 and day 75 post-infection after oral challenge by T. asiatica
2.3 免疫印跡法檢測肝組織Caspase-3蛋白表達結果 免疫印跡實驗結果表明對照組和實驗組內參β-actin表達量一致(見圖3A),即該實驗各組蛋白上樣量一致,在此基礎上,感染后第15 d實驗組Caspase-3表達量低于對照組,而感染后第75 d實驗組Caspase-3表達量高于感染后第15 d實驗組Caspase-3表達量;感染后第75 d,實驗組Caspase-3的亮度和對照組基本一致(見圖3A)。經IMAGEL3.0及SPSS19.0軟件統計處理及內參β-actin校正后,如圖3B所示,感染后第15 d,實驗組Caspase-3蛋白表達量低于對照組,而感染后75 d,Caspase-3蛋白表達量高于感染后第15 d,差異均有統計學意義(P=0.008,P=0.003),感染后第75 d,實驗組與對照組Caspase-3蛋白表達無明顯差異 (P=0.599)。
2.4 免疫組織化學法檢測肝組織Caspase-3蛋白表達結果 顯微鏡下觀察肝組織切片免疫組化結果顯示實驗組和對照組均可見肝細胞胞質被染成黃色至棕黃色(圖4A—D)。感染后第15 d,實驗組肝組織Caspase-3平均光密度值低于對照組,而感染后第75 d,實驗組肝組織Caspase-3平均光密度值高于感染后第15 d,差異均有統計學意義(P=0.004,P=0.002),感染后第75 d,實驗組肝組織Caspase-3平均光密度值較對照組無明顯變化,差異無統計學意義(P=0.531,P=0.231)(見圖5)。
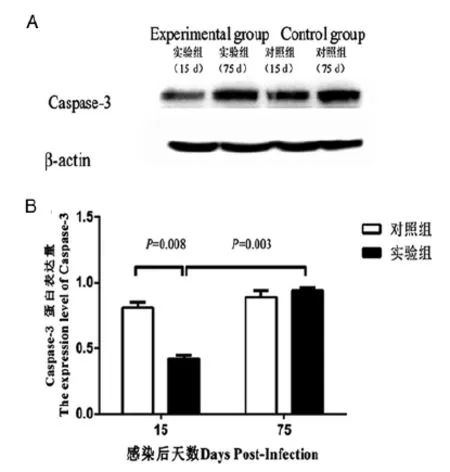
A:免疫印跡法檢測感染后第15 d和第75 d乳豬肝組織Caspase-3蛋白表達結果;B:感染后第15 d和第75 d乳豬肝組織Caspase-3蛋白表達量的統計圖。A:The result of western blot for Caspase-3 and β-actin of experimental and control groups at indicated time points; B:The histogram for the expression level of Caspase-3 of experimental and control groups at indicated time points.圖3 免疫印跡法檢測亞洲帶絳蟲感染后第15 d和第75 d乳豬肝組織Caspase-3蛋白的表達Fig.3 Expression level of Caspase-3 from liver tissue of porkets by western blot assay at day 15 and day 75 post-infection after oral challenge by T. asiatica
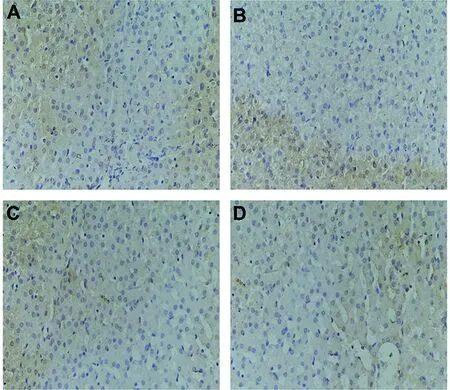
A: 感染后第15 d對照組乳豬肝組織Caspase-3蛋白免疫組化結果;B:感染后第15 d實驗組乳豬肝組織Caspase-3免疫組化結果;C: 感染后第75 d對照組乳豬肝組織Caspase-3蛋白免疫組化結果;D:感染后第75 d實驗組乳豬肝組織Caspase-3免疫組化結果。(A-D放大倍數=400倍)A:The representative section of liver tissue from control group porkets at day 15 post-inoculated by immunohistochemistry; B:The representative section of liver tissue from experimental group porkets at day 15 post-infection by immunohistochemistry; C:The representative section of liver tissue from control group porkets at day 75 post-inoculated by immunohistochemistry; D:The representative section of liver tissue from experimental group porkets at day 75 post-infection by immunohistochemistry.(A-D:Original magnification 400×)圖4 免疫組織化學法檢測亞洲帶絳蟲感染后第15 d和第75 d乳豬肝組織Caspase-3蛋白表達Fig.4 Expression of Caspase-3 of liver tissue from T. asiatica oral challenged porkets by immunohistochemistry assay at day 15 and day 75 post-infection
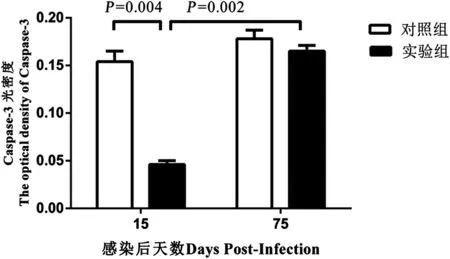
圖5 感染后第15 d和第75 d乳豬肝組織Caspase-3平均光密度值Fig.5 Average optical density of Caspase-3 in liver tissues of porkets from experimental and control groups at day 15 and day 75 post-infection
3 討 論
1972年Kerr[19]首次提出了細胞凋亡概念,細胞凋亡也稱程序性細胞死亡(programmed cell death,PCD),是一個生理性的細胞自我毀滅的過程,也是機體清除感染、變異及衰老細胞而維持自身生理狀態的主要調節方式之一。有研究表明[20],凋亡主要由以下幾個步驟完成:接受凋亡信號后啟動細胞凋亡程序;促凋亡蛋白的激活;引發Caspase級聯反應裂解靶蛋白;細胞器的降解;細胞凋亡小體的破碎。細胞凋亡主要由凋亡受體途徑、線粒體途徑、內質網途徑、細胞核凋亡途徑、高爾基體和溶酶體凋亡途徑以及凋亡基因控制,各途徑互相聯系,共同調節細胞凋亡,其中Caspase在細胞凋亡的各個途徑中發揮重要的作用。Caspase家族是哺乳動物細胞中程序性死亡的介導者和執行者,目前,已經發現Caspase包括Caspase1~13,它們可分別在炎癥和細胞凋亡中起到不同的作用。目前認為[11]Caspase-3處于細胞凋亡的執行者中的核心地位,Caspase-3是Caspase家族中最重要的凋亡執行者。
肝細胞的凋亡具有兩面性,一方面肝細胞凋亡是機體對抗感染、腫瘤及防止自身免疫反應的自衛措施,另一方面大量的肝細胞凋亡常伴有肝細胞壞死,可引起肝臟結構和功能的損傷。本課題組既往研究發現亞洲帶絳蟲感染乳豬后不同時期可引起家豬肝臟的急性、慢性炎癥反應和纖維化等病理性損傷,并且感染中期和晚期均存在肝細胞凋亡[8,21]。呂鵬[22]等研究發現雖然肝細胞凋亡與肝細胞壞死貫穿于肝纖維化的整個病變過程,但二者在肝纖維化的不同時期所處的主導地位不同。本研究結果顯示感染后第15 d實驗組Caspase-3 mRNA水平和Caspase-3蛋白的表達量均低于對照組,但感染后第75 d實驗組較正常對照組無明顯變化,但實驗組感染后第75 d的Caspase-3 mRNA水平和蛋白表達量均高于實驗組感染后第15 d的樣本。結合既往研究結果,說明Caspase-3可能參與了亞洲帶絳蟲感染致乳豬早期肝損傷的調節。研究已發現感染早期乳豬肝細胞有點片狀壞死而無明顯凋亡,可能因早期入侵的亞洲帶絳蟲幼蟲主要導致乳豬肝細胞壞死,抑制了肝細胞的凋亡,這與本實驗發現感染早期Caspase-3在實驗組乳豬肝組織中低表達的結果正好吻合,據此推測早期入侵的亞洲帶絳蟲幼蟲可能對肝細胞凋亡相關Caspase-3的表達有抑制作用。此外,本實驗結果表明亞洲帶絳蟲感染晚期乳豬肝細胞凋亡與Caspase-3無關,可能有其它的凋亡蛋白以及凋亡途徑發揮作用,有待進一步研究。
目前有學者研究發現Caspase-3的表達量與寄生蟲感染致宿主組織細胞凋亡的程度呈正相關。李江輝[15]等發現廣州管圓線蟲幼蟲致小鼠腦組織細胞凋亡程度和Caspase-3的表達量呈正相關。周永華[16]等發現慢性剛地弓形蟲感染致大鼠海馬神經細胞凋亡的程度和Caspase-3的表達量呈正相關。Chen[14]等發現感染血吸蟲的小鼠通過降低Caspase-3的表達抑制肝細胞凋亡,從而起到保護肝臟的作用。此外,有學者發現肝臟疾病中Caspase-3的低表達與細胞凋亡的抑制有關。金雷[23]等發現原發性肝細胞癌患者的肝組織中Caspase-3的低表達可能與肝癌細胞的凋亡障礙有關。黃慧[24]等在內毒素對肝細胞凋亡變化的研究中發現通過下調Caspase-3在肝臟的表達能抑制肝細胞凋亡,從而發揮保護肝臟的作用。結合本研究結果,我們推測:亞洲帶絳蟲感染致乳豬早期肝損傷的過程中通過Caspase-3的低表達,抑制肝細胞凋亡,可能對肝臟有保護作用。亞洲帶絳蟲幼蟲致中間宿主乳豬肝細胞凋亡的分子機制是一個復雜的過程,Caspase-3是通過哪些信號通路及凋亡途徑來調節肝細胞的凋亡尚有待進一步研究。還有學者研究發現寄生蟲感染可通過Caspase-3介導宿主炎性細胞凋亡而發揮免疫逃避作用。Ernatus[13]等用免疫組織化學方法研究含有囊尾蚴的豬腦組織中Caspase-3的表達,發現Caspase-3可能通過以介導炎癥細胞凋亡方式而在囊尾蚴對宿主的免疫逃避中發揮作用。Min[12]等研究表明在衛氏并殖吸蟲感染人體的過程中,通過Caspase-3介導嗜酸性粒細胞凋亡,從而逃避宿主的免疫反應。楊宏強[17]等在棘球蚴感染小鼠過程中,Caspase-3誘導宿主單核細胞發生凋亡,從而逃避宿主的免疫反應。亞洲帶絳蟲感染乳豬的過程中,是否通過Caspase-3介導乳豬炎性細胞凋亡而使幼蟲逃避宿主的免疫反應值得進一步深入研究。
[1] Fan PC. TaiwanTaeniaand taeniasis[J]. Parasitol Today, 1988, 4(3):86-88. DOI:10.1016/0169-4758(88)90204-9
[2] Eom KS, Rim HJ. Morphological descriptions ofTaeniaasiaticasp.n[J]. Korean J Parasitol, 1993, 31(1):1-6. DOI:10.3347/kjp.1993.31.1.1
[3] Zarlenga DS, McManus DP, Cross JH, et al. Characterization and detection of a newly described Asian Taeniid using cloned ribosomal DNA fragments and sequence amplification by polymerase chain reaction[J]. Exper Parasitol, 1991, 72(2):174-183. DOI:10.1016/0014-4894(91)90135-J
[4] Bowles J, McManus DP. Genetic characterization of theAsianTaenia, a newly described taeniid cestode of humans[J]. Am J Trop Med Hyg, 1994, 50(1):33-44.
[5] Ito A, Wandra T, Yamasaki H, et al. Cysticercosis/Taeniasis in Asia and the Pacific[J]. Vectorborne Zoonotic Dis, 2004, 4(2):95-107. DOI:10.1089/1530366041210756
[6] Bao HE, Mou R. Research progress on molecular identification and biologic behavior ofTaeniasaginatain Western China[J]. Chin J Parasitol Parasit Dis, 2009, 27(6):520-526. (in Chinese)
包懷恩,牟榮.中國西部地區牛帶絳蟲的分子鑒定和生物行為研究進展[J].中國寄生蟲學與寄生蟲病雜志, 2009, 27(6):520-526.
[7] Linghu Y, Zhu WJ, Bao HE, et al. Observations on pathological and histochemical changes in piglet livers infected withTaeniasaginataasiatica[J]. Front Med China, 2007, 1(3):258-263. DOI:10.1007/s11684-007-0049-8
[8] Mou R, Bao HE, Zhang K, et al. Study on hepatocyte apoptosis of domestic pigs experimentally infected withTaeniaasiaticaandTaeniasaginata[J]. Chin J Parasitol Parasit Dis, 2012, 30(5):367-371. DOI:1000-7423(2012)-05-0367-06 (in Chinese)
牟榮,包懷恩,張科,等.亞洲帶絳蟲和牛帶絳蟲實驗感染乳豬后肝臟細胞凋亡的研究[J].中國寄生蟲學與寄生蟲病雜志,2012,30(5):367-371.
[9] Patel T, Gores GJ. Apoptosis and hepatobiliary disease[J]. Hepatology, 1995, 21(6):1725-1741. DOI:10.1016/0270-9139(95)90481-6
[10] Zhang Y, Goodyer C, LeBlanc A. Selective and protracted apoptosis in human primary nenlons microinjection with active caspase-3, -6, -7and-8[J]. J Neurosc, 2000, 20(22):8384-8389.
[11] Sun BH, Zhang J, Wang BJ, et al. Analysis ofinvivopatterns of caspase-3 gene expression in primary hepatocellular carcinoma and its relationship to P21 (WAF1) expression and hepatic apoptosis[J]. World J Gastroenterol, 2000, 6(3):356-360.
[12] Min DY, Lee YA, Ryu JS, et al. Caspase-3-mediated apoptosis of human eosinophils by the tissue-invading helminthParagonimuswestermani[J]. Intl Arch Allergy Immunol, 2004, 133(4):357-364. DOI:10.1159/000077355
[13] Mkupasi EM, Sikasunge CS, Ngowi HA, et al. Detection of cysteine protease inTaeniasolium-induced brain granulomas in naturally infected pigs[J]. Vet Parasitol, 2013, 197(1/2):360-363. DOI:10.1016/j.vetpar.2013.05.004
[14] Chen TT, Wu LS, PW Hsu, et al. Mitochondrial dynamics in the mouse liver infected bySchistosmamansoni[J]. Acta Trop, 2015, 148:13-23. DOI:10.1016/j.actatropica.2015.04.004
[15] Li JH, Tan F, Hu X, et al. Observation on cell apoptosis in mouse brain tissues induced by larvae ofAngiostrongyluscantonensis[J]. Chin J Zoonoses, 2008, 24(10):913-915. DOI:1002-2694(2008)10-0913-03 (in Chinese)
李江輝,譚峰,胡昕,等.廣州管圓線蟲幼蟲致小鼠腦組織細胞凋亡研究[J].中國人獸共患病學報,2008,24(10):913-915.
[16] Zhou YH, Fan HJ, Xu YL, et al. Changes of apoptosis and its related protein expressions of hippocampal neurons in rats withToxoplasmagondiichronic infection[J]. Chin J Schisto Control, 2010, 22(3):264-267. DOI:10.16250/j.32.1374.2010.03.017 (in Chinese)
周永華,范紅結,許永良,等.慢性弓形蟲感染對大鼠海馬神經細胞凋亡周期及Caspase-3與細胞色素C蛋白表達的影響[J].中國血吸蟲病防治雜志, 2010, 22(3):264-267.
[17] Yang HQ, Ma SB, Bian ZY, et al. Expression of tumor necrosis factor-α and Caspase-3 protein in monocytes adjacent to the invadedEchinococcusmultilocularisin liver[J]. Chin J Parasitol Parasit Dis, 2012, 30(3):201-205. DOI:1000-7423(2012)-03-0201-05 (in Chinese)
楊宏強,馬少波,卞志遠,等.腫瘤壞死因子-α和半胱氨酸天冬氨酸蛋白酶3在肝泡型棘球蚴周圍單核細胞中的表達[J].中國寄生蟲學與寄生蟲病雜志, 2012,30(3):201-205.
[18] Li D, Chang HM, Zhao L, et al. Study on Caspase-3 protein expression in small intestine and muscle tissue oftrichinellaspiralismice[J]. J Chengde Med College, 2013, 30(1):7-9. DOI:10.15921/j.cnki.cyxb.2013.01.015 (in Chinese)
李丹,常紅敏,趙蕾,等.旋毛蟲小鼠小腸和肌肉組織Caspase-3蛋白表達的研究[J]. 承德醫學院學報, 2013, 30(1):7-9.
[19] Kerr JF, Willie AH, Currie AR. Apoptosis:A basic biological phenomenon with-ranging implications in tissue kinetics[J]. British J Cancer, 1972, 26(4):239-241. DOI:10.1038/bjc.1972.33
[20] Savitskaya MA, Onishchenko GE. Mechanisms of apoptosis[J]. Biochem (Mosc), 2015, 80(11):1393-1405. DOI:10.1134/S0006297915110012
[21] Wang M, Rong JQ, Mo XZ, et al. Pathological examination on hepatic fibrosisin porkets experimentally infected withTaeniasaginataasiatica[J]. Chin J Zoonoses, 2008, 24(04):331-333. DOI:1002-2694(2008)04-0331-03 (in Chinese)
汪敏, 戎聚全, 莫興澤, 等. 亞洲帶絳蟲致乳豬肝纖維化實驗觀察[J]. 中國人獸共患病學報, 2008, 24(4):331-333.
[22] LYU P, Luo HS, Yu BP. Dynamic analysis of hepatocellular apoptosis and necrosisin liver fibrosis model of rat[J]. Chin J Gastroenterol Hepatol, 2002, 11(3):213-216. (in Chinese)
呂鵬, 羅和生, 余保平. 大鼠肝纖維化模型肝細胞凋亡及肝細胞壞死的動態分析[J]. 胃腸病學和肝病學雜志, 2002, 11(3):213-216.
[23] Jin L, Zhu F, Qin XH, et al. Expression of Caspase-3 mRNA in hepatocellular carcinoma and its clinical signification[J]. J Hepatopancreatobiliary Surg, 2012, 24(4):290-291. (in Chinese)
金雷, 朱峰, 秦錫虎, 等. Caspase-3 mRNA在原發性肝癌中的表達及其臨床意義[J]. 肝膽胰外科雜志, 2012, 24(4):290-291.
[24] Huang H, Qu CL, Gao H, et al. Effect of endotoxin on expressions of Caspase-3and protection effect of cation A in liver[J]. Southwest China J Agr Sci, 2013, 26(3):1269-1272. DOI:1001-4829(2013) 03-1269-04 (in Chinese)
黃慧,屈常林,高洪,等.內毒素對肝臟Caspase-3蛋白表達的影響及陽離子A的保護效應[J].西南農業學報,2013,26(3):1269-1272.
Mou Rong, Email:mourong@gmc.edu.cn
Expression of cysteine aspartyl proteinase 3 from liver tissues of the porkets experimentally infected byTaeniaasiatica
XU Shi-gang1,2, MOU Rong1,2, ZHANG Ke1,2, YANG Lin1,2, LANG Shu-yuan1,2, BAO Huai-en1,2
(1.DepartmentofParasitology,GuizhouMedicalUniversity,Guiyang550025,China; 2.LaboratoryofPathogenBiology,GuizhouMedicalUniversity,Guiyang550025,China)
In order to provide substantial scientific information for exploring the mechanism of porcine liver injury caused byTaeniaasiatica(T.asiatica), the expression of Cysteine aspartyl proteinase 3 (Caspase-3) from liver tissues of porkets that were experimentally infected byT.asiaticawas examined. TheT.asiaticaadults were collected from the taeniasis patients in Duyun, Guizhou Province and identified biologically. The eggs were harvested from gravid proglottids and prepared by repeated washing and centrifugation. Twelve 20-days old Yorkshire and Seghers hybrid porkets were randomly divided into experimental and control groups as six pigs per group. The experimental group was orally administrated with 1.5×106eggs per porket at day 0 post-infection. The porkets of both groups were sacrificed on the day 15 and day 75 post-infection (three pigs per time point) respectively, and liver samples were collected for further experiments. Quantitative real-time polymerase chain reaction method was employed to detect the mRNA levels of Caspase-3, and western blotting and immunohistochemistry methods were performed to detect the level of Caspase-3 expression in both groups. At the day 15 post-infection, the mRNA level and expression level of Caspase-3 of the experimental group were significantly decreased, comparison with the control group (P=0.011,P=0.008 andP=0.004 respectively). It was positive with Caspase-3 when yellow or brown signal appeared in the cytoplasm of liver cells by immunohistochemistry. However, at the day 75 post-infection, the mRNA level and expression level of Caspase-3 of the experimental group were dramatically similar to the control group. Furthermore, in the experimental group, the mRNA level and expression level of Caspase-3 were significantly increased at day 75 post-infection than day 15 post-infection (P=0.018,P=0.003 andP=0.002 respectively). These results suggested that Caspase-3 might be involved into the regulation of the damage of porcine liver induced byT.asiaticachallenge at the early infection stage and have on effect to the hepatic injury because of the dramatic recovery of Caspase-3 at the consequent infection stage.
Taeniaasiatica; cysteine aspartyl proteinase 3; porket; liver
10.3969/j.issn.1002-2694.2017.04.007
國家自然科學基金項目(No.81160205)、貴州省優秀科技教育人才省長資金項目(黔省專合字[2008]55號)和貴州省留學人員科技創新項目(黔人項目資助合同[2015]1號)聯合資助
牟 榮,Email:mourong@gmc.edu.cn
1.貴州醫科大學寄生蟲學教研室,貴陽 550025; 2.貴州醫科大學病原生物學實驗室,貴陽 550025
Supported by the National Natural Science Foundation of China (No. 81160205), the Specific Fund of Provincial Government in Guizhou Province (No.[2008]55), and the Science and Innovation Foundation of Guizhou Province for Returned Chinese Scholars (No. [2015]1)
R383.3
A
1002-2694(2017)04-0326-06
2016-11-14 編輯:劉岱偉

