高孕激素下促排卵方案用于FSH升高DOR患者的臨床效果觀察
沈秀,李頌軍,周睿瓊,楊彩簾,張紅,鄧偉芬
(深圳武警醫院生殖中心,深圳 518023)
高孕激素下促排卵方案用于FSH升高DOR患者的臨床效果觀察
沈秀,李頌軍*,周睿瓊,楊彩簾,張紅,鄧偉芬
(深圳武警醫院生殖中心,深圳 518023)
目的 探討高孕激素下促排卵(PPOS)方案應用于FSH升高的卵巢儲備功能減退(DOR)患者的臨床結局,旨在探索DOR患者最優的控制性促排卵(COH)方案。 方法 回顧性分析2015年1月至2016年1月在我中心診斷為DOR行IVF/ICSI-ET助孕的患者的臨床資料,共264個周期。根據促排卵方案的不同對研究對象進行分組,采用PPOS方案的117個周期為PPOS組,采用克羅米芬(CC)微刺激方案的147個周期為CC組。比較兩組的Gn用量、平均Gn天數、促排過程中血清激素水平的變化、獲卵數、優胚率、頂級優胚率、臨床妊娠率等。 結果 PPOS組患者促排過程中LH最高值[(3.92±0.23) vs. (8.56±0.45) U/L]、HCG日E2水平[(4 703.76±3 149.46) vs. (7 021.02±4 249.32) pmol/L]、HCG日LH水平[(2.52±1.74) vs. (7.49±6.41) U/L]均顯著低于CC組(P<0.05);PPOS組的Gn用量及用藥天數顯著高于CC組(P<0.05);PPOS組的優胚率(82.63% vs. 69.51%)及頂級優胚率(28.39% vs. 20.98%)顯著高于CC組(P<0.05);兩組HCG日直徑>14 mm的卵泡數、獲卵數、成熟卵母細胞數、正常受精數、卵裂數、可利用胚胎數等比較均無顯著性差異(P>0.05),兩組的FET臨床妊娠率比較無顯著性差異(P>0.05)。 結論 對于FSH升高的DOR患者,行PPOS方案促排卵能有效抑制早發LH峰,但臨床妊娠率與CC微刺激方案比較無顯著性差異。
高孕激素下促排卵; 克羅米芬微刺激; 卵巢儲備功能減退
(JReprodMed2017,26(4):351-356)
隨著人們生活習慣及社會環境的變化,不孕人群的比例逐年增加,尤其是卵巢儲備功能減退(DOR)女性所占的比例越來越高;二胎政策全面放開以后,將有更多的高齡女性選擇再生育,因而高齡不孕女性的數量也將明顯增加。2015年美國婦產科醫學協會(ACOG)新定義的“卵巢儲備檢測”臨床實踐指南[1]中提出,有生育要求、年齡>35歲,半年內未孕的女性,是DOR的高危人群,有必要積極采取干預措施,而輔助助孕是有效的干預措施之一。在輔助助孕治療的患者中,DOR是一類特殊的人群,其特點表現為竇卵泡數(AFC)急劇減少、基礎FSH升高、卵母細胞數量和質量下降。國外有學者報道,基礎FSH升高(>10 U/L)的婦女IVF周期取消率顯著增加,獲卵率、妊娠率明顯下降,在常規控制性促排卵(COH)方案中,往往用藥劑量大、時間長,且易出現卵巢低反應及周期取消[2]。目前臨床上雖然有許多COH方案,但仍有一部分患者表現為低反應,難以獲得優質的卵母細胞和胚胎,且DOR患者更容易因早發LH峰導致卵泡提前排出。GnRH激動劑雖可以有效抑制早發LH峰,但對于DOR患者容易因卵巢低反應而取消周期;克羅米芬(CC)微刺激方案與拮抗劑方案雖然也可以抑制LH峰,但有抑制失敗的情況發生,如何為該類患者選擇合適、有效的COH方案,提高DOR女性的助孕成功率是生殖醫生需要思考的問題。
近年來有研究認為,高孕激素下促排卵(PPOS)方案亦能有效抑制早發LH峰,與傳統方案及CC微刺激方案相比,其用藥簡單,抑制早發LH峰效果更好,且在FSH升高(>10 U/L)時,仍能獲得較好的臨床結局[3]。葉靜等[4]亦在研究中發現,與短方案相比,PPOS方案促排后無1例發生自發性排卵,且促排卵過程中LH的水平呈逐漸下降的趨勢。本研究回顧性分析PPOS方案與CC微刺激方案在COH過程中抑制早發LH峰的效果及臨床結局,旨在探索DOR患者最優的COH方案。
資料與方法
一、研究對象及分組
回顧性分析2015年1月至2016年1月在我中心診斷為DOR行IVF/ICSI-ET助孕的患者的臨床資料,共264個周期。納入標準即DOR的診斷標準:(1)基礎FSH≥8.5 U/L或FSH/LH>3.6;(2)年齡≥35歲;(3)自然周期陰道B超提示雙側卵巢AFC≤5個,以上3項符合兩項即可[5]。排除標準:(1)合并存在其他內、外科基礎疾病且不能耐受妊娠者;(2)重度宮腔粘連及子宮內膜異位癥者;(3)復發性流產及反復種植失敗者;(4)男方梗阻性無精子癥或極重度少、弱、畸精子癥。
根據促排卵方案的不同對研究對象進行分組,采用PPOS方案的117個周期為PPOS組,采用CC微刺激方案的147個周期為CC組。
二、研究方法
1. 促排卵方案:PPOS方案:于月經周期第3天檢測血清FSH、E2水平,如FSH>12 U/L,給予媽富隆(去氧孕烯炔雌醇片,歐加農,荷蘭)1片/d預處理,口服5 d后,復查FSH水平,當FSH降至8 U/L以下,停用媽富隆,給予口服醋酸甲羥孕酮(安宮黃體酮,MPA,浙江仙琚制藥,2 mg/片)10 mg/d至HCG日,同時肌注尿促卵泡素(麗申寶,珠海麗珠制藥,75 U/支)150~225 U/d,促排5 d后B超監測卵泡發育情況,同時監測血清LH、E2、孕酮(P)水平,并根據卵泡發育情況調整用藥,當至少有1個卵泡直徑達18 mm以上時,給予重組人絨毛膜促性腺激素(rHCG,艾澤,默克雪蘭諾,德國,250 μg/支)250 μg扳機,36 h后取卵。
CC微刺激方案:月經周期第3天開始口服CC(枸櫞酸氯米芬片,吉林通化長青藥業,50 mg/片)50 mg/d,同時肌肉注射尿促卵泡素150~225 U/d,促排5 d后B超監測卵泡發育情況,同時監測血清LH、E2、P水平,如血清LH水平超過基礎LH水平兩倍以上,則皮下注射GnRH拮抗劑(思則凱,默克雪蘭諾,德國,0.25 mg/支)0.125~0.250 mg/d至HCG日,當至少有1個卵泡直徑達18 mm以上時,予rHCG 250 μg扳機,36 h后取卵。
2. 取卵及IVF/ICSI:在陰道超聲引導下取卵,依次抽取所有直徑>14 mm的卵泡,取卵后根據精子質量及既往受精情況選擇受精方式,采用IVF或ICSI受精。
根據卵裂球的大小、形態、數目、胞質情況、碎片的比例進行胚胎質量的評分[6],共分為4級:Ⅰ級:胚胎卵裂球大小均勻,形態規則且胞質清晰,碎片<10%;Ⅱ級:胚胎卵裂球大小不等,且形態欠規則,碎片比例10~25%;Ⅲ級:胚胎卵裂球大小不均勻,碎片比例26~50%;Ⅳ級:胚胎卵裂球大小嚴重不均勻,碎片>50%。可利用胚胎指4細胞Ⅰ~Ⅱ胚胎及4細胞以上Ⅰ~Ⅲ胚胎;優質胚胎指6細胞Ⅱ級以上至9細胞Ⅰ級的胚胎;頂級優胚指第2天(D2)評分為4細胞Ⅰ級,D3評分為7~8細胞Ⅰ級的胚胎[7]。
3. 胚胎移植:CC微刺激方案僅部分患者進行了鮮胚移植,年齡<35歲患者初次移植2枚胚胎,年齡≥35歲患者移植2~3枚胚胎,取卵日開始給予黃體支持。PPOS方案則行全胚冷凍。
凍融胚胎移植(FET)的內膜準備方式和黃體支持:采用自然周期、來曲唑(LE,江蘇恒瑞醫藥,2.5 mg/片)促排周期或激素替代周期等個體化方案進行內膜準備。排卵正常者采用自然周期,月經不規律者使用促排卵方案,對于自然周期或促排卵周期內膜薄者可使用激素替代周期準備內膜。自然周期及LE促排周期,在誘發排卵后3 d,行冷凍胚胎復蘇。排卵后給予口服地屈孕酮(達芙通,雅培,荷蘭)20 mg,bid,用藥至妊娠8~10周;雌激素替代周期者從月經周期第3日開始口服雌二醇片(芬嗎通紅色片,蘇威制藥,德國,2 mg/片)2 mg,tid,若服藥10 d后內膜厚度≥8 mm,監測血清E2、P水平,當E2≥732 pmol/L,且無孕酮升高(P<3.17 nmol/L)時,改服雌二醇地屈孕酮片(芬嗎通黃色片,蘇威制藥,德國,2 mg/片)2 mg,tid,同時陰道塞入黃體酮凝膠(雪諾酮,默克雪蘭諾,德國,90 mg/支)90 mg/d,內膜轉化3 d后行FET,移植胚胎≤3個,黃體支持至妊娠12周。
4. 觀察指標及妊娠結局判斷:主要觀察指標為獲卵數、優胚率、頂級優胚率、臨床妊娠率等。優胚率指優質胚胎數與可利用胚胎數的比值,頂級優胚率指頂級優胚數與可利用胚胎數的比值,臨床妊娠率指臨床妊娠數與移植周期數的比值。
移植后14 d檢測血清β-HCG水平,β-HCG陽性者判定為生化妊娠,移植后30 d行陰道B超檢查,宮腔內可見孕囊及原始心管搏動者判定為臨床妊娠。
三、統計學方法
采用SPSS 19.0統計軟件進行分析,計量資料以均數±標準差(±s)表示,符合正態分布的計量資料比較采用t檢驗,非正態分布的計量資料采用Mann-Whitiney U檢驗;計數資料以率(%)表示,組間比較采用χ2檢驗,P<0.05為差異有統計學意義。
結 果
一、患者一般情況比較
入選的264個周期中,PPOS組患者27~47歲,CC組患者28~47歲,兩組患者的平均年齡、平均不孕年限、體重指數(BMI)、平均促排周期數、抗苗勒管激素(AMH)水平比較均無顯著性差異(P>0.05)。而PPOS組的基礎AFC顯著低于CC組(P<0.05)(表1)。
表1 兩組患者的一般情況比較(±s)
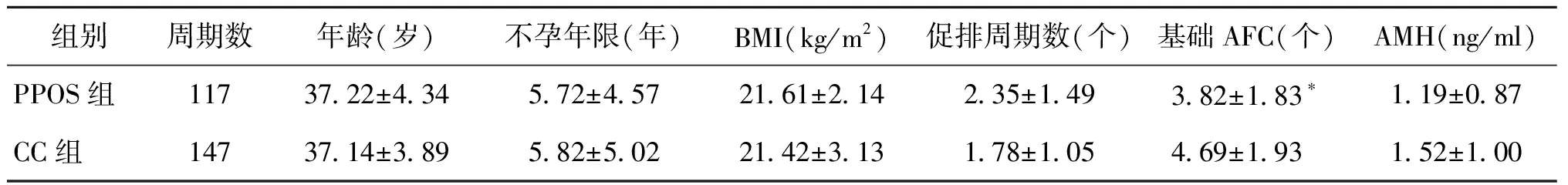
表1 兩組患者的一般情況比較(±s)
組別周期數年齡(歲)不孕年限(年)BMI(kg/m2)促排周期數(個)基礎AFC(個)AMH(ng/ml)PPOS組1173722±434572±4572161±214235±149382±183?119±087CC組1473714±389582±5022142±313178±105469±193152±100
注:與CC組比較,*P<0.05
二、促排過程中血清激素水平變化及未獲卵率比較
PPOS組患者的FSH水平范圍4.18~54.98 U/L,其中FSH>20 U/L者80例,CC組患者FSH水平范圍4.71~35.83 U/L,其中FSH>20 U/L者3例;兩組患者月經D3 FSH水平比較有顯著性差異(P<0.05);基礎E2水平組間比較無顯著性差異(P>0.05);PPOS組患者促排過程中LH最高值、HCG日E2水平、HCG日LH水平均顯著低于CC組(P<0.05);兩組促排后未獲卵率比較無顯著性差異(P>0.05)(表2)。PPOS組患者經媽富隆預處理后FSH平均水平為(6.91±2.01)U/L,CC組患者均未行預處理。CC組患者中有36例添加了GnRH拮抗劑,有2例提前排卵;PPOS組全部未添加拮抗劑,1例發生提前排卵。
三、兩組患者促排過程中用藥、獲卵情況及臨床結局比較
PPOS組的Gn用量及用藥天數顯著高于CC組(P<0.05);兩組HCG日直徑>14 mm的卵泡數、獲卵數、成熟卵母細胞數、正常受精數、卵裂數、可利用胚胎數、優胚數及頂級優胚數比較均無顯著性差異(P>0.05);PPOS組的優胚率及頂級優胚率顯著高于CC組(P<0.05);PPOS組55例進行了FET首次移植,28例臨床妊娠,臨床妊娠率為50.9%;CC組有29例患者進行了鮮胚移植,11例臨床妊娠,臨床妊娠率為37.9%,56例進行了FET首次移植,30例臨床妊娠,臨床妊娠率為53.6%,兩組的FET臨床妊娠率比較無顯著性差異(P>0.05)(表3)。
討 論
一、DOR患者的特點
卵巢儲備功能是指卵巢內存留卵泡的數量和質量,能反映女性的生育潛能和生殖內分泌功能。卵巢儲備在胎兒期即已確定,女性卵泡池在胎齡20周時最大,約有600~700萬個卵泡,出生時減少至100~200萬個,兒童期多數卵泡退化,至青春期只剩下20~50萬個,37歲時僅剩2.5萬個,39歲以上原始卵泡耗竭速度較前增加6倍[8]。DOR是指由于卵巢中卵泡數量減少和卵母細胞質量下降,對垂體Gn反應降低,雌激素分泌減少,負反饋調節減弱,FSH分泌明顯升高,導致女性生育能力減退。
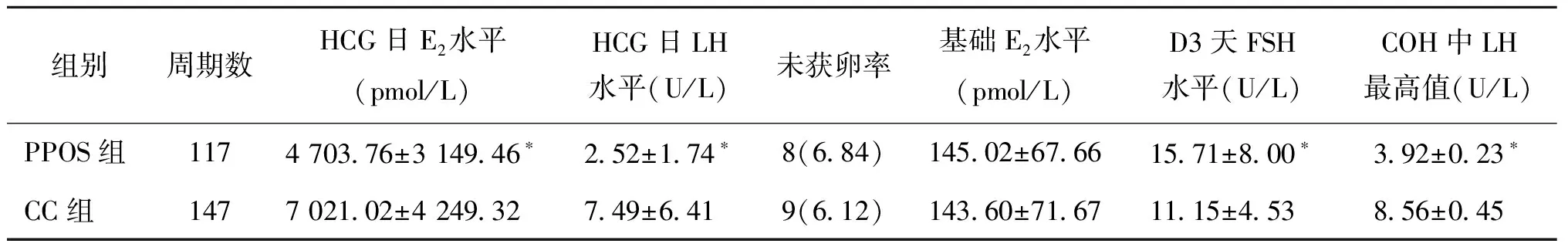
表2 促排過程中各激素水平變化及未獲卵率比較[(x-±s),n(%)]
注:與CC組比較,*P<0.05
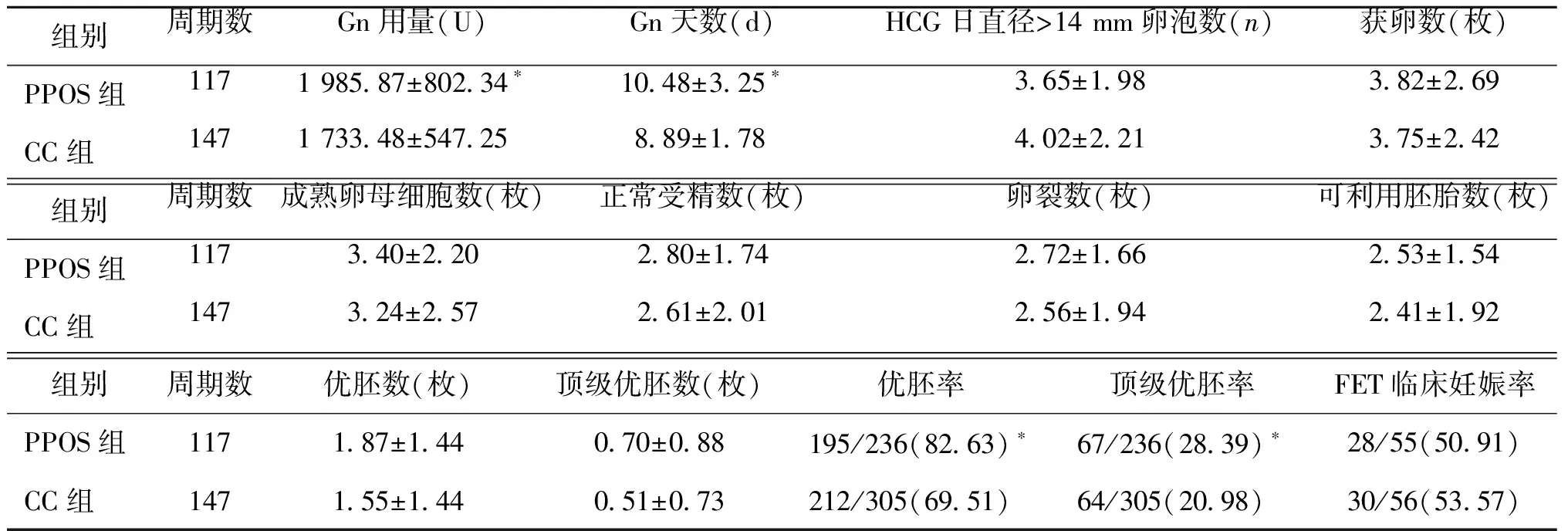
表3 兩組患者促排過程中用藥、獲卵情況及臨床結局比較 [(x-±s),n(%)]
注:與CC組比較,*P<0.05
目前臨床上多采用早卵泡期血清FSH水平、AFC或AMH來預測卵巢儲備功能,血清FSH>10 U/L、AFC<5~7個或AMH<0.5~1.1 ng/ml則提示DOR[9],同時這些指標也預示著卵巢反應低下。其中,基礎FSH是應用最早、最廣泛的卵巢儲備預測的指標之一,是反映竇前卵泡數量的良好指標,基礎FSH升高是卵巢不排卵、DOR的早期信號。有學者發現,基礎FSH升高者促排過程中發生自發性排卵的概率更高,較高的基礎FSH水平是GnRH拮抗劑方案使用過程中發生自發排卵的獨立危險因素,基礎FSH水平每增加1 U/L,自發性排卵風險增加1.2倍,且即使添加拮抗劑也可能由于LH逃逸而發生提前排卵[10]。本研究中,CC方案組基礎FSH>20 U/L者僅占3例,而PPOS組基礎FSH>20 U/L者有80例,COH過程中,PPOS方案組患者并未添加拮抗劑,僅有1例發生自發性排卵;CC組添加拮抗劑者36例,有2例發生自發性排卵。
二、DOR患者的助孕方案選擇
在實施輔助生殖助孕過程中,卵巢對Gn的反應性下降是影響妊娠率的重要環節。有報道顯示,在COH過程中,大約有9%~24%的患者發生卵巢低反應(POR),其病因主要與年齡、遺傳、免疫及環境因素等有關,而DOR往往預示著POR,如何從該類患者有限的卵泡儲備中獲取較多的優質卵母細胞供IVF使用,提高DOR患者的妊娠率,是生殖醫生需要努力探索的目標[11]。目前,臨床上常用兩種方法來增加卵巢的反應性,一是通過增加Gn的劑量來增加獲卵數;二是改變促排卵方案來增加卵巢的反應性。但使用大劑量的Gn后,是否可以降低周期取消率、增加獲卵數、提高臨床妊娠率,目前存在爭議。有學者提出,微刺激方案對此類患者有較好的治療效果,微刺激方案具有治療時間短、費用低、并發癥少等優點,臨床上常用的微刺激方案包括CC微刺激方案、LE微刺激方案等[12-13],其中CC微刺激方案是一種對于DOR患者較為常用的促排卵方案,其優點在于后期加用CC可以抑制早發LH峰的出現,促排過程中HCG日的LH水平顯著低于CC起始日,且對FSH 趨于升高的患者有效[13],但對于基礎FSH>20 U/L的DOR患者,CC微刺激方案可能并不適用[14]。關于CC抑制LH峰的相關機制研究較少,有研究認為,后期加用CC可降低LH水平,可能與CC阻斷雌激素受體,通過降低雌激素對下丘腦的正反饋作用,抑制早發LH峰的發生有關[12-13]。有學者則給出了不同意見,他們發現CC微刺激方案中部分患者LH水平在后期持續上升,其未能有效抑制早發LH峰的發生[15]。本研究中CC微刺激方案組有36例患者出現了LH升高并添加了GnRH拮抗劑,由此可見,持續使用CC并不能完全抑制早發LH峰,部分患者在促排中后期仍需要添加拮抗劑以抑制LH峰的發生,而PPOS方案則可以很好地解決這些問題。PPOS方案對于FSH升高者,先用口服避孕藥短期預處理,降低FSH水平后,使用Gn及口服孕激素進行超促排卵,利用孕激素對下丘腦-垂體-卵巢軸的抗正反饋作用,達到抑制早發LH峰的作用,與傳統方案相比,PPOS方案用藥簡單、給藥途徑方便,抑制LH峰效果顯著。本研究結果提示PPOS方案對于FSH異常升高者能獲得較好的優胚率、頂級優胚率及與CC方案相似的臨床妊娠率,且COH全程LH水平穩定,無1例發生早發LH峰。
三、PPOS方案的原理及特點
對于FSH明顯升高者,臨床上常用口服避孕藥預處理,其中所含有的雌、孕激素通過對內源性FSH及LH的負反饋抑制作用,可一定程度降低FSH、LH水平,解除高FSH對卵巢受體的降調節作用,使卵巢恢復對FSH的敏感性,改善卵泡發育的同步性。但也有文獻報道,口服避孕藥抑制FSH的臨床療效不穩定,且長期口服避孕藥之后,將導致顆粒細胞進一步減少,一旦停止使用,FSH水平迅速上升[16]。因此,對于高FSH的患者,可短期使用口服避孕藥,使FSH水平有所下降,從而恢復卵巢對FSH的敏感性。本研究中對于FSH>12 U/L者,采用媽富隆預處理5 d后復查FSH,大多數能降至10 U/L以下,停用避孕藥即開始進行PPOS。PPOS的核心原理是在雌激素水平上升前使用孕激素,使下丘腦孕激素化,孕激素可以有效地阻斷雌激素誘導的正反饋作用,從而抑制早發LH峰發生。孕激素通過作用于下丘腦孕激素核受體,降低GnRH脈沖性釋放的頻率,從而降低LH水平[17]。早在1973年就有國外學者證實,高孕激素狀態下,大劑量雌激素不能誘發LH峰的發生,雌、孕激素同時作用可以阻斷雌激素誘發的LH峰[18]。朱秀嫻等[19]在一項回顧性研究中對83例行IVF/ICSI助孕的患者進行分析,發現在促排過程中添加口服黃體酮制劑,LH持續低水平,且無1例發生早發LH峰,本研究觀察的結果與之一致。本研究發現,PPOS組中,患者LH水平穩定,無早發LH峰的發生,且優胚率及頂級優胚率顯著高于CC微刺激組,推測可能與促排過程中LH水平相對穩定及FSH下降有關。本研究中,PPOS組中基礎FSH最高值為54.98 U/L,該患者經媽富隆預處理后FSH降至7.86 U/L,最終獲得4枚卵母細胞、2枚可利用胚胎。另有3例患者,基礎FSH水平均超過20 U/L,最終亦獲得了臨床妊娠。本研究結果亦顯示,對于FSH過高的DOR患者在抑制早發LH峰方面,PPOS方案優于CC微刺激方案;而PPOS方案組Gn用量及用藥天數均顯著高于CC微刺激組(P<0.05),這可能與孕激素降低垂體敏感性相關。因此,我們認為PPOS方案為FSH較高的DOR患者提供了一種較為合適的選擇。
綜上所述,PPOS方案對于DOR患者有良好的治療效果,相對于常規長方案來說其所用藥物價格較低、治療時間較短,能減少患者的經濟和情緒壓力,且其抑制早發LH峰效果顯著。但因本研究樣本量有限,后續需要進行大規模、多中心的前瞻性研究以期進一步驗證并優化該方案,且其活產率及流產率還需進一步進行隨訪觀察。
[1] Committee on Gynecologic Practice. Committee opinion no.618:Ovarian reserve testing[J]. Obstet Gynecol,2015,125:268-273.
[3] 匡延平,于莎,洪青青. 超排卵中晚期克羅米芬防止黃體生成素峰的研究[J]. 生殖醫學雜志,2010,19(A01):13-17.
[4] 葉靜,陳秋菊,匡延平. 卵巢功能正常患者高孕激素狀態下促排卵的內分泌特征及IVF/ICSI臨床結局的研究[J]. 生殖與避孕,2015,35:393-400.
[5] 徐千花,曹云霞,魏兆蓮,等. 不同促排卵方法在卵巢儲備功能下降患者中的應用[J]. 生殖與避孕,2009,29:51-54.
[6] Cummins JM,Breen TM,Harrison KL,et al. A formula for scoring human embryo growth rates in in vitro fertilization:its value in predicting pregnancy and in comparison with visual estimates of embryo quality[J]. J In Vitro Fert Embryo Transf,1986,3:284-295.
[7] Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology. The Istanbul consensus workshop on embryo assessment:proceedings of an expert meeting[J]. Hum Reprod,2011,26:1270-1283.
[8] Faddy MJ,Gosden RG. A model conforming the decline in follicle numbers to the age of menopause in women[J]. Hum Reprod,1996,11:1484-1486.
[9] Wang YA,Healy D,Black D,et al. Age-specific success rate for women undertaking their first assisted reproduction technology treatment using their own oocytes in Australia,2002-2005[J]. Hum Reprod,2008,23:1633-1638.
[10] 羅璐,陳明暉,賈夢希,等. GnRH拮抗劑方案在體外受精-胚胎移植周期中自發排卵風險的大樣本量回顧性研究[J]. 中華婦產科雜志,2016,51:352-356.
[11] 耿嘉瑄,張少娣,張翠蓮,等. 不同促排卵方案在卵巢低反應患者中的應用[J]. 生殖與避孕,2010,30:837-840.
[12] 張少娣,謝娟珂,耿嘉瑄,等. 40歲以上患者體外受精-胚胎移植不同促排方案的療效分析[J]. 生殖與避孕,2011,31:250-254.
[13] 傅薇,李路,董曦,等. 克羅米芬對卵巢儲備功能減退者進行促排卵治療的有效性研究[J]. 生殖與避孕,2013,33:347-350.
[14] 高彥,冒韻東,王嫜,等. 微刺激和自然周期體外受精/卵胞漿內單精子注射治療的臨床結局分析[J].生殖醫學雜志,2013,22:34-38.
[15] Williams SC,Gibbons WE,Muasher SJ,et al. Minimal ovarian hyperstimulation for in vitro fertilization using sequential clomiphene citrate and gonadotropin with or without the addition of a gonadotropin-releasing hormone antagonist[J]. Fertil Steril,2002,78:1068-1072.
[16] Griesinger G,Kolibianakis EM,Venetis C,et al. Oral contraceptive pretreatment significantly reduces ongoing pregnancy likelihood in gonadotropin-releasing hormone antagonist cycles:an updated meta-analysis[J]. Fertil Steril,2010,94:2382-2384.
[17] 劉亞麗,于莎,陳秋菊,等. 克羅米芬聯合高孕激素促排卵抑制早發LH峰的臨床結局研究[J]. 生殖與避孕,2016,36:263-269.
[18] Dierschke DJ,Yamaji T,Karsch FJ,et al. Blockade by progesterone of estrogen-induced LH and FSH release in the rhesus monkey[J]. Endocrinology,1973,92:1496-1501.
[19] 朱秀嫻,陳秋菊,匡延平. 卵巢功能正常患者使用不同促性腺激素聯合安宮黃體酮促排卵的IVFF/ICSI-ET結局[J]. 生殖與避孕,2015,35:310-317.
[編輯:肖曉輝]
Clinical outcome of progestin-primed ovarian stimulation in women with diminished ovarian reserve &high FSH
SHENXiu,LISong-jun*,ZHOURui-qiong,YANGCai-lian,ZHANGHong,DENGWei-fen
ReproductiveCenterofShenzhenArmedPoliceHospital,Shenzhen518023
Objective:To analyze the clinical outcomes of the progestin-primed ovarian stimulation (PPOS) in the IVF/CISI-ET patients with diminished ovarian reserve & high FSH.Methods:The clinical data of 264 cycles in the women with diminished ovarian reserve in the Reproductive Medical Center of Shengzhen Wujing Hospital from January 2015 to January 2016 were analyzed. The cycles were divided into two groups:117 cycles treated with PPOS and 147 cycles treated with clomiphene citrate (CC) stimulation. The clinical characteristics and outcome were compared between the two groups.Results:The highest value of LH [(3.92±0.23) vs. (8.56±0.45) U/L],E2levels [(4 703.76±3 149.46) vs. (7 021.02±4 249.32) pmol/L] & LH levels [(2.52±1.74) vs. (7.49±6.41) U/L] on HCG day in the PPOS group were significantly lower than those in the CC group (P<0.05). The total dosage and days of gonadotropin (Gn) used in the PPOS group were significantly higher those in the CC group(P<0.05). The high-quality embryo rate (82.63% vs. 69.51%) and the top-quality embryo rate (28.39% vs. 20.98%) in the PPOS group were significantly higher than those in the CC group (P<0.05).There were no significant differences in the numbers of follicles with diameter more than 14 mm on HCG day,oocytes retrieved,mature oocytes,normal fertilization,cleavages,and available embryos between the two groups (P>0.05). There was also no significant difference in clinical pregnancy rate in frozen embryo transfer (FET) between the two groups (P>0.05)Conclusions:Progestin-primed ovarian stimulation protocol can effectively prevent premature LH surge during the ovarian stimulation and obtain good clinical outcome for the patients with DOR & higher FSH.
Progestin-primed ovarian stimulation; Clomiphene citrate mild stimulation; Diminished ovarian reserve
10.3969/j.issn.1004-3845.2017.04.012
2016-08-02;
2016-11-25
沈秀,女,湖北黃岡人,碩士,生殖醫學專業.(*
,Email:13723470237@163.com)

