庫存血加熱對于血漿中IL-8的影響
孫 楠,溫 轉,韓麗娜,彭 華,李 捷(.河北醫科大學第四醫院輸血科,河北 石家莊 0500;.河北醫科大學第四醫院干部保健處,河北 石家莊 0500)
·論 著·
庫存血加熱對于血漿中IL-8的影響
孫 楠1,溫 轉2,韓麗娜1,彭 華1,李 捷1
(1.河北醫科大學第四醫院輸血科,河北 石家莊 050011;2.河北醫科大學第四醫院干部保健處,河北 石家莊 050011)
目的探討溫浴不同溫度和時間對血漿中白細胞介素8(interleukin-8,IL-8)的影響,為庫存紅細胞安全、有效的使用提供理論依據。方法隨機抽取河北省血液中心采集的無償獻血、經檢測各項指標均合格的血液標本50份,每份均分成8段(A、B、C、D、E、F、G、H組)分別行4 ℃保存,37 ℃加熱10、20、30、60、120、180 min和40 ℃加熱30 min處理,并進行后續實驗。采用雙抗體夾心酶聯免疫吸附測定法檢測血漿中IL-8濃度。結果加熱能明顯上調IL-8水平,并且有時間依賴性,隨加熱時間延長IL-8水平逐漸增高,B、C組血漿IL-8濃度與A組相比差異無統計學意義(P>0.05),而D、E、F、G、H組血漿IL-8濃度與A組相比顯著升高,差異有統計學意義(P<0.05)。結論庫存紅細胞37 ℃溫浴30 min以內對血漿IL-8濃度無明顯影響,之后隨著時間延長逐漸升高。
輸血;紅細胞免疫功能;白細胞介素8
醫院輸血科庫存的紅細胞一般在4 ℃條件下保存,若將4 ℃保存的紅細胞直接輸入患者體內,會出現體溫下降以及冷抗體導致的溶血等不良反應。如果將庫存血加熱后輸注可以避免以上不良反應,但是庫存血加熱后對其免疫功能是否有影響呢?是否能在更大程度上提高輸血治療的效果?本研究通過檢測血漿中白細胞介素8(interleukin-8,IL-8)濃度的變化來評價加熱對庫存紅細胞免疫功能是否有影響,并進一步探討保證紅細胞免疫功能的最佳溫浴時間,旨在為庫存紅細胞安全、有效的使用提供理論依據。
1 材料與方法
1.1 樣本來源 隨機抽取2015年1—12月河北省血液中心采集的經檢測各項指標均合格的無償獻血者血液標本共50份,約10 mL/份。將所采集每份血液與血袋中CPD 保養液充分混勻后, 注入血袋細管小辮,將其分成8段小樣4 ℃保存備用;每次各取1個小樣測定, 分別于4 ℃保存(A組),37 ℃加熱10 min(B組)、20 min(C組)、30 min(D組)、60 min(E組)、120 min(F組)、180 min(G組)和40 ℃加熱30 min(H組)處理后,對上述標本分別進行血漿IL-8濃度的檢測。本研究獲得河北醫科大學第四醫院倫理委員會批準。
1.2 方法 血漿IL-8濃度測定采用雙抗體夾心酶聯免疫吸附測定法,IL-8酶聯免疫試劑盒由法國Diaelone公司生產,結果以ng/L表示。性能參數:靈敏度≥25 ng/L。重復性:板內變異系數<10%,板間變異系數<10%。
1.2.1 血漿制備 將待測標本以3 000 g離心5 min,收集上層血漿至試管備用。
1.2.2 試劑準備 按照試劑盒說明的內容,準備好標準品、生物素、親和鏈霉素-HRP、洗滌液。
1.2.3 檢測程序 按照試劑盒說明的內容:①建立標準曲線,將標準孔進行倍比稀釋操作;②將各組待檢樣品加入相應的樣品孔;③加入配有標記物的IL-8抗體;④孵育,室溫(18~25 ℃)1 h后洗板;⑤加入親和鏈霉素-HRP室溫孵育20 min;⑥洗板后加入底物,在室溫避光孵育20 min;⑥加入終止液,30 min內在酶標儀內振蕩后,450 nm測試吸光度。
1.2.4 結果分析 將酶標儀所測得的吸光度減去空白孔以防止板間差異和本地差異,繪制標準曲線,根據標準曲線求得各樣品孔血漿中IL-8濃度。
1.3 統計學方法 應用SPSS 13.0軟件對所有數據進行統計學處理。計量資料比較分別采用單因素方差分析和SNK-q檢驗。P<0.05為差異有統計學意義。
2 結 果
血漿IL-8濃度在37 ℃加熱30 min以內無顯著變化,之后隨著時間延長逐漸升高。與A組相比,B、C組血漿IL-8濃度差異無統計學意義(P>0.05),而D、E、F、G、H組血漿IL-8濃度顯著高于A組,差異有統計學意義(P<0.05);E、F、G、H組血漿IL-8濃度顯著高于D組,差異有統計學意義(P<0.05)。見表1。
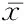
表1 庫存懸浮紅細胞加熱不同溫度不同時間后IL-8濃度比較Table 1 The level of IL-8 in storing suspending erythrocytes treated with different degree for various times (n=50,±s,ng/L)
*P<0.05與A組比較 #P<0.05與D組相比較(SNK-q檢驗)
3 討 論
傳統觀點認為,紅細胞在人體內只是通過攜帶氧氣和二氧化碳參與呼吸功能,并不參與免疫系統運轉。隨著人們對于紅細胞基礎分析、臨床觀察和動物實驗等研究的深入,逐漸發現紅細胞具有非常重要的免疫功能,1981年Siegel等提出了機體中除了白細胞免疫系統外還存在紅細胞免疫系統這一重要概念,紅細胞和中性粒細胞、淋巴細胞等經典免疫細胞共同參與機體的免疫系統,紅細胞的免疫功能和免疫活性與許多疾病尤其是腫瘤和一些自身免疫性疾病的發生和進展有密切的關系[1-2]。紅細胞具有包括識別攜帶抗原、清除血液循環中的免疫復合物、防御感染、增強T細胞依賴反應、抗自由基氧化、促進中性粒細胞的吞噬功能和調控淋巴細胞活性等。紅細胞的免疫功能包括天然免疫功能和獲得性免疫功能,天然免疫功能包括免疫黏附功能等,獲得性免疫功能包括調控自然殺傷細胞殺傷活性、促進中性粒細胞的吞噬功能等,紅細胞在人體中數量巨大,是一種重要的免疫細胞。輸血作為一種替代性的治療方法,在創傷急救、外科手術以及出血性休克等治療過程中都是不可缺少的。輸血前血液加熱可以避免由于低溫造成的患者不良反應。有研究表明,在臨床輸血中對于大劑量輸血的患者,在輸注前需要對紅細胞進行溫浴加熱處理,這樣可以改變血液的流變性質,有效降低紅細胞的黏度,使血液輸注的速度加快,便于搶救大出血的危重患者;紅細胞在4 ℃條件保存會出現胞膜脆性程度升高、膜變形能力下降,直接輸注到患者體內會降低紅細胞的壽命,降低紅細胞輸注的治療效果,而通過37 ℃加熱可以有效解決這一問題[3]。
紅細胞膜上具有的許多廣譜趨化因子受體(duffyantigenreceptorforchemokines,DARC),也稱紅細胞趨化因子受體(erythrocytechemokinreceptor,ECKR),DARC與IL-8可以發生受體和配體的結合反應,DARC不斷吸附血漿中的IL-8, 使人體血液循環中IL-8的濃度保持在最適宜的水平,因此紅細胞對于血漿中IL-8的濃度起到重要的調控作用。IL-8的主要生物學功能是在炎癥反應中趨化中性粒細胞、T淋巴細胞等到達病變部位。IL-8是吞噬細胞、腫瘤細胞等一些類型的細胞受刺激后釋放的因子,為血小板β球蛋白超家族成員,是促炎癥與促營養血管生長的細胞因子,有利于腫瘤細胞增殖和轉移。國內外研究發現,IL-8的生物學功能可以使腫瘤細胞避免因為藥物治療和物理治療等手段引起的細胞凋亡,從而增強腫瘤細胞的遷移和侵入[4]。IL-8還參與卵巢癌、前列腺癌、肺癌、肝癌、胃癌、乳腺癌等多種癌癥的發病過程和侵襲轉移[5-6]。IL-8在血漿中的濃度對于臨床治療腫瘤具有相當重要的參考意義[7-15]。IL-8與冠心病、急性腦梗死、慢性阻塞性肺疾病等疾病的發病機制密切相關,并且還可作為疾病恢復或進行性加重的指標[16-24]。紅細胞可以負調節血漿中IL-8的濃度[25],可以降低腫瘤的轉移,促進炎性因子向正常水平恢復,因此輸血治療中保證紅細胞的正常免疫功能有著非常重要的意義。
本研究結果顯示,IL-8含量隨著庫存血37 ℃加熱時間增加而增高, 尤其在加熱60min后增高明顯(P<0.05)。這是由于紅細胞膜表面也有大量的IL-8受體,紅細胞可通過該受體迅速地結合血漿中IL-8等趨化因子并通過循環系統清除掉IL-8,但隨著加熱時間延長,紅細胞能量代謝增加,而周圍環境無法提供營養而導致紅細胞膜不斷受損,膜表面IL-8受體隨之減少,最終導致血漿中IL-8濃度升高。有報道指出,腦缺血后患者體內紅細胞被破壞,IL-8濃度升高并導致其神經元細胞等出現炎性損傷[26]。本研究結果顯示,隨著加熱時間延長和加熱溫度的提高,血漿中IL-8濃度越來越高。提示,為保證輸血過程中血漿中IL-8濃度的穩定,應將血漿加熱時間限制在30min以內,溫度不超過37 ℃,避免因為加熱時間過長導致患者體內IL-8濃度升高,從而影響患者的治療和康復。
[1] 丁艷,郭海,顧武軍.紅細胞免疫在腫瘤研究中的進展[J].遼寧中醫藥大學學報,2007,9(1):68-69.
[2] 劉靜.健脾為主中藥對人胃癌移植瘤裸鼠腫瘤生長與轉移及紅細胞免疫功能影響的實驗研究[J].中華腫瘤防治雜志,2007,14(2):107-109.
[3] 嚴建新.庫存血液在不同溫度下加熱紅細胞變形性變化[J].中國衛生檢驗雜志,2010,20(6):1554-1555.
[4]SinghRK,LokeshwarBL.Depletionofintrinsicexpressionofinterleukin-8inprostatecancercellscausescellcyclearrest,spontaneousapoptosisandincreasestheefficacyofchemotherapeuticdrugs[J].MolCancer,2009,8:57-71.
[5]MerrittWM,LinYG,SpannuthWA,etal.Effectofinterleukin-8genesilencingwithliposome-encapsulatedsmallinterferingRNAonovariancancercellgrowth[J].JNatlCancerInst,2008,100(5):359-372.
[6] 曹寶森,李霞,常茂葉,等.外周血IL-8和Fractalkine表達與非小細胞肺癌病理特征的關系[J].河北醫科大學學報,2013,34(7):757-760.
[7] 馬鐘鈴,秦思達,張伯翔,等.非小細胞肺癌中IL-8與MCP-1的表達及其臨床意義[J].現代腫瘤醫學,2016,24(3):394-397.
[8] 楊蒙,劉曉斌.白細胞介素-8與腫瘤的研究進展[J].中國醫藥導報,2016,13(26):33-37.
[9] 李鑫屹,楊楊,黃校青,等.白細胞介素-8對前列腺癌細胞增殖及遷移的影響[J].中國老年學雜志,2016,36(6):33-37.
[10] 龐雪利,李礦發,魏蘭,等.IL-8通過上調Bcl-2的表達和下調caspase-3的表達抑制MCF-7乳腺癌細胞凋亡[J].細胞與分子免疫學雜志,2015,31(3):307-311.
[11] 王毅,楊振華,李雪丹,等.IL-8通過整合素調控肝癌HepG2細胞遷移[J].軍事醫學,2016,40(8):623-627.
[12] 李鳳英,楊楊,李鑫屹,等.外源性IL-8上調其受體表達促進宮頸癌Hela細胞增殖[J].中國老年學雜志,2016,36(11):2603-2605.
[13] 張長杰,徐新偉,李洪利,等.吞噬細胞運動蛋白1(ELMO1)在IL-8誘導的乳腺癌細胞的侵襲和轉移中發揮重要作用[J].中國藥理學通報,2016,31(10):1452-1457.
[14] 鐘延法.乳腺癌患者血漿IL-6、IL-8、TNF-α水平變化及其臨床意義[J].山東醫藥,2016,56(30):82-84.
[15] 鄧芳,王靜,范夢恬,等.過表達白細胞介素8促進乳腺癌BT549細胞遷移[J].細胞與分子免疫學雜志,2016,32(5):585-589.
[16] 白建蓉,閔興明,黃遠帥.冠心病患者血清IL-8表達量與血小板gpⅡb/Ⅲa活性白細胞血小板聚集率之間的關系[J].貴州醫藥,2016,40(7):686-688.
[17] 路小薇.急性腦梗死患者血清炎性因子及血流動力學變化及意義[J].海南醫學院學報,2016,22(1):93-95.
[18] 虞莉娜,席剛明,劉進香.急性腦梗死患者血清中miR-21-5p與炎性因子的相關性分析[J].河北醫科大學學報,2016,18(11):177-179.
[19] 郭紅雨,樊建勛,王松齡,等.老年腦梗死泌尿系感染患者白介素與組織因子的變化研究[J].中華醫院感染學雜志,2016,26(15):3428-3430.
[20] 楊凌婧.穩定期中重度慢阻肺患者血清IL-6、IL-8、TNF-α、hs-CRP與肺功能的相關性研究[J].臨床肺科雜志,2016,21(3):481-484.
[21] 張曉慧.炎性細胞因子水平檢測對慢性阻塞性肺疾病的臨床意義[J].海南醫學院學報,2016,22(3):240-242.
[22] 陳艷蓉,竇立陽,劉穎,等.慢性阻塞性肺病患者急性加重期外周血IL-8、TNF-α及IGF-I表達變化的意義[J].現代生物醫學進展,2016,16(6):1092-1094.
[23] 何小雙,許西琳,劉冬,等.慢性阻塞性肺疾病患者呼出氣冷凝液中白介素8、白介素17水平及其與第1秒用力呼氣末容積占預計值百分比的關系研究[J].中國全科醫學,2016,19(1):63-67.
[24] 劉力興,賈欽堯,陳紹平,等.慢性阻塞性肺疾病患者外周血單個核細胞絲裂原活化蛋白激酶p38的表達[J].中國老年學雜志,2016,36(12):2966-2968.
[25] 郭峰,錢寶華,張樂之,等.紅細胞調控IL-8/IL-12的血細胞快速培養實驗研究[J].臨床醫學工程,2011,18(1):7-9.
[26] 許國根,陳斕,陳雯,等.心肺復蘇病人腦缺血-再灌注損傷后炎性細胞因子的監測及其意義[J].中國急救醫學,2001,21(7):385-3861.
(本文編輯:劉斯靜)
Effect of heating on blood plasma IL-8
SUN Nan1, WEN Zhuan2, HAN Li-na1, PENG Hua1, LI Jie1
(1.DepartmentofBloodTransfusion,theFourthHospitalofHebeiMedicalUniversity,Shjiazhuang050011,China; 2.DepartmentofCadreHealthService,theFourthHospitalofHebeiMedicalUniversity,Shjiazhuang050011,China)
Objective To study the effects of storing suspending erythrocytes after water bath on interleukin-8(IL-8) in plasma, and further more to confirm the effect of water bath at various times and different degrees on IL-8 in plasma. Our study will provide the theoretical basis for safe and effective use of storing suspending erythrocytes. Methods Fifty blood samples were selected randomly from blood center in HebeiProvince, with detection of all indicators qualified. Each divided into 8 groups(A, B, C, D, E, F, G, H) which were stored at 4 ℃, heated at 37 ℃ for various time(10, 20, 30, 60, 120, 180 min) and 40 ℃ for 30 min for subsequent experiments. IL-8 concentration in plasma was detected by adopt double antibody sandwich enzyme-linked immunosorbent assay. Results Heating could significantly up-regulated IL-8 level, and with time-dependence pattern. There was no significant difference in plasma IL-8 concentration between B and C group compared with A group(P>0.05). Plasma levels of IL-8 in D, E, F, G, H were significantly higher than those in the A group, the difference was statistically significant(P<0.05).Conclusion There was no significant effect on plasma IL-8 concentration in water bath at 37 ℃ within 30 min,and then gradually increased with time extended.
blood transfusion; erythrocyte immune functions; interleukin-8
2017-02-07;
2017-03-06
孫楠(1978-),男,河北保定人,河北醫科大學第四醫院主管技師,醫學碩士,從事臨床輸血研究。
R457.1
A
1007-3205(2017)04-0454-04
10.3969/j.issn.1007-3205.2017.04.020

