羥基磷灰石對人腎小管上皮細胞骨橋蛋白表達的影響及機制探討
余駿川,鄧耀良,黎承楊,陶芝偉,關曉峰,吳基華,寧鑫,劉云龍,何子奇,劉權
(廣西醫科大學第一附屬醫院,南寧530021)
腎結石是泌尿外科常見疾病之一,復發率高。探討腎結石的病因與發病機制是泌尿外科研究的熱點。目前認為,遺傳、飲食、環境及鈣代謝異常等因素相互作用參與了泌尿系結石的形成發展。其中,尿液過飽和所引起的礦物異質成核、晶體生長聚集及晶體與腎上皮細胞的黏附等引起的鈣代謝異常在腎結石的發病中發揮了重要作用[1,2]。近年研究發現,腎結石中最常見的草酸鈣結石起源于腎鈣化斑(Randall斑)的形成[3],羥基磷灰石(HAP)是Randall斑的核心成分[4]。骨橋蛋白(OPN)是一種非膠原性骨基質糖蛋白,參與細胞間黏附、趨化、遷移和信號傳導等生理及病理過程。研究發現,OPN參與了腎結石的形成,在腎結石患者腎乳頭Randall斑內及周圍均發現OPN蛋白的存在[5]。目前,對Randall斑部位的結石形成過程中HAP的作用及其對OPN表達的影響尚不明確。2015年9月~2016年6月,我們觀察了HAP對人腎小管上皮細胞株HK-2細胞的損傷作用及細胞內OPN的表達變化,探討HAP在腎結石形成中的作用。
1 材料與方法
1.1 細胞及試劑 HK-2細胞購于中國典型培養物保藏中心。HAP購于北京德科島金科技有限公司;DMEM/F12細胞培養基、胎牛血清(FBS)購于美國Gibco公司;TRIzol、逆轉錄試劑盒、RT-qPCR試劑盒購于大連TaKaRa公司;鼠抗人OPN、β-actin內參抗體購于Abcam公司。
1.2 細胞培養 HK-2細胞在含10%FBS的DMEM/F12細胞培養液中,置于5%CO2、37 ℃培養箱中培養,每天換液。當細胞貼壁生長到培養瓶面積的75%~80%時,用0.25%的EDTA胰酶進行消化傳代。調整每個培養瓶的細胞密度為1×105/mL,用DEME/F12細胞培養液繼續培養至細胞密度40%~50%時,進行后續實驗。
1.3 分組及干預方法 取生長良好的第5代HK-2細胞,以3×108/L的密度接種于6孔板,待細胞融合后,分為正常對照組、HAP1組、HAP2組、HAP3組及HAP4組。正常對照組在正常培養液中培養,HAP1組、HAP2組、HAP3組及HAP4組分別加入200、400、600、800 ng/mL的HAP懸液。
1.4 細胞活力檢測 采用CCK-8法。各組加入相應的HAP懸液后,每組設10個孔,在培養箱中孵育12、24、48、72 h后,向每孔中加入CCK-8溶液10 μL,將96孔板置于培養箱內孵育2 h。用酶標儀測定在450 nm波長處每孔的光密度OD值,計算細胞存活率,細胞存活率=(ODHAP各組/OD正常對照組)×100%,重復3次,取平均值。
1.5 細胞內OPN mRNA表達檢測 采用RT- qPCR法。取各組培養24 h后細胞,按照Takara公司RNA提取試劑盒說明書進行操作,抽提各組細胞總RNA。然后繼續按照Takara公司的逆轉錄步驟進行逆轉錄,所得到的cDNA進行RT-qPCR實驗,以β-actin 為對照。引物由Takara公司設計合成,引物如下:OPN 上游5′-ACACATATGATGGCCGAGGTGA-3′;下游5′-GTGTGAGGTGATGTCCTCGTCTGTA-3′。β-actin 上游5′-TGGCACCCAGCACAATGAA-3′,下游5′-CTAAGTCATAGTCCGCCTAGAAGCA-3′。采用2-ΔΔCt法計算各樣本mRNA相對表達量。
1.6 細胞內OPN蛋白表達檢測 采用Western blot法。取各組培養24 h后細胞,加入蛋白提取液裂解細胞。賽默飛公司酶標儀測定蛋白含量,每樣本各取蛋白10 μg,10%SDS-PAGE電泳,PVDF膜200 mA轉印2 h,以5%脫脂奶粉封閉60 min,分別加入稀釋的一抗OPN(1∶1 000)、GAPDH(1∶1 000)于4 ℃孵育12 h 后,辣根過氧化物酶標記的羊抗鼠、羊抗兔IgG 二抗室溫孵育1 h,ECL化學發光法顯色,曝光顯影,掃描儀掃描結果。Image Lab圖像分析軟件分析結果,以OPN/GAPDH值作為OPN蛋白相對表達量。
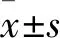
2 結果
2.1 各組細胞活力變化結果 隨著HAP濃度增加,細胞存活率逐漸降低,細胞存活率與HAP的濃度呈負相關(r=-0.566 3,P<0.01)。隨著HAP作用時間延長,細胞存活率逐漸降低,細胞存活率與HAP作用時間呈負相關(r=-0.796 3,P<0.01)。見表1。
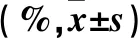
表1 各組不同時間細胞存活率比較
2.2 各組細胞內OPN mRNA表達比較 正常對照組、HAP1組、HAP2組、HAP3組、HAP4組OPN mRNA相對表達量分別為1.151±0.029、1.201±0.004、1.269±0.029、1.179±0.022、1.406±0.058,HAP2組、HAP4組OPN mRNA相對表達量均高于正常對照組(P均<0.05)。
2.3 各組細胞內OPN蛋白表達比較 正常對照組、HAP1組、HAP2組、HAP3組、HAP4組OPN蛋白相對表達量分別為0.418±0.010、0.436±0.016、0.512±0.021、0.562±0.016、0.627±0.023, HAP2、HAP3、HAP4組OPN蛋白相對表達量均高于正常對照組(P均<0.05)。見圖1。

圖1 各組細胞內OPN蛋白表達情況(Western blot法)
3 討論
草酸鈣晶體是腎結石的主要成分,而HAP是誘發草酸鈣在腎乳頭表面沉淀并凝結的重要原因[6]。Randall斑作為大多數特發性草酸鈣結石在腎乳頭的黏附部位,位于髓袢降支細段的基底膜,是草酸鈣結石形成的起始位點,而HAP是草酸鈣結石的重要組成成分[4]。Evan等[7]通過高分辨率CT發現,結石能夠黏附在Randall斑上生長。但Randall斑發生HAP聚集的原因及其在腎結石發生中的作用機制尚未完全明確。
研究發現,Randall斑部位腎小管上皮細胞的損傷可導致HAP在此處的異常沉積,可能是導致腎結石發生的始動因素。研究發現,非洲綠猴腎上皮細胞表面草酸鈣的黏附量與晶體聚集程度及細胞的損傷程度呈正相關[8]。當各種原因導致的腎臟氧化應激反應激活后,可導致腎小管上皮細胞炎癥損傷[9],促進腎小管上皮基底膜Randall斑部位的HAP沉淀聚集。Evan等[10]研究發現,腎結石患者的結石附著點上皮細胞受到破壞,認為腎小管上皮細胞的損傷能夠為HAP聚集提供條件。細胞受損后,不僅讓磷脂酰絲氨酸暴露在細胞表面[11,12],而且還表達了如HA、OPN、CD44、膜聯蛋白Ⅱ、含唾液酸的糖蛋白和核仁素相關蛋白(NRP)[13]等多種晶體黏附分子,這些分子帶有負電荷,既可以通過氫鍵與草酸鈣中的草酸根(Ox2-)作用,又可以通過靜電作用和草酸鈣晶體結合,從而大大增強損傷后的細胞對晶體的黏附能力。當Randall斑中的HAP大量聚集后,可導致間質的理化環境改變,進而鈣化成腎乳頭鈣化斑,并可跟隨尿液流動,流到腎盞在遠端末梢小管管腔聚集。此外,當聚集的HAP達到一定數量之后,還可刺激遠端小管的泌氫作用,使尿液發生酸化,使磷酸鈣晶體在集合小管末端溶解,釋放出鈣離子及草酸根離子,形成草酸鈣小晶體,導致草酸鈣結石的形成。本課題組前期研究發現,腎結石患者腎組織中存在顯著的鈣鹽結晶,并出現明顯的因細胞損傷而導致的氧化應激反應[14],提示細胞損傷是導致結石形成的重要原因。本研究發現,細胞存活率與HAP濃度呈負相關,提示隨著HAP濃度增加HK-2細胞的存活率逐漸降低;細胞存活率與HAP作用時間呈負相關,提示HAP對HK-2細胞的抑制作用隨著作用時間的延長逐漸增強,表明HAP對HK-2細胞具有一定的損傷作用,且與HAP的濃度及作用時間有關,可能與結石的形成有關。
OPN為帶負電荷的磷酸化糖蛋白,多表達于骨組織中,也表達于腎臟、動脈血管平滑肌細胞、泌尿生殖道、膽囊等組織中。研究發現,腎結石大鼠腎臟組織中OPN表達水平明顯升高,被認為是導致結石形成的關鍵控制因素[15,16]。Taguchi等[5]研究發現,在腎結石患者的腎小管上皮細胞和腎小管間質細胞中,Randall斑中OPN蛋白比不含Randall斑的部分表達更高。Gan等[17]也通過研究非洲綠猴腎細胞損傷發現,細胞受到損傷之后,不僅對晶體的黏附能力顯著強于正常細胞,而且OPN蛋白的表達水平也有明顯上升。以上研究表明,OPN作為一種重要的多功能性蛋白,與尿路結石的形成具有密切關系,在OPN介導草酸鈣晶體在腎小管上皮的附著、沉積方面表現得尤為突出。Hirose等[18]研究發現,在結石形成初期,當草酸鈣晶體導致腎小管上皮細胞損傷時,OPN的黏附作用可能會激發結石晶體異質成核這一過程,進而促進結石的形成。Alex等[15]也發現在結石大鼠模型中,OPN的表達呈增高趨勢。本研究發現,HAP2組、HAP4組OPN mRNA表達均高于正常對照組,HAP2、HAP3和HAP4組OPN蛋白表達量均高于正常對照組,提示不同濃度的HAP干預后可使OPN mRNA及蛋白表達增加,可能與腎結石的形成有關。
綜上所述,HAP對HK-2細胞具有一定的損傷作用,并可導致細胞OPN mRNA及蛋白表達增加,可能是其參與腎結石形成的機制之一。

