白毛藤多糖聯合阿霉素對乳腺癌細胞凋亡的影響※
● 楊旭東 張 杰 楊清東 楊驕霞 王桂云 崔榮軍 劉洪鳳
白毛藤多糖聯合阿霉素對乳腺癌細胞凋亡的影響※
● 楊旭東1*張 杰1▲楊清東1楊驕霞2王桂云1崔榮軍1劉洪鳳1
目的:探討白毛藤多糖(Solamum lyratum Thunb polysaccharide,SLTP)聯合阿霉素(Adrismycim,ADM)對人乳腺癌MCF-7細胞凋亡的影響及其分子機制。方法:實驗分為空白對照組、ADM組、ADM+低劑量SLTP組,ADM+中劑量SLTP組,ADM+高劑量SLTP組。通過RT-PCR檢測各組Bcl-2、Fas基因表達量的變化,同時應用熒光顯微鏡觀察人乳腺癌細胞MCF-7細胞凋亡情況。結果:與空白對照組比較,ADM組及ADM+高中低劑量SLTP組細胞凋亡率增加,并且上調Fas和降低Bcl-2表達。結論:阿霉素及阿霉素聯合白毛藤多糖促進其MCF-7細胞凋亡,其機制可能與激活Fas、抑制Bcl-2的基因表達有關。
白毛藤多糖 阿霉素 乳腺癌 Fas Bcl-2
乳腺癌即乳腺惡性腫瘤,是女性常見的惡性腫瘤之一,治療方式以手術治療為主。對于無法手術治療的患者,如何一方面保證化療藥物的療效,一方面減少化療藥物的毒副作用,一直是臨床上惡性腫瘤化療過程中亟待解決的問題。白毛藤(Solamum lyratum Thunb)是茄科植物白英的全草,傳統中醫認為其有清熱、利濕、解毒、消腫之功用[1]。本課題組前期實驗表明,白毛藤對多種腫瘤細胞具有增殖抑制作用[2-3],本研究進一步觀察白毛藤多糖(Solamum lyratum Thunb polysaccharide,SLTP)聯合阿霉素(Adrismycim,ADM)對人乳腺癌MCF-7細胞增殖的影響及其分子機制,為SLTP應用于乳腺癌的輔助化療,降低化療藥物的毒副作用提供實驗依據。
1 材料
1.1 乳腺癌細胞株 人乳腺癌MCF-7細胞株購于武漢中美科技有限公司,按細胞庫要求培養細胞。
1.2 主要試劑 RT-PCR試劑盒及相關試劑購于大連寶生物有限公司(批號:DRR019A);胰酶(批號: 1606137)、引物購于上海生工生物工程公司;DMEM培養基(批號:12491013)、胎牛血清(批號:1527494)、Trizol(批號15596-026)購于美國Gibco公司,4℃保存;MTT細胞增殖分析試劑盒購于Sigma公司(批號: PB11058)。
2 方法
2.1 藥物的制備 白毛藤清洗勻漿、醇提、沉淀,留取沉淀再溶解、再沉淀、離心分離。蒸餾水溶解固體部分,加入等體積氯仿/正丁醇混合液(4∶1),振蕩混勻20min,沉淀,取上清,去除蛋白,重復操作3次。取上清,再醇析(4倍乙醇),取沉淀用乙醚、丙酮依次洗滌,冷凍干燥,即得SLTP。
2.2 細胞培養與分組 精確稱取適量SLTP溶解于10%胎牛血清的 DMEM培養液中配置成16mg· mL-1SLTP的母液,4℃儲存,應用時按比例稀釋。MCF-7細胞培養于含10%胎牛血清的DMEM培養液中,37℃,5%CO2培養箱中培養。調零組:不含細胞的培養液;空白對照組:用含MCF-7細胞的培養液;ADM組:1mg·L-1ADM;ADM+低劑量SLTP組: 1mg·L-1ADM+0.4mg·mL-1SLTP;ADM+中劑量SLTP組:1mg·L-1ADM+0.8mg·mL-1SLTP; ADM+高劑量SLTP組:1mg·L-1ADM+1.6mg· mL-1SLTP。
2.3 MTT方法檢測細胞的藥物敏感性 以每孔150μL將密度為1×105個·mL-1的MCF-7細胞接種于96孔培養板中。分別加入不同濃度藥物20μL,每組設5個復孔,另外設不加藥物的空白對照組。細胞培養12、24、48h后,除調零組外各組分別加入20μL MTT(5g·L-1);培養4h后,棄去MTT液,加DMSO150μL/孔,全自動酶標儀490nm波長,測定光密度值(OD值)。計算腫瘤細胞抑制率(inhibition rate,IR)。IR=(對照組OD-實驗組OD)/(對照組OD-空白組OD)×100%。
2.4 細胞凋亡檢測 MCF-7細胞以3×105·mL-1的濃度,接種于6孔培養板中,1mL/孔。CO2培養箱孵育細胞24h后,加入相應藥物,對照組加相同體積新鮮培養液。48h后胰酶消化細胞制成細胞懸液,0.01mol·L-1PBS漂洗 3遍,固定液 4℃固定細胞10min,棄固定液,0.01mol·L-1PBS漂洗細胞3次,5min/次,干燥后,在37℃、5%CO2培養箱中,用5mg ·L-1Hoechst33258染色液染色15 min,取出蓋玻片,用甘油與PBS比例為1:9的混合性封片劑封片,熒光顯微鏡觀察。計算細胞凋亡率,細胞凋亡率=[凋亡細胞/(凋亡細胞+正常細胞)]×100%。
2.5 RT-PCR檢測 總RNA的提取,將各組細胞中加入1mL Trizol,用移液管吹打混勻,移入Ep管,15~30℃放置5min。每管加入0.2ml氯仿,震蕩混勻,室溫放置3min。12000 r·min-1、4℃,離心15min,上清移入新Ep管,加0.5mL異丙醇,混勻,靜置10min。12000r·min-1、4℃、離心 5min,棄上清液,加入1mL4℃75%乙醇(DEPC水配制),震蕩使RNA沉淀重新懸浮。7500r·min-1、4℃,離心5min,棄上清,靜置10min,加入DEPC水20μL混勻、溶解RNA,分光光度計測定A260/A280為1.8-2.0,RNA產物置于-80℃冰箱保存。PCR擴增引物如下:Fas上游引物序列為:5'-CGCCTATGGTTGTTGTTGACC-3';Fas下游引物序列為:5'-CCTCTGTTACGACCTC-3',擴增產物Fas的長度為477bp。Bcl-2上游引物序列為:5'-GACTTCTCGTCGCTACCGTC-3';Bcl-2下游引物序列:5'-ACATGCACCTACCCAGCCTCCGTTATC-3',擴增產物Bcl-2長度為296bp。β-actin上游引物序列為:5'-ATGTGGCACCACACCTTCTA-3',β-actin下游引物序列為:5'-CGTCATACTCCTGCTTGCTG-3',擴增產物β-actin片段為838bp。PCR反應條件:94℃、5min,預變性,1個循環;94℃、5min,變性,54℃、50s,退火,72℃、90s,延伸,35個循環;72℃、10min,延伸,1個循環。瓊脂糖凝膠電泳后拍照,軟件分析Bcl-2、Fas mRNA的相對表達量。
3 結果
3.1 MTT實驗測定藥物敏感性 實驗結果顯示,高中低劑量的SLTP分別與ADM合用對乳腺癌細胞都有明顯的抑制增殖作用,其作用效果比單用ADM效果明顯。見表1。
表1 細胞生長抑制率(%±s)
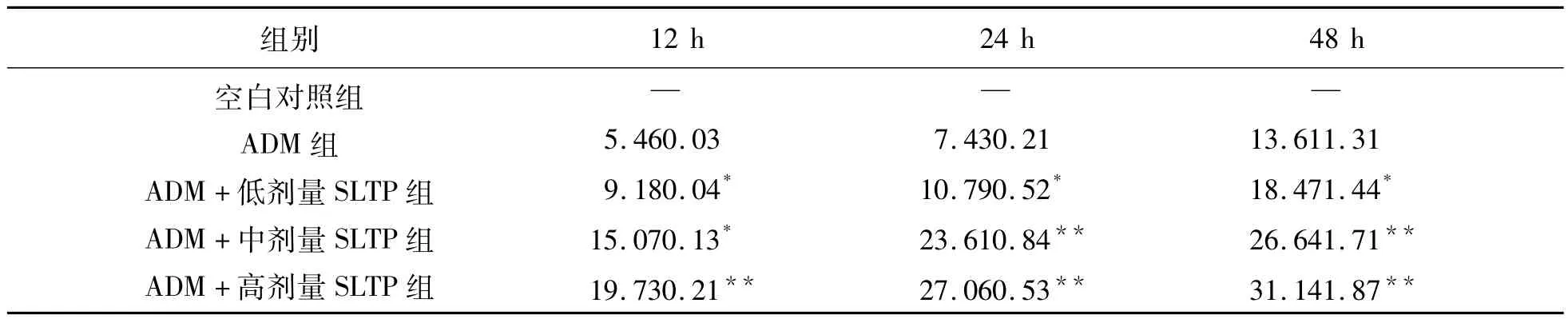
表1 細胞生長抑制率(%±s)
注:與ADM組比較,**P<0.01,*P<0.05。
組別12 h 24 h 48 h空白對照組ADM組ADM+低劑量SLTP組ADM+中劑量SLTP組ADM+高劑量SLTP組———5.460.03 9.180.04*15.070.13*19.730.21**7.430.21 10.790.52*23.610.84**27.060.53**13.611.31 18.471.44*26.641.71**31.141.87**
3.2 細胞凋亡情況 熒光顯微鏡下可見空白對照組細胞核形態完整。不同濃度藥物作用于乳腺癌MCF-7細胞48 h后,熒光標記的凋亡細胞,細胞核呈藍色深染、細胞核碎裂等情況。各組細胞的凋亡率各不相同,與空白對照組凋亡率(3.76%)比較,ADM組凋亡率(6.37%)明顯升高,說明ADM可以誘導乳腺癌MCF-7細胞凋亡;ADM+低劑量SLTP組凋亡率為9.03%,ADM+中劑量SLTP組凋亡率為11.41%,ADM+高劑量SLTP組凋亡率為15.43%,與空白對照組比較,ADM+高劑量SLTP組腫瘤細胞的凋亡率升高最明顯(P<0.01)。
3.3 ADM聯合SLTP對Bc1-2和Fas基因表達影響
腫瘤細胞中抑制細胞凋亡的Bcl-2基因的表達情況(見圖1及表2):與空白對照組比較,藥物作用48h后,ADM組Bcl-2基因表達減少(P<0.05),ADM+低劑量SLTP組、ADM+中劑量SLTP組、ADM+高劑量SLTP組Bcl-2基因表達降低,效果更顯著(P<0.01);腫瘤細胞中促進細胞凋亡的Fas基因的表達情況(見圖2及表2):與空白對照組比較,藥物作用48h后,ADM組Fas基因表達增加(P<0.05),ADM+低劑量SLTP組、ADM+中劑量SLTP組、ADM+高劑量SLTP組Fas基因表達增加,效果更顯著(P<0.01)。
表2 ADM聯合SLTP對Bc1-2和Fas基因表達影響(±s)
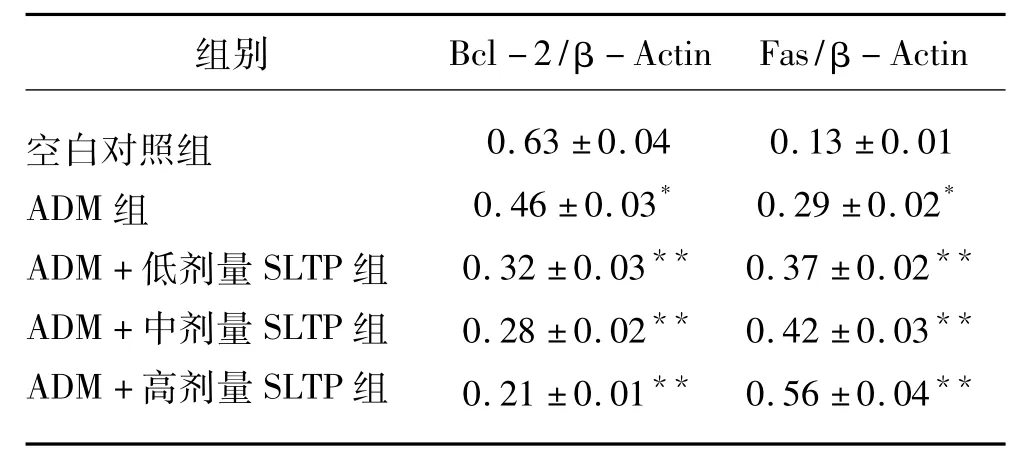
表2 ADM聯合SLTP對Bc1-2和Fas基因表達影響(±s)
注:與空白對照組比較,**P<0.01,*P<0.05。
組別 Bcl-2/β-Actin Fas/β-Actin空白對照組ADM組ADM+低劑量SLTP組ADM+中劑量SLTP組ADM+高劑量SLTP組0.63±0.04 0.46±0.03*0.32±0.03**0.28±0.02**0.21±0.01**0.13±0.01 0.29±0.02*0.37±0.02**0.42±0.03**0.56±0.04**

圖1 ADM聯合SLTP對Bc1-2基因表達影響
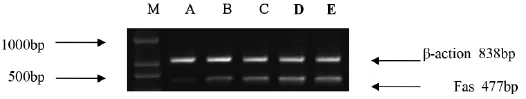
圖2 ADM聯合SLTP對Fas基因表達影響M.DNA Marker;A.空白對照組;B.ADM組;C.ADM+低劑量SLTP組; D.ADM+中劑量SLTP組;E.ADM+高劑量SLTP組
4 討論
乳腺癌是發生在乳腺腺上皮組織的惡性腫瘤,目前已成為威脅女性健康的常見腫瘤之一[4、5]。大多患者通過乳腺癌根治術治療,但由于乳腺癌細胞之間連接松散,易脫落,可隨血液或淋巴液播散全身,形成轉移,危及生命。對于無法采用手術治療的患者或術后恢復的患者往往輔助化療治療腫瘤。化療藥物在殺滅腫瘤細胞同時損傷正常組織細胞,因此提高化療藥物的敏感性至關重要,在保證治療效果的同時又降低了化療藥物毒副作用。細胞的無限制生長可導致腫瘤的發生,其原因是細胞的過度增殖和細胞凋亡的減少,因此調控抗凋亡基因及凋亡基因的表達成為了腫瘤治療中的一個潛在的靶點。Bcl-2基因最早在研究B細胞淋巴瘤中發現的,其位于18q21,具有明顯的抑制細胞凋亡的作用,是Bcl-2家族中最具代表的抗凋亡蛋白。其通過調控線粒體途徑、影響細胞膜跨膜轉運、激活谷氨酰胺轉移酶、改變鈣離子分布等機制調控凋亡,因此,Bcl-2蛋白的表達情況可以在一定程度上反映細胞凋亡的程度[6-8]。實驗研究表明Bcl-2等凋亡相關基因的異常表達是導致腫瘤化療耐受的重要原因之一[9-10]。因此藥物是否能有效抑制Bcl-2等凋亡相關基因的異常表達,將能提高腫瘤細胞對化療藥物的敏感性,降低化療的抵抗。Fas蛋白是一種細胞膜表面受體蛋白,在細胞凋亡中起重要的作用,分子量為45kd,位于人染色體的10q24.1,與活化的T淋巴細胞表面的配體Fas-L蛋白結合,向細胞膜內傳遞死亡信號,誘導細胞凋亡[11]。
本研究結果顯示:高中低劑量的SLTP分別與ADM合用可明顯抑制乳腺癌細胞增殖,誘導細胞凋亡,提高ADM的藥物療效;并且SLTP能明顯上調Fas基因表達,下調Bcl-2基因表達,其作用效果比單用ADM效果明顯。表明SLTP可能通過調節Bcl-2及Fas基因表達的平衡,增加腫瘤細胞對ADM的敏感性,促進ADM誘導乳腺癌細胞的凋亡。為SLTP應用于乳腺癌的輔助化療提供實驗依據,然而其協同作用機制仍需進一步研究。
[1]馮洪錢.民間獸醫本草[M].北京:科學技術文獻出版社,1993:307-308.
[2]楊旭東,張 杰,楊驕霞.白毛藤對人乳腺癌MCF-7細胞凋亡的影響[J].中國現代中藥,2010,12(4):34-36.
[3]楊旭東,張 杰,董 凱.白毛藤總苷誘導人食管癌細胞Ec-9706凋亡及其作用機制的研究[J].牡丹江醫學院學報,2011,32(1):7-9.
[4]黃哲宙,陳萬青,吳春曉,等.中國女性乳腺癌的發病和死亡現狀——全國32個腫瘤登記點2003-2007年資料分析報告[J].腫瘤,2012,32:435-439.
[5]胡一迪,胡孝渠,李 權,等.Survivin,caspase-8在人體乳腺癌增生乳腺癌癌前病變和乳腺癌中的表達程度分析[J].中國生化藥物雜志,2015,13:100-102.
[6]Kelly PN,Strasser A.The role of Bcl-2 and its pro-survival relatives in tumourigenesis and cancer therapy[J].Cell Death Differ,2011,18(9): 1414-1424.
[7]Shamas-Din A,Kale J,Leber B,et al.Mechanisms of action of Bcl-2 family proteins[J].Cold Spring Harb Perspect Biol,2013,5(4):714.
[8]Martinou JC,Youle RJ.Mitochondria in apoptosis:Bcl-2 family members and mitochondrial dynamcis[J].Dev Cell,2011,21(1):92-101.
[9]秦緒軍,何 偉,海春旭.Bcl-2蛋白在腫瘤放化療氧化損傷中的作用[J].癌變畸變突變,2014,26(5):361-364.
[10]王雪峰,何援利,譚 峰.Bcl-2基因對環磷酰胺誘導的大鼠卵巢損傷的保護作用[J].中國婦幼保健,2013,28(1):143-147.
[11]Martin-villalba A,Llorens-bobadilla E,Wollny D.CD95 in cancer: tool or target[J].Trends in Molecular Medicine,2013,19(6):329-335.
黑龍江省中醫藥管理局中醫藥科研項目(No.ZHY10-W71);牡丹江醫學院科學技術研究項目(No.ZS201314)
楊旭東,男,副教授。主要從事中藥的藥理與毒理研究。
▲通訊作者張杰,女,碩士。主要從事中藥的藥理與毒理研究。E-mail:zhangjie03mdj@126.com
1.黑龍江省牡丹江醫學院(157011);2.黑龍江省牡丹江醫學院附屬紅旗醫院(157011)

