海洋肌酐水解酶菌株的篩選鑒定及其酶學性質研究
石群,張慶芳,楊麗娜,王曉輝,竇少華,遲乃玉*
海洋肌酐水解酶菌株的篩選鑒定及其酶學性質研究
石群1,2,張慶芳1,2,楊麗娜1,2,王曉輝1,2,竇少華1,2,遲乃玉1,2*
(1.大連大學生命科學與技術學院,遼寧大連116622;2.遼寧省海洋微生物工程技術研究中心,遼寧大連116622)
從渤海海泥中篩選出一株肌酐水解酶高產菌株S-09,經形態學、生理生化特征并結合16S rDNA系統發育分析,鑒定菌株為微小桿菌屬(Exiguobacteriumsp.)。對所產肌酐水解酶進行酶學性質研究表明,該酶的最適作用溫度為30℃,熱穩定性較差;最適作用pH值為7.5,堿性條件下,pH值穩定性較好;Co2+、Mn2+對酶的激活作用較強,Ag+、Hg2+對酶有顯著的抑制作用。
海洋;肌酐水解酶;菌株篩選;鑒定;酶學性質
肌酐(creatinine)是一種低分子質量的含氮化合物,是肌酸代謝的終末產物[1]。它僅僅由腎小球排泄,不被腎小管重吸收,所以血清中肌酐濃度主要與腎小球濾過率相關,如果肌酐值超過707 μmol/L就被診斷為尿毒癥,因而血清中的肌酐濃度是一項判斷腎功能的重要指標[2-3]。目前肌酐的檢測方法主要有化學法和酶促法[4]。化學方法專一性不強、敏感性差、易受樣品干擾,而酶促法具有專一性強和靈敏度高等特點[5-6],因而備受國際臨床化學聯盟與我國臨床檢驗中心重視并逐漸成為臨床主要檢測方法[7]。肌酐水解酶(creatininase)EC 3.5.2.10作為酶促檢測法中的關鍵酶之一,其性能的好壞直接影響到測定系統的可靠性[8]。但是直到目前,我國仍沒有自主研制的肌酐測定的工具酶,原酶生產技術不成熟及臨床所用的檢測試劑盒也主要依賴進口[9-10],并且鮮見從海洋中篩選產肌酐水解酶的菌株的相關報道和研究。為了推廣酶促法檢測肌酐,降低檢測成本,為臨床診斷提供可靠的依據,針對國內這個幾乎空白的市場,本實驗利用海洋這個巨大的資源篩選獲得高產肌酐水解酶的菌株S-09,對其進行形態學、生理生化特征及16S rDNA序列分析,進而確定其種屬并研究酶學性質,為研究海洋微生物發酵生產肌酐水解酶進而實現肌酐水解酶的國產化奠定基礎。
1 材料與方法
1.1 材料與試劑
1.1.1 菌株
試驗菌株篩選自渤海海域(123°371′E,39°6972′N)海泥樣品,經鑒定為微小桿菌屬(Exiguobacteriumsp.),命名為S-09,現由遼寧省海洋微生物工程技術研究中心保藏。
1.1.2 培養基
初篩培養基:肌酐1%,酵母浸粉0.5%,瓊脂2%,K2HPO40.2%,KH2PO40.05%,MgSO4·7H2O 0.01%,KCl 0.005%,水1 000 mL,pH 7.0,121℃滅菌20 min。
LB(Luria-Bertani)培養基[11]:胰蛋白胨1%,酵母浸粉0.5%,瓊脂2%,NaCl 1%,水1 000 mL,pH 7.0,121℃滅菌20 min。
種子培養基:胰蛋白胨1%,酵母浸粉0.5%,NaCl 1%,水1 000 mL,pH 7.0,121℃滅菌20 min。
發酵培養基:肌酐0.5%,胰蛋白胨0.5%,K2HPO40.1%,KH2PO40.05%,MgSO4·7H2O0.05%,KCl0.05%,水1000mL,pH 7.0,121℃滅菌20 min。
1.1.3 試劑
蛋白Marker:加拿大Fermentas公司;肌酐、肌酸:大連凱美化工工程配套有限公司;苦味酸:生工生物工程(上海)股份有限公司;其余試劑均為國產分析純。
1.2 儀器與設備
HZP-250全溫振蕩培養箱:上海精宏實驗設備有限公司;CX21FS3顯微鏡:日本奧林巴斯有限公司;MLS-3750高壓蒸汽滅菌器:日本三洋電機株式會社;SCIENTZ-ⅡD超聲波細胞破碎機:寧波新芝生物科技股份有限公司;UV-H232可見紫外分光光度計:菲迪康樂(廣州)科學儀器有限公司;DYY-6C電泳儀:北京市六一儀器廠。
1.3 方法
1.3.1 菌株初篩
取10 g海泥加入90 mL帶有玻璃珠的無菌水中,振蕩30 min。用無菌水從10-1依次梯度稀釋至10-7,分別取10-4、10-5、10-6、10-7稀釋度樣品各0.1 mL,均勻涂布于初篩培養基上,25℃倒置培養。挑取能夠在初篩培養基上生長的菌株,結合菌落形態與顯微鏡觀察,純化得到菌株于LB培養基,4℃保藏。
1.3.2 菌株復篩
將初篩獲得的菌株接入種子培養基中在25℃、200r/min培養24 h,按5%的接種量轉入相同種子培養基中,25℃、200r/min培養24h,按5%的接種量接種于初始發酵培養基,25℃、200 r/min培養24 h。通過測定發酵液肌酐水解酶活,篩選出肌酐水解酶活高的菌株作為目的菌株進行后續實驗。
1.3.3 菌株鑒定
(1)細菌形態觀察
在初篩培養基上觀察菌落的形狀、大小、顏色等形態學特征,通過革蘭氏染色在光學顯微鏡(10×100)下觀察菌體形態。
(2)菌株生理生化特征鑒定
根據《常見細菌系統鑒定手冊》[12]進行生理生化試驗。主要包括葡萄糖氧化發酵測定、氧化酶反應、接觸酶反應、硝酸鹽還原試驗、產生吲哚試驗、淀粉水解試驗、糖、醇類發酵試驗、脲酶試驗、硫化氫產生、含碳化合物的利用、檸檬酸鹽的利用。
(3)16S rDNA的PCR擴增和序列分析
采用Ezup柱式細菌基因組DNA抽提試劑盒提取菌株DNA。以提取到的菌株S-09 DNA為模板,以16S rDNA基因通用引物對16S rDNA序列片段進行聚合酶鏈反應(polymerase chain reaction,PCR)。其引物如下:正向引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和反向引物1492R(5′-GGTTACCTTGTTACGACTT-3′)。擴增后交由生工生物工程(上海)股份有限公司進行測序,測序結果在GenBank中進行BLAST比對分析,根據分析結果對菌株S-09進行種屬鑒定,利用MEGA軟件構建系統發育樹。
1.3.4 肌酐水解酶活測定方法[13-14]
取0.1 mL的酶液加入0.9 mL肌酸溶液中,37℃反應10 min后取出0.1 mL反應液加入1 mol/L NaOH和0.5%苦味酸(各1 mL)終止反應,加入0.9 mL蒸餾水,于25℃水浴鍋水浴20 min后于波長520 nm處測吸光度值。肌酐水解酶活力定義:在上述反應條件下,每分鐘催化1 μmol肌酐轉變成產物所需要的酶量為一個酶活力單位(U)。
1.3.5 粗酶液的制備
將純化后的菌株S-09接于發酵培養基中,培養36 h。發酵菌液于4℃、4000r/min離心30min得到菌體,用超純水將菌體水洗2次,4℃、4000r/min離心30min。將離心得到的濕菌體用0.1 mol/L pH 7.5的磷酸緩沖液溶解。冰浴條件下用超聲波細胞粉碎機裂菌(作用3s,間隔3s,120W,共10min)。低溫(4℃)10 000 r/min離心10 min收集上清液即為肌酐水解酶粗酶液。
1.3.6 酶學性質的初步研究
(1)酶最適反應溫度
取一定量酶液,分別在20℃、25℃、30℃、35℃、40℃、45℃、50℃、55℃、60℃條件下,測定肌酐水解酶酶活,相對酶活計算以同組最高酶活為100%,每次做3組平行實驗。
(2)酶的熱穩定性
將酶液分別置于30℃、35℃、40℃、45℃、50℃、55℃、60℃、65℃、70℃水浴中保存30 min立即冷卻,并測定肌酐水解酶酶活,相對酶活計算以同組最高酶活為100%,每次做3組平行實驗。
(3)酶最適作用pH
在酶最適作用溫度下,分別在pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的磷酸鹽緩沖液反應體系中測定肌酐水解酶酶活,相對酶活計算以同組最高酶活為100%,每次做3組平行實驗。
(4)酶的pH穩定性
在pH 4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0的磷酸鹽緩沖液中加入酶液,于25℃保溫24 h,測定肌酐水解酶酶活,相對酶活計算以同組最高酶活為100%,每次做3組平行實驗。
(5)不同化學物質對酶活性的影響
以不添加任何化學物質的發酵液為對照,在發酵液中加入不同化學物質,于25℃處理30 min,使ZnSO4·7H2O、FeSO4·7H2O、CoCl·6H2O、MnCl2·4H2O、CuSO4·5H2O、MgSO4·7H2O、CrCl2·6H2O、HgCl2、AgNO3終濃度均為1mmol/L,鰲合劑乙二胺四乙酸(ethylenediaminetetraaceticacid,EDTA)終濃度為20 mmol/L,表面活性劑Tween-20 0.1%及TtritonX-100 0.5%,測定肌酐水解酶活力,每次做3組平行實驗。
2 結果與分析
2.1 菌株篩選及形態特征
對渤海海域海泥進行初篩和復篩,得到9株具有肌酐水解酶活性的菌株。從中獲得一株高產肌酐水解酶菌株,該菌株發酵產酶穩定,命名為S-09。其菌落形態及革蘭氏染色結果見圖1。
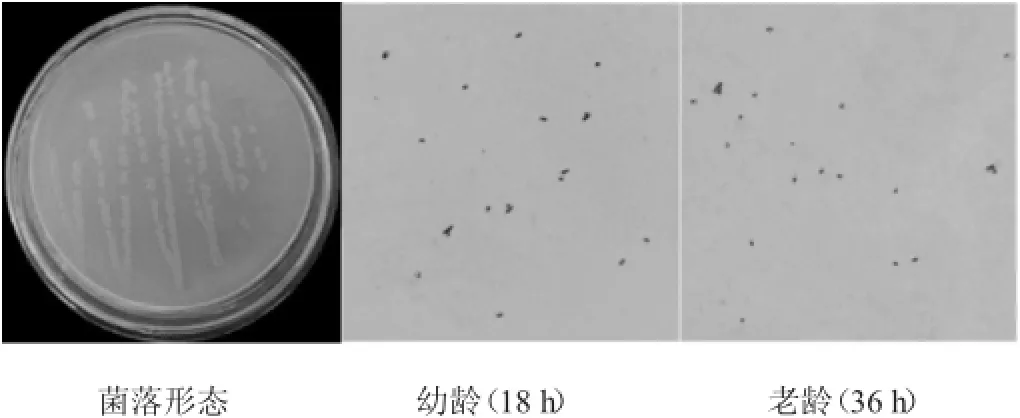
圖1 菌株S-09菌落形態及革蘭氏染色結果Fig.1 Colonial morphology and gram staining results of strain S-09
由圖1可知,該菌株在LB培養基25℃培養18~36 h,菌落呈淡橙色、圓形、平坦、不生孢、不透明,革蘭氏染色呈陽性。菌株S-09幼齡細胞為桿狀,常呈V形排列,老齡細胞呈球狀。細胞培養過程中有明顯的桿、球狀周期變化。
2.2 生理生化鑒定結果
按照《常見細菌系統鑒定手冊》(第8版)對菌株S-09進行生理生化試驗,結果如表1所示。

表1 菌株S-09的生理生化特征Table 1 Physiological and biochemical characteristics of strain S-09
由表1可知,菌株S-09生理生化特征如下:好氧,氧化酶、脲酶試驗呈陰性,過氧化氫酶、硝酸鹽還原、接觸酶均呈陽性。利用葡萄糖不產酸不產氣,能利用多種含碳化合物如檸檬酸鈉、乙酸鈉等。能利用多種碳水化合物如D-果糖、甘露醇、葡萄糖、D-木糖。不能利用L-山梨糖和棉子糖。
2.3 16S rDNA序列分析與系統發育樹的構建
菌株S-09經PCR擴增電泳,結果見圖2。鄰接(Neighbor-Joining,NJ)法進行系統發育樹構建,結果見圖3。
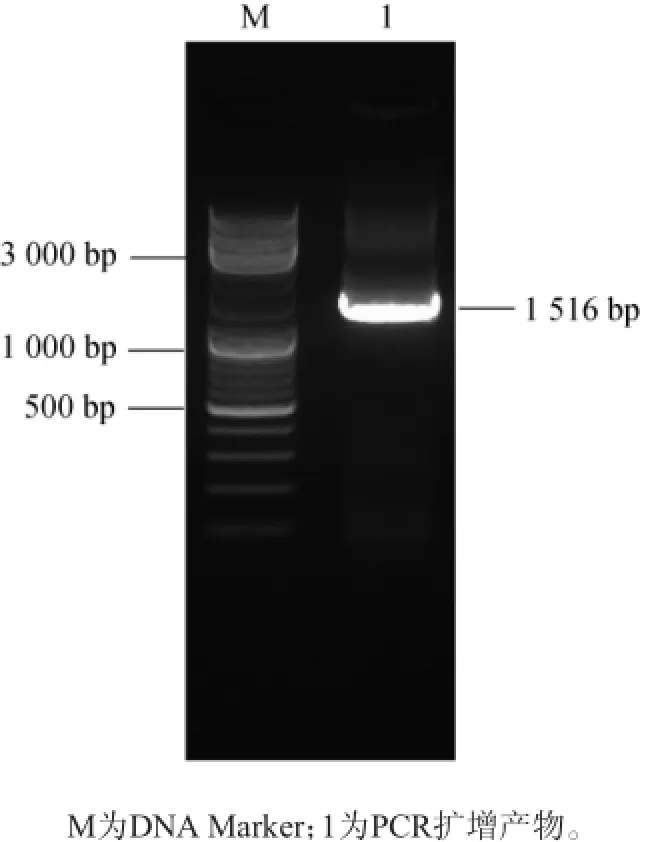
圖2 菌株S-09的16S rDNA PCR擴增結果Fig.2 16S rDNA PCR amplification results of strain S-09
由圖2可知,PCR擴增產物序列長度為1 516 bp。由圖3可知,該菌株與Exiguobacteriumsp.9AN NR 114970.1同源性較高,相似度為99%,結合菌體形態特征和16S rDNA的序列系統發育樹分析,確定該菌株屬于微小桿菌屬(Exiguobacteriumsp.)。
2.4酶學性質初步研究
2.4.1 酶作用的最適溫度
由圖4可知,肌酐水解酶最適作用溫度為30℃。該酶在25~35℃低溫環境下能保持較高水平的酶活,符合低溫酶性質[15]。這對于縮短反應時間、降低開發成本具有重要意義。
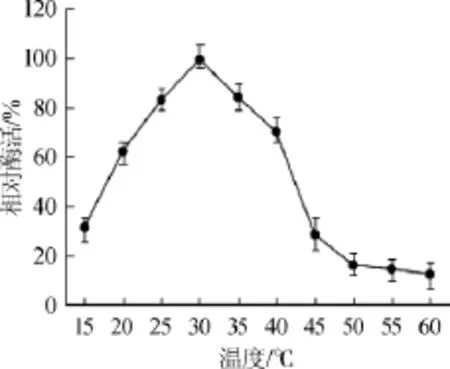
圖4 酶最適作用溫度曲線Fig.4 Optimal temperature curve of creatininase
2.4.2 酶的熱穩定性
將酶液在不同溫度下處理30 min后測定酶活力,結果見圖5。由圖5可知,該酶在30~50℃處理30min后保持較高酶活且相對穩定。在60℃處理30 min后,相對酶活為70%;65℃處理30 min后,相對酶活僅為45%,說明該酶熱穩定性較差。
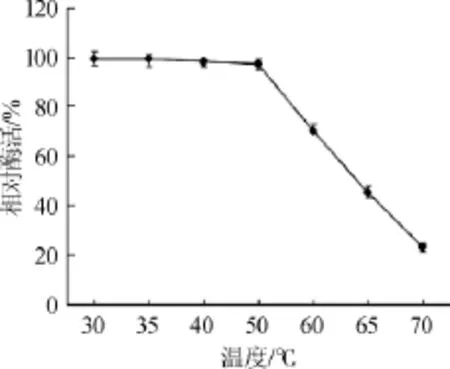
圖5 酶的熱穩定性Fig.5 Thermostability of the creatininase
2.4.3 酶作用的最適pH及穩定性
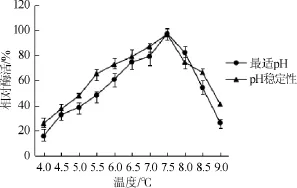
圖6 酶的最適pH及其pH穩定性曲線Fig.6 Optimal pH and pH stability curve of creatininase
由圖6可知,肌酐水解酶的最適作用pH值為7.5。在pH值>8.0時,相對酶活呈下降趨勢;當pH值為7.0~8.0時,該酶的相對酶活能保存80%以上,說明該酶在偏堿性環境下穩定性較好。因此,選擇pH 7.5作為最佳保藏的pH值。
2.4.4 不同化學物質對酶活性的影響
以不添加任何化學物質的發酵液為對照,在發酵液中加入不同化學物質,于25℃處理30 min,使ZnSO4·7H2O、FeSO4·7H2O、CoCl·6H2O、MnCl2·4H2O、CuSO4·5H2O、MgSO4·7H2O、CrCl2·6H2O、HgCl2、AgNO3終濃度均為1 mmol/L,鰲合劑EDTA終濃度為20 mmol/L,表面活性劑Tween-200.1%及TtritonX-1000.5%,測定肌酐水解酶活力,結果見表2。
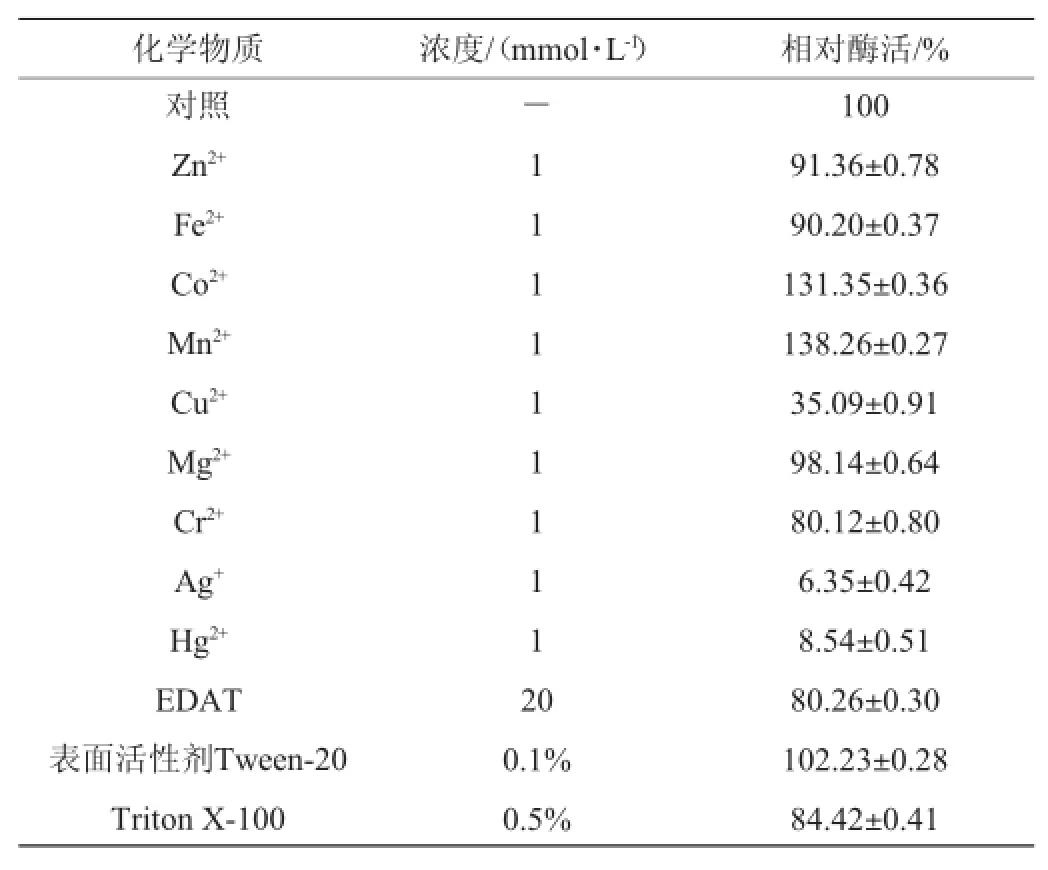
表2 不同化學物質對酶活性的影響Table 2 Effect of different chemical substances on creatininase activity
由表2可知,Ag+、Hg2+幾乎能使酶完全喪失失活;Co2+、Mn2+對酶的激活作用較強;Cr2+、EDTA、Triton X-100、表面活性劑Tween-20對酶有較弱的抑制作用;Cu2+、Zn2+、Fe2+、Mg2+對酶幾乎無影響。
3 結論
本實驗共從渤海海域的海泥中篩選出9株產肌酐水解酶的菌株,并選中一株酶活較高的菌株命名為S-09,對其進行形態學、生理生化特征、16S rDNA序列分析,鑒定菌株S-09為微小桿菌屬。菌株S-09與國內外篩選的其他產肌酐水解酶的菌株相比[16],具有最適生長溫度低(25℃)、高耐壓能力(菌株篩選深度>100 m)、原始菌株產酶活力高等優點。菌株S-09作為一株產肌酐水解酶的新菌源,具有潛在的開發價值。對其所產的肌酐水解酶酶學性質進行初步研究,結果表明,該酶的最適作用溫度為30℃;酶的最適作用pH值為7.5;酶的作用溫度較低,屬于低溫酶類。海洋微生物發酵生產低溫肌酐水解酶具有很大優勢,肌酐水解酶在低溫下具有高酶活力及高催化效率,在應用中能減少工藝流程可大大縮短處理時間并省卻昂貴的加熱或冷卻費用[17-18]。海洋肌酐水解酶的研究,為實現我國自主研發的肌酐檢測試劑盒并將其商品化拓寬了應用前景。后續關于該酶的分離純化及工業發酵等試驗還在進一步深入探究中。
[1]BURKE D G,MACLEAN P G,WALKER R A,et al.Analysis of creatine and creatinine in urine by capillary electrophoresis[J].J Chromatogr B, 1999,732(2):479-485.
[2]李萍,趙瑩,余霆.肌酐在腎小球濾過功能損傷診斷中的價值的系統評價[J].中國循證醫學雜志,2004,11(4):752-758.
[3]MATSUDA Y,WAKAMATSU N,INOUYE Y,et al.Purification and characterization of creatine amidinohydrolase ofAlcaligenes origin[J]. Chem Pharm Bull,1986,34(5):2155-2160.
[4]盧紅波,馬曉航.肌酸水解酶的研究及其應用[J].科技通報,2009,25(4):437-440.
[5]THIENPONT L M,VAN LANDUYT K G,STOCKL D,et al.Candidate reference method for determining serum creatinine by isocratic HPLC: Validation with isotope dilution gas chromatography-mass spectrometry andapplicationforaccuracyassessmentofroutinetest kits[J].Clin Chem, 1995,41(7):995-1003.
[6]石凌波,林龍順.常見肌酐測定方法中存在的干擾[J].中華檢驗醫學雜志,2001,24(2):102-104.
[7]ZHI Q,KONG P Y,HU C M.Biochemical and molecular characterization of a novel high activity creatine amidinohydrolase fromArthrobacter nicotianaestrain 02181[J].Process Biochem,2009,44(4):460-465.
[8]趙更峰,馬曉航,賈小明,等.節桿菌肌酐水解酶的純化及特性研究[J].生物工程學報,2005,21(2):250-253
[9]羅侃,崔有宏.診斷用酶的研究進展[J].西北國防醫學雜志,2000,21(1):57-59.
[10]OGUSHIS,NAGAOK,EMIS,etal.SarcosineoxidasefromArthrobacter ureafaciens:Purification and some properties[J].Chem Pharm Bull, 1988,36(4):1445-1450.
[11]李載平.分子克隆實驗指南(第3版)[J].科學通報,2002,47(24):1888.
[12]東秀珠,蔡妙英.常見細菌系統鑒定手冊[M].北京:科學出版社,2001:43-65.
[13]YADAV S,DEVI R,BHAR P,et al.Immobilization of creatininase, creatinase and sarcosine oxidase on iron oxide nanoparticles/chitosang-polyaniline modified Pt electrode for detection of creatinine[J]. Enzyme Microb Tech,2012,50(4-5):247-254.
[14]SONG L,DAI J,ZHEN K,et al.Production of novel NaN3-resistant creatine amidinohydrolase in recombinantEscherichia coli[J].Bioengineered,2015,6(4):248-250.
[15]王強,李旭,竇少華,等.海洋葡甘聚糖酶菌株的分離鑒定及酶學性質研究[J].中國釀造,2016,35(6):65-69.
[16]趙更峰.一株產肌酐水解酶菌株的分離及酶特性研究[D].杭州:浙江大學,2003.
[17]UEDA M,GOTO T,NAKAZAWA M,et al.A novel cold-adapted cellulase complex fromEisenia foetida:characterization of a multienzyme complex with carboxymethylcellulase,β-glucosidase β-1,3 glucanase, and β-xylosidase[J].Comp Biochem Phys Part B:Biochem Mol Biol, 2010,157(1):26-32.
[18]CAVICCHIOLI R,CHARLTON T,ERTAN H,et al.Biotechnological usesofenzymesfrompsychrophiles[J].Microb Biotech,2011,4(4):49-60.
Screening and identification of creatininase-producing strain from marine and its enzymatic properties
SHI Qun1,2,ZHANG Qingfang1,2,YANG Lina1,2,WANG Xiaohui1,2,DOU Shaohua1,2,CHI Naiyu1,2*
(1.School of Life Science and Biotechnology,Dalian University,Dalian 116622,China; 2.Liaoning Marine Microbial Engineering and Technology Center,Dalian 116622,China)
A high creatininase-producing strain S-09 was screened from the Bohai Sea mud,and identified asExiguobacteriumsp.by morphology, physiological and biochemical characteristics and 16S rDNA phylogenetic analysis.The research of enzymatic properties of creatininase showed that the optimal temperature was 30℃,the thermostability was weaker;the optimal pH was 7.5,pH stability was better in alkaline condition;the activation of Co2+and Mn2+on creatininase was stronger,the Ag+and Hg2+had significant inhibitory effect on creatininase.
marine;creatininase;strain screening;identification;enzymatic characteristics
Q93
0254-5071(2017)03-0019-05
10.11882/j.issn.0254-5071.2017.03.005
2017-02-08
國家高技術研究發展計劃“863”計劃項目(2007AA021306);遼寧省自然科學基金(NO.2050775)
石群(1990-),女,碩士研究生,研究方向為微生物與酶工程。
*通訊作者:遲乃玉(1965-),男,教授,博士,研究方向為微生物與酶工程。

