7廠家51批雙氯芬酸鈉緩釋膠囊的質量分析
安佰平,柴龍龍(淄博市食品藥品檢驗檢測中心,山東 淄博 255086)
·藥品監督·
7廠家51批雙氯芬酸鈉緩釋膠囊的質量分析
安佰平*,柴龍龍(淄博市食品藥品檢驗檢測中心,山東 淄博 255086)
目的:考察2014年山東省評價性抽驗雙氯芬酸鈉緩釋膠囊的質量現狀,為提高產品質量的均一性和穩定性提供參考。方法:采用法定檢驗方法對7廠家(A、B、C、D、E、F、G)51批雙氯芬酸鈉緩釋膠囊的性狀、鑒別、裝量差異、釋放度、有關物質和含量測定等進行全項檢驗,并對檢驗結果進行統計分析;采用文獻方法對膠囊殼中鉻的含量及在不同pH溶出介質中主藥釋放曲線進行探索性研究(以A廠樣品為參比計算相似因子f2比較差異)。結果:檢品按照質量標準檢驗所有項目均合格,但是各廠家樣品質量有差異,如主藥含量范圍為92.4%~102.1%;探索性研究中鉻含量均低于限度要求,但各廠家間樣品含量及同廠家不同批間樣品含量差異均較大;與A廠家樣品比較,B~G廠家樣品的f2為37~86。結論:雙氯芬酸鈉緩釋膠囊總體質量較好,但仍需進一步加強質量研究和控制,建議提高釋放度的檢查方法提高標準。
雙氯芬酸鈉緩釋膠囊;質量分析;鉻含量;釋放曲線
雙氯芬酸鈉(Diclofenac sodium),又名雙氯滅痛,是第三代強效非甾體消炎鎮痛藥物。該藥自1974年瑞士Giba-Geigy公司首次上市后,相繼在美國、德國、英國和日本等國投產。該藥從1986年起一直為用量較大藥物之一[1]。雙氯芬酸鈉緩釋膠囊由雙氯芬酸鈉制成緩釋顆粒或微丸后填充膠囊而成,可以減少口服普通片在胃內迅速釋放、局部濃度過高而引起的不良反應[2],以及克服口服吸收迅速、生物半衰期較短致常需日服多次才能維持藥效[3]等問題,臨床上用于緩解類風濕性關節炎、骨關節炎等各種慢性關節炎的急性發作期或持續性的關節腫痛癥狀,應用廣泛。為有效監控藥品質量,保證用藥安全,并為臨床醫師合理選擇藥品提供依據,根據山東省食品藥品監督管理局要求,筆者所在單位于2014年承擔了雙氯芬酸鈉緩釋膠囊的全省評價性抽驗工作。為了全面評估該制劑的質量狀況,本文在常規檢驗的基礎上還進行了探索性研究工作,現將結果總結如下。
1 材料
1.1 儀器
RCZ-8M型溶出試驗儀、RZQ-8C型溶出儀自動取樣器(天津天大天發科技有限公司);CP225D型電子天平(德國賽多利斯公司);20AT型高效液相色譜(HPLC)儀(日本島津公司)。
1.2 藥品與試劑
雙氯芬酸鈉對照品(中國食品藥品檢定研究院,批號:100334-200302,純度:100%);不同廠家雙氯芬酸鈉緩釋膠囊共51批[其中雙氯芬酸鈉緩釋膠囊45批,6個廠家,規格:每粒50 mg;雙氯芬酸鈉緩釋膠囊(Ⅰ)6批,1個廠家,規格:每粒0.1 g];甲醇為色譜純,冰醋酸、磷酸二氫鉀、氫氧化鈉均為分析純。
2 方法與結果
2.1 抽樣概況
2.1.1 藥品劑型、規格和包裝材料 雙氯芬酸鈉緩釋膠囊分為緩釋膠囊(50 mg)和緩釋膠囊(Ⅰ)(0.1 g),所有樣品均為鋁塑泡罩包裝。
2.1.2 藥品的生產廠家與批準文號 截至2016年4月3日,國家食品藥品監督管理總局網站(www.sda.org.cn)藥品數據庫顯示,目前我國有7個廠家生產雙氯芬酸鈉緩釋膠囊,7個藥品批準文號;2個廠家生產雙氯芬酸鈉緩釋膠囊(Ⅰ),2個藥品批準文號;1個廠家生產雙氯芬酸鈉緩釋膠囊(Ⅲ),1個藥品批準文號(未收集到樣品)。
2.1.3 樣本來源 本次抽取樣品共51批次,其中雙氯芬酸鈉緩釋膠囊45批,涉及6個廠家(A廠,16批;B廠,1批;C廠,1批;D廠,15批;E廠,7批;F廠,5批),占全國該品種生產企業的100%;6個批準文號,占全國該品種批準文號的85.7%。雙氯芬酸鈉緩釋膠囊(Ⅰ)6批,涉及1個廠家(G廠,6批),占全國該品種生產廠家的50%,批準文號占全國該品種批準文號的50%。
本次抽樣覆蓋山東省17個地級市;從抽樣點看,市級44批、縣級4批、鄉級3批;從流通環節看,生產廠家0批、經營單位39批、使用單位12批,大部分集中在經營單位;在經營單位中,批發企業15批,零售連鎖店10批,零售藥店14批,比例比較均衡。因此,對所抽雙氯芬酸鈉緩釋膠囊進行全項檢驗和統計分析能較好地反映目前山東省內市售雙氯芬酸鈉緩釋膠囊的質量現狀。
2.2 檢驗方法
2010年版《中國藥典》(二部)僅收載雙氯芬酸鈉原料藥及雙氯芬酸鈉腸溶片的質量標準(藥品生產日期均在2015年12月之前,故本次檢驗方法執行2010年版《中國藥典》,僅探索性研究有參照2015年版《中國藥典》)。雙氯芬酸鈉緩釋膠囊現行質量標準均為國家標準,除一個廠家執行國家藥品標準[4],其他均執行國家藥品標準[5],雙氯芬酸鈉緩釋膠囊(Ⅰ)執行國家藥品標準[6]。比較各藥品標準發現,國家藥品標準[6]與國家藥品標準[5]僅在釋放度的限度上有區別,其他均相同。國家藥品標準[4]與其他標準區別較大,鑒別、有關物質檢查、含量測定的方法均不相同。
從考察藥品的使用安全性和有效性出發,在此次評價性抽驗中,除按藥品的各自現行有效的標準對樣品進行全部項目的規定檢驗外,筆者還參考《中國藥典》2010年版、2015年版和日本橙皮書[7]對抽驗樣品開展了一系列的探索性研究,如膠囊殼中鉻含量和主藥釋放曲線的研究。通過統計分析對產品質量、生產工藝和國內現行質量標準的合理性進行全面評價。
2.3 規定檢驗結果
本次共評價樣品51批,來自7個廠家,依據各自現行有效標準檢驗,全部項目均符合規定,合格率為100%。從不同抽樣點抽取同廠家同批號樣品9對(21批),這些樣品以抽自流通領域為多。對樣品的含量、有關物質的結果進行比較,結果基本一致,未發現明顯區別。對不同抽樣點抽取的同批次樣品的檢驗結果進行分析,發現不同抽樣點的檢測結果基本一致。
2.3.1 性狀 51批樣品,來自7個廠家,性狀均為白色或類白色的球形小丸。雙氯芬酸鈉緩釋膠囊(來自6個廠家)均為規則的白色小丸,無粉末。雙氯芬酸鈉緩釋膠囊(Ⅰ)為不規則小丸,有粉末附著在膠囊殼上。同一廠家不同批次之間性狀無明顯差別,提示保存條件等對性狀無影響,僅與生產工藝有關。
2.3.2 鑒別 51批樣品中只有1個廠家的15批樣品(執行國家藥品標準[4])采用紫外光譜、薄層色譜鑒別,其他均采用液相色譜鑒別。標準[4]規定,薄層色譜供試品溶液為50 mg/mL的乙醇溶液,即取1粒樣品的內容物研細溶于1 mL乙醇中,再進行過濾。筆者發現,由于該制劑中輔料很多,溶液很稠,很難過濾,若離心后取上清液再過濾,則較易操作,故建議更改質量標準相關內容。
2.3.3 裝量差異 雙氯芬酸鈉緩釋膠囊(45批)規格為50 mg,平均裝量在0.12~0.25 g;雙氯芬酸鈉緩釋膠囊(Ⅰ)(6批)規格為0.1 g,平均裝量約0.27 g。裝量的批內RSD在1%~3.6%,其中D廠裝量的批內RSD最大且波動也大,不同廠家裝量的批間RSD以D廠最大(2.96%)、E廠最小(0.89%)。這提示除少數廠家外,大部分廠家的生產工藝比較穩定。
2.3.4 釋放度 3個現行標準在釋放度上只有限度范圍不同,其他均相同,即溶出介質為pH 6.8的磷酸鹽緩沖溶液900 mL,方法采用釋放度測定法(2010年版《中國藥典》二部附錄ⅩD第一法),采用溶出度第一法裝置,以紫外-可見分光光度法在276 nm波長處測定吸光度,外標一點法計算釋放度。按現行標準檢驗,51批樣品均符合規定。
各批次之間釋放度均值的標準差(SD)可反映出該廠家各批次之間釋放度的波動情況,由統計得出,樣本量大于5的企業批間SD均小于4%,表明制劑處方工藝和生產工藝都得到了很好的控制。批內釋放度SD的均值可以反映同批次內藥品的釋放度的均一性,各企業批內SD的均值均小于4%,表明批內樣品均一性良好。
2.3.5 有關物質 3個現行質量標準中有關物質的限度相同,均為單個雜質不得過0.5%、雜質總量不得過1.0%。51批樣品中只有1批樣品單個雜質為0.288%,其他50批均小于0.2%;雜質總量只有1批樣品為0.397%,其他均小于0.3%,表明各廠家總體質量較好。在2個國家藥品標準中均要求鄰苯二甲酸二乙酯峰不計為雜質,但各廠家樣品中鄰苯二甲酸二乙酯含量有顯著差異,最大能達到1%。希望能進一步探討是否控制鄰苯二甲酸二乙酯含量的問題。
2.3.6 含量測定 從含量測定結果看,51批樣品含量最大值為102.1%,最小值為92.4%。有96.1%的樣品含量在93%~103%,基本符合要求。
除去2個抽驗量為1批的廠家未統計,經分析,部分廠家可能存在投樣低的問題,如F廠,平均值低于95%。G廠含量極差最小,且6批樣品的含量均在100.0%附近,提示其投料和工藝均較穩定;A廠含量極差最大,個別樣品含量在95%以下,可能在投料和工藝上存在一定的不穩定性。
2.4 探索性研究結果
2.4.1 膠囊殼中鉻的含量 近年來,“毒膠囊”“皮革膠囊”事件頻發,“鉻超標膠囊”事件引起社會強烈關注。故對膠囊殼鉻含量的檢測,可以綜合評價各廠家藥品的質量。檢測方法:膠囊中樣品傾盡,擦拭干凈,參照《中國藥典》明膠空心膠囊鉻的檢測方法[8-9],取膠囊殼0.5 g,微波消解,石墨爐原子分光光度法測定。經檢測,各廠家膠囊殼中鉻的含量均低于《中國藥典》關于明膠空心膠囊標準中鉻的限度要求(含鉻應不得過百萬分之二),但各廠家之間膠囊殼鉻的含量有明顯差別,同一廠家不同批次之間也有很大差別,個別廠家上半年與下半年樣品膠囊殼中鉻的含量差近10倍,提示廠家采購的膠囊殼質量不穩定。希望廠家在采購膠囊殼時能進一步考察其質量,保證臨床用藥安全。
2.4.2 釋放曲線 溶出度試驗是評價口服固體制劑內在質量的一種科學手段和方法。對于不同廠家的同一劑型固體制劑,溶出度的深入全面研究以及多種介質下溶出曲線的精確客觀繪制,可以揭示各制劑工藝的差別和內在品質的優劣,也可初步為體內生物利用度的高低、是否生物等效提供參考[10]。在現行標準中的釋放度項目只采用一種釋放介質,僅取3個點,不能很好地反映整個釋放過程,也不能反映不同廠家產品的釋放差異。故選擇多點多釋放介質的釋放曲線方法很有必要。
(1)方法的選擇。根據《藥品評價抽驗質量分析指導原則》[11]及《普通口服固體制劑溶出曲線測定與比較指導原則(征求意見稿)》,參照日本橙皮書[7]及樣品在釋放介質中的穩定性,確定4種釋放介質即水、0.1 mol/L的鹽酸溶液、pH 5.0磷酸鹽緩沖溶液、pH 6.8磷酸鹽緩沖溶液。根據現行質量標準[5],選擇籃法,釋放介質900 mL、100 r/min為釋放條件,取樣時間設為0.5、1、2、3、4、5、6、8、10、12、14 h。測定方法選擇國家藥品標準[5]中含量測定方法,HPLC法測定。
(2)結果分析。①pH 6.8磷酸鹽緩沖溶液條件下廠家內部各批次之間釋放曲線比較。選用現行標準釋放介質(pH 6.8磷酸鹽緩沖溶液),對抽樣量大于1批的廠家的樣品各隨機取樣4批進行釋放曲線測定,結果廠家內各批次間釋放曲線基本一致,各批次間各取樣點累積釋放量平均值批間SD均小于5%,提示各廠家制備及生產工藝較穩定,樣品質量較好。②不同釋放介質條件下各廠家間產品釋放曲線比較。將最早在國內生產雙氯芬酸鈉緩釋膠囊(50 mg)的A廠的樣品作為參比制劑,其他各廠家選取1批樣品進行比較。由于雙氯芬酸鈉在0.1 mol/L的鹽酸溶液中降解嚴重,且考慮到緩釋制劑在胃液中2 h排空,所以未進行以0.1 mol/L的鹽酸溶液為介質的釋放曲線比較。
不同廠家樣品在不同介質中的釋放曲線見圖1。
采用美國FDA發布的《口服固體制劑溶出度試驗技術指導原則》中推薦使用的相似因子(f2)法,比較參比制劑和國內其他廠家制劑的溶出行為。當f2大于50時,認為受試制劑與參比制劑溶出過程一致[12-13]。各受試制劑與參比制劑雙氯芬酸鈉緩釋膠囊釋放曲線的f2值測定結果見表1。
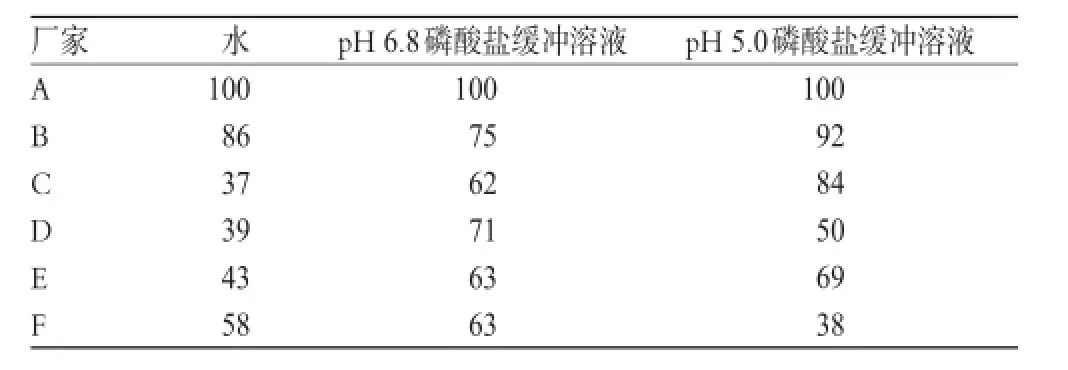
表1 不同廠家樣品在3種介質中的f2值Tab 1 f2value of samples from different manufacturers in 3 mediums
表1結果提示,各廠家樣品的內在品質尚存在較大差距。盡管釋放曲線相似并不意味著兩者一定具有生物等效性,但可用于判斷兩者用藥后的臨床差異。
3 討論
藥品評價性抽驗指的是藥品監督管理部門為了掌握、了解轄區內藥品質量的總體水平與狀態而進行的抽查檢驗工作。筆者通過研究發現,雖然各廠家的樣品“釋放度”檢查均符合要求,但是釋放曲線有明顯差異,個別廠家釋放曲線不理想,建議增加取樣點和嚴格控制取樣時點的釋放量,以更好地控制緩釋效果。筆者還發現個別廠家平均含量有明顯偏低的情況,有可能是低限投料所致。筆者還認為標準[4]中“鑒別”項下的藥品前處理方法不太適用,建議更改為“8 000 r/min離心后再取上清液,過濾”。
綜合常規檢驗和探索性研究結果,筆者認為,在規定的有效期內,不同抽樣地點、抽樣區域、抽樣級別、被抽樣單位性質等對藥品質量無顯著影響,本品合格率高,總體結果滿意。本品種質量標準項目設置較為合理,檢測方法較可靠,可控制藥品質量,但對釋放度的檢查方法應更加嚴格,以提高產品質量的均一性。另外,企業需深入研究原料藥輔料及膠囊殼的質量和工藝流程,以提高產品質量的均一性和穩定性。
[1] 秦丙昌,陳靜,廖新成,等.雙氯芬酸鈉合成工藝研究[J].應用化工,2008,37(3):275-278.
[2] 金奕,程宗琦.雙氯芬酸鈉片劑與膠囊劑的體外溶出度分析[J].蘇州大學學報(醫學版),2006,26(6):1101-1102.
[3] 林寧,肖學成,饒澤萍,等.雙氯芬酸鈉緩釋膠囊的制備及其釋藥特性研究[J].華西藥學雜志,2002,17(2):118-119.
[4] 國家食品藥品監督管理局.雙氯芬酸鈉緩釋膠囊YBH-01852010[S].2010-05-07.
[5] 國家食品藥品監督管理局.雙氯芬酸鈉緩釋膠囊WS1-(X-002)-2002Z-2011[S].2011-10-08.
[6] 國家食品藥品監督管理局.雙氯芬酸鈉緩釋膠囊(Ⅰ)WS1-(X-080)-2006Z-2011[S].2011-10-08.
[7] 國家食品藥品監督管理局藥品審評中心.雙氯芬酸鈉[EB/OL].[2016-04-01].http://www.cde.org.cn/recommend.do?method=view&id=480.
[8] 國家藥典委員會.中華人民共和國藥典:二部[S].2010年版.北京:中國醫藥科技出版社,2010:1204-1206.
[9] 國家藥典委員會.中華人民共和國藥典:四部[S].2015年版.北京:中國醫藥科技出版社,2015:522-523.
[10] 楊曉菊,謝沐風.不同廠家格列美脲片溶出度的比較[J].中國醫藥工業雜志,2008,39(10):758-761.
[11] 國家食品藥品監督管理局.藥品評價抽驗質量分析指導原則[S].2009.
[12] 謝沐風.溶出曲線相似性的評價方法[J].中國醫藥工業雜志,2009,40(4):308-311.
[13] 陳艷君,胡容峰,朱雙雙,等.f2法與AV值法評價國內不同廠家格列齊特緩釋片與原研制劑的體外釋放曲線的相似性[J].中國藥房,2016,27(9):1230-1233.
(編輯:劉萍)
Quality Analysis of 51 Batches of Diclofenac Sodium Sustained-release Capsules from 7 Manufacturers
AN Baiping,CHAI Longlong(Zibo Institute for Food and Drug Control,Shandong Zibo 255086,China)
OBJECTIVE:To investigate the quality of Diclofenac sodium sustained-release capsules testing in Shandong province in 2014,to provide the reference for improving the homogeneity and stability of product quality.METHODS:51 batches of Diclofenac sodium sustained-release capsules from 7 manufacturers(A,B,C,D,E,F,G)were tested by statutory inspection test in respects of property,identification,content uniformity,release rate,related substance,content determination,etc.The inspection results were analyzed statistically.The content of chromium in capsule shell and release curve of diclofenac sodium in dissolution mediums with different pH were explored and tested by literature method(compared by similarity factor f2with sample from A). RESULTS:All items of samples were in line with the quality standard,but there was difference in the quality of samples among different manufacturers,such as the content ranged 92.4%-102.1%.In exploration test,the content of chromium was lower than the limit requirement,but the content of diclofenac sodium had great difference among different manufacturers and different batches.Compared with the sample from A manufacture,the f2from B,C,D,E,F,G manufactures ranged 37-86.CONCLUSIONS:Diclofenac sodium sustained-release capsules are superior in quality.But it is still suggested to strengthen quality study and control,and raise the standard for release rate test.
Diclofenac sodium sustained-release capsules;Quality analysis;Chromium content;Release curve
R927
A
1001-0408(2017)04-0540-04
2016-04-11
2016-06-27)
*主管藥師。研究方向:藥物分析。電話:0533-7866116。E-mail:baiping2011an@163.com
DOI10.6039/j.issn.1001-0408.2017.04.30

