小鼠腦血流量自動調節范圍觀察
林婉蓉,高慶春,李學龍
( 廣州醫科大學附屬第二醫院,廣州510260)
小鼠腦血流量自動調節范圍觀察
林婉蓉,高慶春,李學龍
( 廣州醫科大學附屬第二醫院,廣州510260)
目的明確小鼠腦血流自動調節的范圍。方法以左頸動脈插管測定的動脈血壓為標準,建立小鼠股動脈插管監測動脈血壓的動物模型。在腦血流量測定組模型中通過放血及尾靜脈泵入去甲腎上腺素的方式逐步分級升高和降低其動脈血壓,以10~15 mmHg為一個梯度,同時采用激光多普勒監測模型大腦中動脈區域腦血流量。結果小鼠股動脈插管與左頸動脈插管監測的收縮壓、舒張壓和平均動脈相近(P均gt;0.05),但脈壓差異較大(Plt;0.05)。腦血流量測定組模型平均動脈壓在-30~+30 mmHg(即平均動脈壓降低或升高30 mmHg)變化時,其腦血流量無明顯改變(P均gt;0.05);超過該范圍后,腦血流量隨動脈血壓升高而升高(P均lt;0.05),隨動脈血壓下降而下降(P均lt;0.05)。結論小鼠腦血流自動調節范圍為平均動脈壓-30~+30 mmHg,超出此范圍后,腦血流量隨著血壓的改變而明顯改變。
腦血流;腦血流自動調節;腦血流自動調節范圍;頸動脈測壓法;股動脈測壓法
腦血流自動調節(CA)是指動脈血壓改變時腦血流維持穩定的復雜過程[1]。CA功能狀態與某些腦血管疾病的發生、發展以及治療密切相關,如頸動脈狹窄[2]、腦梗死[3]、腦出血[4]、蛛網膜下腔出血[5]及煙霧病[6]等。但到目前為止,依據傳統CA學說尚無法建立臨床實用的無創評價方法,且越來越多證據表明傳統CA學說也存在不足和爭議。關于CA機制研究的動物模型,目前多采用大鼠[7]等體型較大的動物,尚未見有小鼠CA模型的報道。小鼠不僅價格便宜,利于進行基因工程研究[8, 9],關鍵是可以采用雙光子顯微鏡觀察其腦皮層內血管和血流動力學,對深入觀察腦實質內血管和血流動力學在血壓改變過程中的變化,突破僅觀察軟腦膜血管的瓶頸,建立CA機制研究的新平臺,具有重要意義。2016年3月16日~9月15日,我們以左頸動脈插管測定的動脈血壓為標準,建立小鼠股動脈插管監測動脈血壓的動物模型,成功觀察了小鼠的CA范圍。現將結果報告如下。
1 材料與方法
1.1 實驗動物 成年Swiss小鼠33只,體質量30~35 g,購自中山醫科大學實驗動物研究中心。小鼠飼養在溫度為25 ℃、相對濕度為65%、12 h光照/暗循環的SPF級環境中。 所有小鼠在手術前禁食過夜,不禁水。 在手術和血壓監測過程中,小鼠的直腸溫度保持在37 ℃左右。實驗分兩部分:第一部分采用10只成年Swiss小鼠,同時進行左側頸動脈及右側股動脈插管監測血壓。第二部分采用23只Swiss小鼠,隨機分為升壓組及降壓組,在改變血壓的同時監測其腦血流量。 所有實驗方案經中山大學動物倫理與福利委員會批準。 所有實驗程序按照《國家實驗動物護理和使用指南》(NIH出版物,第80-23號,1996年修訂)進行。
1.2 小鼠頸動脈、股動脈插管及血壓監測 10只Swiss小鼠(聯合測壓組)用1%戊巴比妥鈉腹腔麻醉后呈仰臥位置于鋪有恒溫電熱毯的手術臺上。根據先前研究所采用的方法[10]分離出小鼠左頸總動脈(分離過程中不能傷及頸動脈分支及與頸動脈相鄰的迷走神經,以免影響血壓測量結果);完成左側頸動脈插管后,通過三通管連接壓力傳感器監測小鼠動脈血壓。同時暴露分離小鼠右側股動脈1 cm,將其遠端結扎,近端用絲線暫時阻斷血流,將一根絲線置于分離的股動脈下方備用;用眼科剪在分離的股動脈中間靠近端剪出一個V形小口,將管徑約0.20 mm的導管插入股動脈中并固定,將導管末端通過三通管的一端連接1 mL注射器,回抽確認導管通暢后,將導管與傳感器連接監測血壓。
1.3 小鼠血壓改變及腦血流監測 將23只Swiss小鼠隨機分為升壓組及降壓組。降壓組小鼠兩側股動脈均插管(方法同上),一側用于動態監測動脈血壓,另一側連接1 mL的注射器用于放血制做梯度降壓模型,每次放血約0.05 mL。升壓組小鼠在右側股動脈插管以監測動脈血壓,同時尾靜脈置一新生兒頭皮針,連接1 mL的注射器于靜脈泵上,將10%的去甲腎上腺素以0.08~1.0 μg/(kg·min )泵入。兩組小鼠血壓的改變以10~15 mmHg為一個梯度,血壓改變維持2~3 min再開始測量腦血流量。采用激光多普勒(LDF)監測兩組小鼠右側大腦中動脈區域的血流,收集數據,單位為PU(灌注單位)[11]。
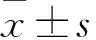
2 結果
聯合測壓組,右股動脈插管監測到的收縮壓、舒張壓、平均動脈壓、脈壓分別為(105.04± 14.13)、(74.70 ±12.80)、(84.74 ±12.94)、(31.45± 2.18)mmHg,左頸動脈插管監測到的收縮壓、舒張壓、平均動脈壓、脈壓分別為(103.77±15.95)、(75.94± 14.42)、(85.22 ±14.73)、(28.94± 2.41)mmHg。 右股動脈插管及左頸動脈插管檢測到的收縮壓、舒張壓、平均動脈壓相比,P均gt; 0.05,但右股動脈插管及左頸動脈插管檢測到的脈壓相比,Plt;0.05。右股動脈插管與左頸動脈插管所測的收縮壓、舒張壓、平均動脈壓、脈壓都有較高的相關性(r分別為0.943、0.956、0.952、0.613,P均lt;0.05),且一致性很高[差異平均值分別為-0.5 mmHg(95%CI為9.3~11.8 mmHg)、1.0 mmHg(95%CI為9.7~ 7.3mmHg)、0.5 mmHg(95%CI為9.5~8.6 mmHg)、-1.5 mmHg(95%CI為1.5~6.5 mmHg)]。
在升壓組中,小鼠基礎腦血流量為270.27(337.7,248.63)PU,當小鼠平均動脈壓升高值為10~15 mmHg、15~30 mmHg、30~45 mmHg、45~60 mmHg、60~75 mmHg時,其腦血流量分別為278.51(341.87,250.03)、288.73(348.04,251.9)、316.83(400.15,291.97)、346.62(420.65,313.67)、376.32(446.81,320.54)PU,腦血流量增加的變化率分別為3.04%、6.82%、17.23%、33.80%、39.24%;平均動脈壓升高值為10~15 mmHg和15~30 mmHg時,升壓組小鼠腦血流量與基礎腦血流量相比,P均gt;0.05;平均動脈壓升高值為30~45 mmHg、45~60 mmHg、60~75 mmHg時,升壓組小鼠腦血流量依次明顯升高,與基礎腦血流量相比,P均lt;0.05。可以看出,在動脈血壓升高過程中,平均動脈壓升高值小于30 mmHg時,小鼠腦血流量的變化不大,相對穩定,平均動脈壓升高值超過30mmHg時,小鼠腦血流量明顯增加。
在降壓組中,小鼠基礎腦血流量為218.85(300.43,144.0)PU,當小鼠平均動脈壓降低值為10~15 mmHg、15~30 mmHg、30~45 mmHg、45~60 mmHg、60~75 mmHg時,其腦血流量分別為207.98(290.47,135.78)、204.15(282.37,131.93)、185.33(238.67,110.77)、135.27(188.57,80.43)、109.84(124.54,50.7)PU,腦血流量降低的變化率分別為4.97%、6.72%、15.32%、38.19%、49.82%;平均動脈壓降低值為10~15 mmHg、15~30 mmHg時,降壓組小鼠腦血流量與基礎腦血流量相比,P均gt;0.05;平均動脈壓降低值為30~45 mmHg、45~60 mmHg、60~75 mmHg時,降壓組小鼠腦血流量依次明顯降低,與基礎腦血流量相比,P均lt;0.05。可以看出,在動脈血壓降低過程中,平均動脈壓降低值小于30 mmHg時,小鼠腦血流量的變化不大,相對穩定,平均動脈壓降低值超過30 mmHg時,小鼠腦血流量明顯下降。
根據GAO的方法[12],可以確定正常小鼠在麻醉狀態下,其CA下限和上限分別為基礎平均動脈壓降低和升高30 mmHg,即小鼠CA范圍為基礎平均動脈壓上下30 mmHg。
3 討論
CA是指血壓改變時,腦實質血管通過各種機制維持腦血流量恒定,保持大腦功能正常的過程。CA機制學說較多,但卻無定論。經典的CA學說認為,血壓改變時,腦血管通過改變自身血管管徑而改變腦血管阻力以維持腦血流的穩定[13]。但有研究[14, 15]表明,在CA過程中,血管的張力即臨界關閉壓的改變維持了腦血流量的恒定。CA功能機制復雜,與各類腦血管疾病的發生發展息息相關,因此明確CA的機制十分重要。由于實驗技術條件的限制,以往的研究大部分是在大鼠的身上完成,且只能觀察到大鼠腦表面的血管,導致腦實質內血管管徑在CA過程中的具體變化依然不明確。隨著雙光子共聚焦顯微鏡技術的發展,觀察腦實質內血管管徑的變化成為可能。目前,小鼠是雙光子研究的主要使用動物,明確小鼠CA范圍是CA研究的第一步。CA上下限的測定方法主要有三種,第一種為雙盲人工目測CA曲線法[16],第二種為血流量改變10%[12]或7%[7]處的血壓值法,第三種為比較不同血壓值的腦血流量是否有統計學差異的方法。本研究采用第二種方法,觀察在血壓變化的過程中小鼠腦血流量的改變。本研究是通過小鼠股動脈插管監測并改變血壓,同時通過LDF觀察小鼠右側大腦中動脈局部腦血流量的變化,以確定相應的CA范圍。
小鼠動脈血壓的監測方法經常采用置入液體導管法,亦稱插管法,一端連接壓力傳感器,液體填充導管的另一端必須置入動脈內,如頸動脈和股動脈。大鼠CA的動物模型中所采用的是股動脈插管監測血壓。由于小鼠體型較小,頸動脈插管測壓法成為小鼠有創動態監測血壓的最常用方法。但在本研究中,若行小鼠頸動脈插管必然會引起大腦血液供應發生變化,從而導致相應的腦血流動力學參數變化。為了能有效且準確監測動脈血壓,我們以頸動脈插管測壓法為標準,建立了較少用的小鼠股動脈插管測壓法。同一只小鼠的左頸動脈與右股動脈插管測壓結果顯示,其收縮壓、舒張壓、平均動脈壓差異無統計學意義;但右股動脈插管測壓法所測的脈壓高于左頸動脈插管法所測的脈壓,這個結果可以通過正常的生理機制來解釋:在正常的生理條件下,離心臟越遠的位置,機體動脈脈壓越大[17, 18],與頸動脈相比,股動脈與心臟相距遠,因此股動脈的脈壓會更高。此結果更進一步證實了股動脈測壓法的準確性。而且,相關性分析及Bland-Altman分析結果顯示,左頸動脈及右股動脈插管法所測的收縮壓、舒張壓、平均動脈壓、脈壓的一致性十分高,說明股動脈插管測壓法與頸動脈插管測壓法測得的結果都十分準確可靠。
本研究結果表明,當平均動脈壓升高或降低在30 mmHg以內時,小鼠腦血流量穩定,腦血流的變化率小于10%。這個結果與其他關于大鼠和豬的研究結果一致[19, 20]。當平均動脈壓升高超過30 mmHg時,小鼠腦血流量隨著血壓的升高明顯升高;當平均動脈壓下降超過30 mmHg時,其腦血流量隨著血壓的下降明顯減少。平均動脈壓的改變超過30 mmHg時,小鼠腦血流的變化率超過10%。這一結果表明,小鼠CA范圍為基礎平均動脈壓上下30 mmHg。明確小鼠的范圍,對進一步研究CA機制具有重要意義。
[1] Armstead WM. Cerebral blood flow autoregulation and dysautoregulation [J]. Anesthesiol Clin, 2016,34(3):465-477.
[2] Fisch L, Brown MM. Management of carotid near-occlusion and acute carotid occlusion [J]. J Cardiovasc Surg (Torino), 2016,57(2):145-151.
[3] Guo ZN, Liu J, Xing Y, et al. Dynamic cerebral autoregulation is heterogeneous in different subtypes of acute ischemic stroke [J]. PLoS One, 2014,9(3):93213.
[4] Oeinck M, Neunhoeffer F, Buttler KJ, et al. Dynamic cerebral autoregulation in acute intracerebral hemorrhage [J]. Stroke, 2013,44(10):2722-2728.
[5] Budohoski KP, Czosnyka M, Smielewski P, et al. Impairment of cerebral autoregulation predicts delayed cerebral ischemia after subarachnoid hemorrhage: a prospective observational study [J]. Stroke, 2012,43(12):3230-3237.
[6] Chen J, LIU J, Duan L, et al. Impaired dynamic cerebral autoregulation in moyamoya disease [J]. CNS Neurosci Ther, 2013,19(8):638-640.
[7] 王文君,高慶春,李現亮,等.腦血流自動調節范圍內維持腦血流恒定的因素[J].中國神經精神疾病雜志,2016,42(1):34-38.
[8] Desjardins F, Lobysheva I, Pelat M, et al. Control of blood pressure variability in caveolin-1-deficient mice: role of nitric oxide identified in vivo through spectral analysis [J]. Cardiovasc Res, 2008,79(3):527-536.
[9] LI S, Wang K, Xu G, et al. The intervention effect of zinc supplementation on irbesartan treatment for atherosclerosis of ApoE-/- mice [J]. Pak J Pharm Sci, 2016,29(6):1907-1912.
[10] Zhao X, Ho D, Gao S, et al. Arterial Pressure Monitoring in Mice [J]. Curr Protoc Mouse Biol, 2011,1(1):5-22.
[11] Taninishi H, Jung JY, Izutsu M, et al. A blinded randomized assessment of laser Doppler flowmetry efficacy in standardizing outcome from intraluminal filament MCAO in the rat [J]. J Neurosci Methods, 2015,241(1):11-20.
[12] Gao E, Young WL, Pile-Spellman J, et al. Mathematical considerations for modeling cerebral blood flow autoregulation to systemic arterial pressure [J]. Am J Physiol, 1998,274(3 Pt 2):1023-1031.
[13] Tzeng YC, Macrae BA, Ainslie PN, et al. Fundamental relationships between blood pressure and cerebral blood flow in humans [J]. J Appl Physiol, 2014,117(9):1037-1048.
[14] Robertson AD, Edgell H, Hughson RL. Assessing cerebrovascular autoregulation from critical closing pressure and resistance area product during upright posture in aging and hypertension [J]. Am J Physiol Heart Circ Physiol, 2014,307(2):124-133.
[15] Rhee CJ, Fraser CD, Kibler K, et al. Ontogeny of cerebrovascular critical closing pressure [J]. Pediatr Res, 2015,78(1):71-75.
[16] Jones SC, Radinsky CR, Furlan AJ, et al. Cortical NOS inhibition raises the lower limit of cerebral blood flow-arterial pressure autoregulation [J]. Am J Physiol, 1999,276(4 ):1253-1262.
[17] Mcdonald DA, Nichols WW. Left ventricular output derived from the time-derivative and phase velocities of the aortic pressure wave [J]. Med Biol Eng, 1973,11(6):678-690.
[18] Nichols WW, Mcdonald DA. Wave-velocity in the proximal aorta [J]. Med Biol Eng, 1972,10(3):327-335.
[19] 王文君,高慶春,李現亮,等.臨界關閉壓對于正常大鼠腦血流自動調節的作用[J].中國卒中雜志,2016,11(1):349-355.
[20] Pesek M, Kibler K, Easley RB, et al. The upper limit of cerebral blood flow autoregulation is decreased with elevations in intracranial pressure [J]. Neurosurgery, 2014,75(2):163-170.
10.3969/j.issn.1002-266X.2017.43.010
R743
A
1002-266X(2017)43-0032-03
國家自然科學基金資助項目(831371573 )。
高慶春(E-mail: qcgao@263.net)
2017-05-11)

