三唑磷農藥降解酶的定位及酶學性質研究
湯鳴強,陳淑賢
(福建師范大學福清分校海洋與生化工程學院,福建 福清 350300)
三唑磷農藥降解酶的定位及酶學性質研究
湯鳴強,陳淑賢
(福建師范大學福清分校海洋與生化工程學院,福建 福清 350300)
采用超聲波破碎法破碎三唑磷農藥降解菌芽孢桿菌TAP-1,研究不同細胞組分對三唑磷農藥的降解率,應用液相色譜法研究三唑磷農藥降解酶的酶學性質。結果表明,胞外酶、胞間粗酶液和胞內酶對三唑磷的降解率分別為2.8(±0.34)%、12.8(±2.44)%和84.4(±6.71)%。菌株TAP-1降解三唑磷農藥的主要活性物質位于降解菌細胞內,屬于胞內酶組分。該酶最適作用pH值為6.5~7.0,在pH 5.0~7.5之間,酶活力均能保持在最高酶活力的68%以上。最適反應溫度為30℃,在25~40℃溫度范圍內能保持75%以上的降解活性。不同化學試劑和金屬離子對酶活性產生不同的影響。巰基修飾劑、EDTA、Hg2+和Mn2+對酶活性有抑制作用。Mg2+、Co2+和Fe3+對酶活性有促進作用。該降解酶米氏常數(Km)為23.02 μmol/L,最大反應速度(Vmax)為 0.738 μmol/mg·min。
三唑磷降解菌TAP-1;降解酶;酶定位;酶學特性
三唑磷(Triazophos,TAP)是1971年由原西德Farbwerke Hoechs公司開發出來的高效、中毒、廣譜的有機磷類殺蟲殺螨劑,對糧、棉、果、蔬菜等主要農作物上的許多重要害蟲如螟蟲、稻飛虱、蚜蟲、紅蜘蛛、棉鈴蟲、菜青蟲和線蟲等有良好的防治效果。研究發現,與傳統有機磷農藥相比,三唑磷表現為對水稻植株有很強的滲透性、對害蟲有較高的胃毒活性和殺卵能力等特點[1],因此,對常見的水稻危害害蟲如二化螟和三化螟有較強的觸殺活力,從而被大量應用于水稻害蟲的防治,目前已成為長江流域防治水稻螟蟲的主打藥品[2]。我國于20世紀80年代中后期引入三唑磷農藥。近年來,隨著甲胺磷等5種高毒有機磷農藥被禁止生產與流通,三唑磷等農藥的需求量呈現上升的趨勢。目前,我國已成為三唑磷農藥生產、使用及出口大國。
然而,隨著這類農藥的大量使用,其對生態環境與人類健康的負面影響不容忽視。已有文獻報道,三唑磷對蜜蜂和多數魚類高毒,對土壤微生物生態等也造成了一定的危害[3]。高濃度的三唑磷還可能具有較強的誘變效應。近年來,我國部分養殖海域采用三唑磷作為清埕殺菌和消除蟲害的常用農藥,直接導致了它通過地表徑流進入水體,從而對海洋生態系統造成威脅。此外,三唑磷在水稻害蟲防治上的大量使用也導致了稻米中三唑磷殘留量的增加。還有研究發現,三唑磷進入水體環境后,由于藻類的累積作用,可通過食物鏈轉移到上一個營養級,對水生生態系統和人類健康有更大的風險[4]。
微生物是生物修復的重要資源,利用微生物及其產生的降解酶處理環境中有機磷農藥的方法,已顯示出良好的應用前景,是近年來研究有機磷農藥降解的主要發展方向[5]。大多數微生物降解農藥的反應屬于酶促反應,降解酶的農藥處理技術具有成本低、效果好、無二次污染、不會受到土著微生物排斥等特點,已被用于殺蟲劑和除草劑的處理[6-7]。目前在農藥酶降解領域研究比較廣泛的是菊酯類農藥、三氮苯類農藥和有機磷類農藥等[8-10]。盡管國內外學者從不同環境中分離到許多有機磷農藥的降解菌,但是,有關三唑磷農藥微生物降解的研究還少見報道。國內外已分離的三唑磷降解菌主要有蒼白桿菌(Ochrobactrum sp.)和伯雷克氏菌(Klebsiella sp.)等[1,11],主要研究了這些菌株的降解特性及降解途徑等,鮮見對三唑磷降解酶的研究。
本課題從福建建甌福農生化有限公司污水處理池活性污泥及其出水口污泥中,通過富集培養基和基礎培養基馴化培養分離到5株對三唑磷農藥有較高降解率的細菌菌株,采用生理生化實驗結合16S rDNA序列比對的方法將降解率最高的菌株鑒定為芽孢桿菌TAP-1(Bacillus sp. TAP-1),通過室內搖瓶發酵法確定菌株的生長與降解特性(另文發表)。本試驗采用液相色譜技術,分析TAP-1菌株三唑磷降解酶成分在細胞中的位置,并研究降解酶的酶學性質,為降解酶的實際應用奠定基礎,也為有機磷農藥污染的生物治理提供理論參考和技術支持。
1 材料與方法
1.1 試驗材料
供試菌株:芽孢桿菌TAP-1 (Bacillus sp. TAP-1),在Genbank上的注冊登錄號為HQ156466。
主要試劑:三唑磷(Triazophos,純度>98%)購自上海市農藥研究所。甲醇(色譜純)購自德國Merck公司。種子液培養基:胰蛋白胨5.0 g,酵母膏5.0 g,KH2PO41.0 g,去離子水1L,pH 7.0。發酵培養基:牛肉浸膏3.0 g,胰蛋白胨10.0 g,NaCl 5.0 g,葡萄糖5.0 g,去離子水1 L,pH 7.0~7.2。
主要儀器:L-2000日立高效液相色譜儀,配有L-2400紫外檢測器,L-2130 蠕動泵;色譜柱:Apollo-C8 (250×4.6 mm,i.d.,5μm);DHG-9070A型電熱恒溫鼓風干燥箱:上海一恒科技有限公司;THZ-C-1臺式冷凍恒溫振蕩器:太倉市試驗設備廠;UV-9100紫外分光光度計:北京瑞利分析儀器公司;SCIENTE-IID超聲波細胞粉碎機:寧波新芝生物科技股份有限公司;105810R冷凍離心機:德國Eppendorf公司;ALPHAI-2冷凍干燥機:北京博醫康實驗儀器有限公司。
1.2 降解菌的培養與降解酶的提取
取活化的TAP-1菌株于100 mL種子液培養基中,32℃、180 r/min培養16 h,15℃,8 000 r/min離心5 min,收集菌體,用pH 7.5、0.2 mmol/L Tris-HCl洗滌3次,用滅菌的雙蒸水重懸菌體,調整OD600≈2.0,按2%的接種量(V/ V)轉接到100 mL液體發酵培養基中,32℃、180 r/min培養72 h。
經培養的菌液離心后用pH 7.5、20 mmol/L Tris-HCl洗滌3次,按照菌體:緩沖液=1∶4的比例將菌體懸浮于pH 7.5、20 mmol/L Tris-HCl緩沖液中,混合均勻后置于冰浴中用超聲波處理15 min,功率為280 W,頻率為破碎4 s,間隔9 s,4℃、11 000 r/min離心10 min,除去細胞碎片得降解酶粗酶液。
1.3 酶活性測定
在860 μL pH 7.2、20 mmol /L Tris-HCl緩沖溶液中加入50 μL 500 mg/L三唑磷標準溶液,37℃水浴預熱10 min,加入50 μL預熱的粗酶液,100 r/min水浴反應1 h,用40 μL 6 mol/L HCl終止反應,每處理重復3次,以50 μL 上述緩沖液代替酶液為對照,計算降解酶活力。酶活力單位定義為:在37℃,pH 7.2條件下,每分鐘降解1 μmol三唑磷的酶用量定義為一個酶活力單位(U)。
1.4 酶學性質的測定
在不同溫度、pH及不同化學物質下檢測酶對三唑磷的降解效率,獲得降解酶的最適反應溫度、最適作用pH及金屬離子化學物質對酶活性的影響。取三唑磷溶液(濃度為20 mg/L)于離心管中,在不同溫度(分別為20、25、30、35、40、45和50℃)、pH (5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5)、金屬離子(Fe3+、Zn2+、Hg2+、Co2+、Mg2+、Mn2+)及化學試劑(十二烷基硫酸鈉、巰基乙醇、吲哚乙酸、二硫赤蘚糖醇、乙二胺四乙酸、特里通、谷胱甘肽、碘乙酸、對氯高汞苯甲酸、N-乙基馬來酰亞胺)下進行酶促反應,分別測定酶活力,以最高酶活力為100%,其他條件下的酶活力與之相比得各自相對酶活力。
將酶液在pH 7.2、20 mmol/L Tris-HCl緩沖液中,于-20、4、20、30、40、50和60℃條件下處理1 h,測定剩余酶活力。將菌體分別懸浮在pH為5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、 9.5、10.0、10.5和11.0的緩沖液(pH 5.0~6.5用40 mmol/L Na2HPO4-0.1mol/L檸檬酸緩沖液,pH 7.0~8.5用20 mmol/L Tris-HCl緩沖液,pH 9.0~11.0用40 mmol/L 甘氨酸-NaOH緩沖液)中,于超聲波破碎后得到的粗酶液32℃保溫1 h后,分別測定其在pH 7.2、32℃下的剩余酶活力。最適條件下酶活力定義為100%,推算出其他條件下的相對酶活力,研究三唑磷降解酶對溫度的耐受性和pH穩定性。
將不同濃度三唑磷(200、250、300、350、450 和500 mg/L)作底物,加入到pH 7.2、20 mmol/L的Tris-HCl緩沖液體系中,32℃下反應測定酶反應速度,運用Lineweaver-Burk作圖法求米氏常數(Km)和最大反應速度(Vmax)。
1.5 蛋白質濃度的測定
粗酶液的蛋白含量按Bradford法測定[12],以BSA作為標準蛋白。
1.6 三唑磷濃度的測定
取三唑磷降解液5 mL,4℃,8 000 r/min離心10 min得上清液。取上清液2 mL,用3×2 mL二氯甲烷液-液分配萃取2 h,取下層有機相風干后加入等量甲醇供HPLC分析。HPLC工作條件為流動相:甲醇:水=80:20;流速:1.0 mL/min;進樣量:20 μL;檢測波長:246 nm;時間:15 min;保留時間:約5.89 min。
用Excel 2003和SPSS 15.0軟件對試驗數據進行單因素方差分析,差異顯著性分析采用LSD多重比較法。
2 結果與分析
2.1 菌株TAP-1三唑磷降解酶的定位
微生物農藥降解酶的分布可能在胞內,也可能在胞膜或胞外[13]。近年國內報道的一些有機磷農藥降解酶主要是胞內酶[14-15]。以濃度為40 mg/L的三唑磷為底物分別測定不同粗酶液對三唑磷的降解率。結果(圖1)表明,菌株TAP-1發酵后細胞不同部位提取液對三唑磷的降解率差異顯著。菌株TAP-1胞外粗酶液、胞間粗酶液和胞內粗酶液對三唑磷的降解率分別為2.8(±0.34)%、12.8(±2.44)%和84.4(±6.71)%,胞外和胞間粗酶液酶活明顯低于胞內粗酶液。說明菌株TAP-1三唑降解酶屬于胞內蛋白組分。

圖1 細菌TAP-1三唑磷降解酶的定位
2.2 最適酶促反應溫度的確定
溫度對酶促反應速度影響很大,在最適溫度范圍內,降解酶活力最大,酶促反應速度最快。圖2表明,溫度為30℃時,降解酶表現出最強的降解活性,即該降解酶對三唑磷的最適降解溫度為30℃。在25~40℃溫度范圍內該降解酶均具有較好的降解活性,粗酶活力都能保持最高活力的75%以上,顯示了該酶對溫度的較好適應性。但在50℃時,酶活性迅速降低,降低到最高酶活力的10.8%。

圖 2 溫度對三唑磷酶促降解的影響
2.3 最適酶促反應pH的確定

圖 3 pH對三唑磷酶促降解的影響
由圖3可知,不同酸堿條件對粗酶活性有較大影響。粗酶降解三唑磷的最適pH值范圍為6.5~7.0,在pH 5.5~7.5之間粗酶能保持最高活力的68%以上,但pH>7.5時,粗酶活力有明顯下降的趨勢。
2.4 金屬離子及有機試劑對酶的影響
不同的金屬離子和有機試劑會對酶組分產生不同的影響,從而促進或抑制酶的作用。試驗結果(表1)表明,巰基修飾劑如巰基乙醇(Mercaptoethanol)、碘乙酸(IAA)、對氯高汞苯甲酸(PCMB)、N-乙基馬來酰亞胺(NEM)對該酶有強烈的抑制作用,表明巰基基團可能涉及到酶的活性中心。EDTA對酶活的影響也較大,是因為EDTA是一種絡合劑,可與金屬離子形成絡合物。已報道的有機磷農藥降解酶多數為金屬酶,加入EDTA會與酶活性中心的金屬離子螯合,從而降低了酶的活性。不同的金屬離子對酶的活性產生不同的影響。Mg2+和Co2+對酶活有明顯的激活作用;Fe3+對酶活有一定的促進作用;而Hg2+和Mn2+對該酶活有強烈的抑制作用,其他金屬離子和有機溶劑對酶活無明顯影響。
2.5 三唑磷降解酶對溫度的耐受性
從圖4可以看出,粗酶在-20℃和4℃時保存最為穩定,處理1 h后粗酶仍能保持最高酶活力的98%左右。粗酶活力隨著保存溫度的升高而降低,20℃下處理1 h與30℃下處理1 h酶活力分別保持原有酶活力的85.5%和83.3%,二者間沒有顯著差異。之后,粗酶活力隨著保存溫度的進一步升高而呈現明顯下降的趨勢。40℃、50℃和60℃下處理1 h,粗酶活力分別下降到最高活力的61.3%、34.5%和11.2%,與低中溫處理差異顯著。可見,溫度對粗酶活性的影響較大,較高的溫度可使降解酶變性失活。
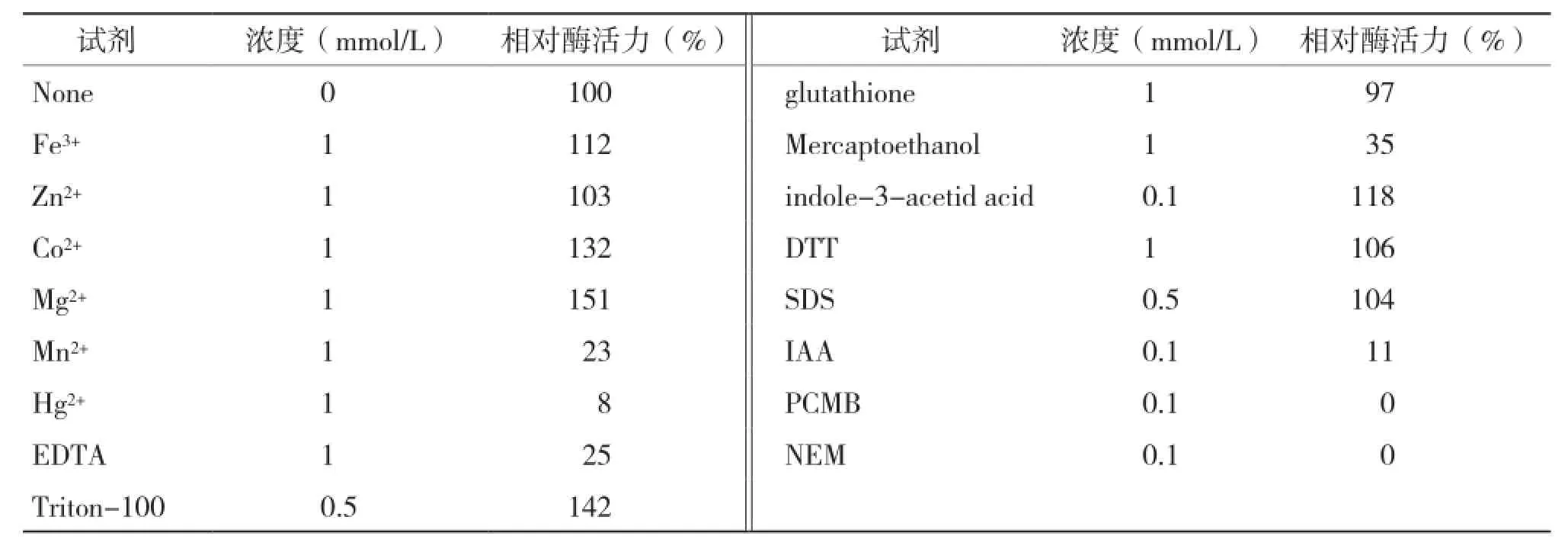
表1 各種化學物質對酶活力的影響

圖 4 粗酶對溫度的耐受性
2.6 粗酶的pH穩定性
圖5表明,用pH為6.5~7.5的緩沖體系處理酶液1 h后,粗酶的剩余酶活力保持90%以上,在pH為8.0的緩沖體系中保存1 h后,酶活力損失不到40%,而在pH為8.5的環境中保存1 h后,酶活力損失近77%。之后,隨著緩沖體系pH的升高,粗酶液的剩余酶活力進一步下降,直至為0。
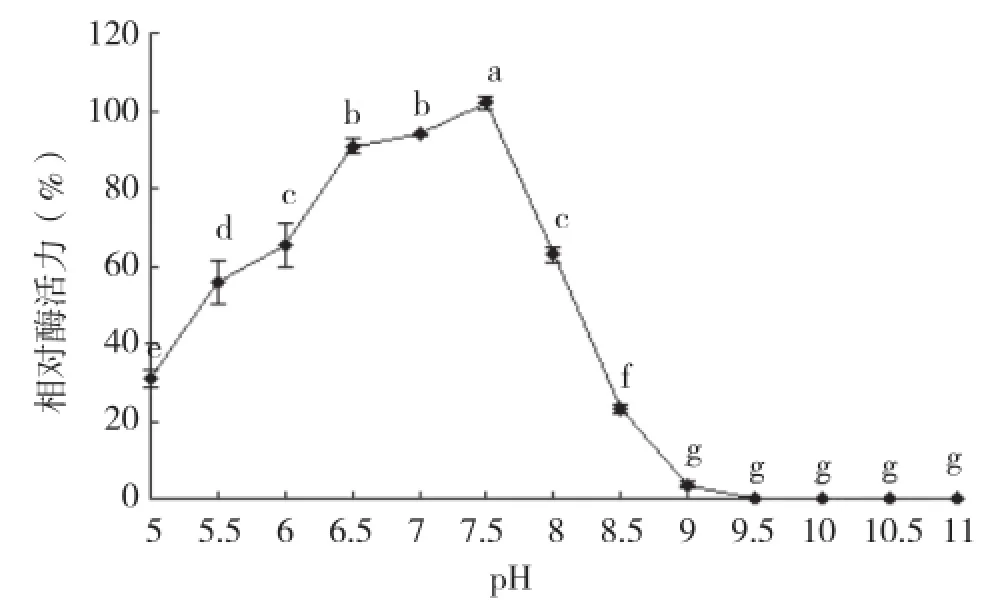
圖 5 粗酶對pH的耐受性
2.7 三唑磷降解酶動力學常數
動力學常數可以反映酶與底物的關系,是區別不同反應底物的重要特征性常數。用pH 7.2、20 mmol/L Tris-HCl緩沖液調節三唑磷溶液使之濃度為200、250、300、350、450 和500 mg/L,在32℃水浴中預熱10 min后加入50 μL酶液,32℃、100 r/min條件下反應30 min,以不加粗酶液作為對照,計算反應體系中三唑磷的降解速度,以三唑磷濃度的倒數為橫坐標,以速度的倒數為縱坐標作Lineweaver-Burk圖。結果(圖6)表明,三唑磷降解酶米氏常數為23.02 μmol/L,最大反應速度為 0.738 μmol/ mg·min。以牛血清白蛋白為標準蛋白制作標準曲線,在波長595 nm下比色測定,測得粗酶液中可溶性蛋白含量為2.31 g/L。因此,粗酶對三唑磷的最大降解速率為0.319 μmol/mg·min。

圖 6 三唑磷降解酶的Lineweaver-burk 圖
3 結論與討論
微生物酶制劑在生物修復方面的成功與否是由多種因素決定的,農藥降解酶與所有酶蛋白一樣,對于環境條件很敏感。其中,環境溫度、pH及重金屬離子的種類與濃度等是影響酶制劑作用效果的重要因素。試驗結果表明,施氏假單胞菌J7-4 (Pseudomonas stutzeri)有機磷農藥降解酶為胞內酶,最適pH為9.0,最適反應溫度為45℃。Mg2+、Ca2+等金屬離子對其有激活作用,而Mn2+、Fe3+、Zn2+、Al3+、Hg+、Cd2+、Ba2+和Ag+對該酶有強烈的抑制作用[14]。黑曲霉ZHY256樂果降解酶的最適作用溫度與pH分別為50℃、7.0,pH 穩定范圍為6.0~9.5[16]。有機磷降解酶OPHC2降解甲基對硫磷的最適溫度為65℃,最適pH為9,該酶具有很好的熱穩定性和pH穩定性,并且對大多數金屬離子和化學試劑不敏感[17]。源自真菌的甲基對硫磷和內吸磷降解酶為胞內酶,酶的最適反應溫度為45℃,最適pH 7.5,在50℃以下、pH 6.0~9.5范圍內活性穩定[18]。同樣為胞內酶的毒死蜱降解酶具較好的熱穩定性和酸堿穩定性,最適反應溫度為40℃,最適作用pH值為 6.8[19]。
本試驗對三唑磷降解酶最適反應溫度和最適反應pH以及粗酶液的熱穩定性、pH穩定性分別進行了研究,為降解酶制劑的規模化生產和應用提供理論依據和技術支持。試驗表明,三唑磷降解酶的最適作用溫度為30℃,最適作用pH范圍為6.5~7.0,pH≥8.0時,粗酶活力有明顯下降的趨勢。Co2+對酶活有明顯的激活作用,進一步說明了Co2+可能作為三唑磷降解酶輔酶成分。表面活性劑Triton-100通過改善細胞表面通透性,促使酶活性的增加。Hg2+、Mn2+、EDTA以及巰基乙醇等巰基修飾劑強烈抑制酶的活性,表明巰基基團可能涉及到酶的活性中心。動力學常數Km值和Vmax體現了酶與底物結合的牢固程度和酶的特異性質,對于研究酶的生理生化功能和催化方向有重要的指導意義。本試驗以三唑磷為底物,得到米氏常數為23.02 μmol/L,最大反應速率為0.738 μmol/mg·min,為進一步研究三唑磷降解酶的酶學性質提供了理論依據。
同已有報道的有機磷降解酶相比,本研究從芽孢桿菌TAP-1中提取的粗酶在酶學特性上存在差異,這可能與菌株的遺傳性差異、農藥本身的化學結構特性以及酶促反應體系不同有關。為了進一步闡明該酶的作用機理,有必要開展酶的分離純化工作,并且通過固定化和添加酶活性保護劑等方法,為降解酶的實際應用奠定基礎。
[1] 戴青華,張瑞福,蔣建東,等. 一株三唑磷降解菌mp-4 的分離鑒定及降解特性的研究[J].土壤學報,2005,42 (1):120-124.
[2] 楊英利,朱小燕,李愛民,等. 3 種淡水藻對三唑磷的降解研究[J]. 環境科學研究,2007,20 (1):85-89.
[3] 鄒小明,朱立成,肖春玲,等. 三唑磷的土壤微生物生態效應研究[J]. 農業環境科學學報,2008,27(1):238-242.
[4] 秦曙,喬雄梧,王霞,等. 三唑磷原藥及其中相關雜質治螟磷的水解特性研究[J]. 農藥學學報,2009,11(1):126-130.
[5] 李冠喜,吳小芹,葉建仁. 多噬伯克霍爾德氏菌WS-FJ9 對草甘膦的降解特性[J]. 生態學報,2013,33(21):6885-6894.
[6] Gomez Jimenez-TR,Moliterni E,Rodriguez L,et a1. Villasefior feasibility of mixed enzymatic complexes to enhanced soil bioremediation processes[J]. Procedia Environmental Sciences,2011(9):54-59.
[7] Goutami B,Scott Craig J S,Walton J D. Improving enzymes for biomass conversion:A basic research perspective[J]. Bioenergy Research,2010,3(1):82-92.
[8] 黃皓,梁衛驅,李艷芳,等. 菊酯類農藥降解酶基因原核表達條件的優化[J]. 廣東農業科學,2015,42(10):76-79.
[9] 劉幽燕,鄢恒宇,李青云,等. 一株產堿桿菌DN25中降氰酶的提取和特性研究[J]. 環境科學與科技,2008,31(5):11-13.
[10] Rutwik RMT,Sivakami S. Degradation of chlorpyrifos by an alkaline phosphatase from the cyanobacterium Spirulina platensis[J]. Biodegradation,2010,21(4):637-644.
[11] 王麗紅,張林,陳歡林. 三唑磷降解菌的篩選及其降解途徑研究[J]. 生物工程學報,2005,21(6):954-959.
[12] Bradford M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Anal. Biochem. ,1976,72:248-254.
[13] 張娜,郭慶啟,劉曉飛,等. 甲胺磷生物降解酶對韭菜中農殘生物修復效果研究[J]. 中國林副特產,2013(3):9-11.
[14] 王繼雯,甄靜,劉瑩瑩,等. 一株有機磷農藥高效降解菌的篩選及酶學性質研究[J]. 中國農學通報,2013,29 (21):83-87.
[15] 王繼雯,劉瑩瑩,李冠杰,等. 黑曲霉J6有機磷農藥降解酶固定化條件的研究[J]. 中國農學通報,2014,30 (6):285-289.
[16] Liu Y H,Chung Y C,Xiong Y. Purification and characterization of a dimethoate-degrading enzyme of Aspergillus niger ZHY256,isolated from sewage[J]. Appl Environ Microbiol. ,2001,67 (8):3746-3749.
[17] 伍寧豐,鄧敏捷,史秀云,等. 一種新的有機磷降解酶的分離純化及酶學性質研究[J]. 科學通報,2003,48(23):2446-2450.
[18] 劉陽,劉玉煥,陳志仕,等. 米曲霉LY-128廣譜有機磷農藥水解酶的純化和鑒定[J]. 菌物系統,2003,22(4):557-564.
[19] 謝慧,朱魯生,王軍,等. 真菌WZ-1對有機磷殺蟲劑毒死蜱的酶促降解研究[J]. 環境科學,2005,26 (6):164-168.
(責任編輯 楊賢智)
Distribution and properties of triazophos-degrading enzyme
TANG Ming-qiang,CHEN Shu-xian
(School of Ocean and Biochemical Engineering, Fuqing Branch of Fujian Normal University, Fuqing 350300, China)
To investigate the effects of different fractions of bacterial strain Bacillus TAP-1 on the degradation rate of tirazophos, sonication method was applied to lyse the TAP-1 cells to obtain triazophos-degrading enzyme,while HPLC(High Performance Liquid Chromatography)method was used to determine the enzymatic properties. The results showed that the degradation rate of triazophos by intracellular, intercellular and extracellular extracts were 84.4(±6.71)%, 12.8(±2.44)%, and 2.8(±0.34)%, respectively. The active substances of triazophos-degrading were intracellular fractions. The enzyme demonstrated greatest enzymatic activity in the pH range of 6.5-7.0 with its highest activity occurring in the pH range of 5.0-7.5. Enzymatic activity occurred at an optimum temperature of 30℃ for the degradation of triazophos;activity remained above 75% of the maximum over a temperature range of 25℃-40℃. Different chemicals and metallic ions also had different effects on its activity. Its activity can be strongly inhibited by thiol modifier, ETDA, Hg2+and Mn2+, but stimulated by Mg2+,Co2+and Fe3+. The Km value and the maximal degradation rate of triazophos-hydrolase were 23.02 μmol/L and 0.738 μmol/mg·min, respectively.
triazophos-degrading bacteria TAP-1;degrading enzyme;enzyme localization;enzymatic property
X592
A
1004-874X(2017)-01-0115-07
2016-10-11
福建省自然科學基金(2012J01118)
湯鳴強(1966-),男,博士,教授,E-mail:mqt-1022@163.com
湯鳴強,陳淑賢. 三唑磷農藥降解酶的定位及酶學性質研究[J].廣東農業科學,2017,44(1):115-121.

