hsa-miR-381過表達慢病毒載體的構建、轉染和表達
周蘇娜,葉文廣,崔耀友,梁軍#,張明鑫*
(1第四軍醫大學唐都醫院放療科,西安 710061;2第四軍醫大學腫瘤研究所;3第四軍醫大學唐都醫院消化內科;*通訊作者,E-mail:zmx3115@163.com;#共同通訊作者,E-mail:liangjtangdu@163.com)
hsa-miR-381過表達慢病毒載體的構建、轉染和表達
周蘇娜1,2,葉文廣2,崔耀友1,梁軍1#,張明鑫2*
(1第四軍醫大學唐都醫院放療科,西安 710061;2第四軍醫大學腫瘤研究所;3第四軍醫大學唐都醫院消化內科;*通訊作者,E-mail:zmx3115@163.com;#共同通訊作者,E-mail:liangjtangdu@163.com)
目的 構建hsa-miR-381過表達慢病毒載體病毒載體,并對其在食管鱗癌TE10細胞中miR-381表達調節效果進行鑒定。 方法 利用PCR法擴增miR-381基因序列,將目的基因miR-381克隆到攜帶Green&Puro的慢病毒載體LV3中,經雙酶切及測序鑒定后大量抽提;利用脂質體將含目的基因的重組質粒和包裝質粒pGag/Pol、pRev、pVSV-G共轉染293T細胞;用得到的慢病毒轉染TE10細胞,通過熒光顯微鏡觀察轉染狀況,實時熒光定量PCR分析轉染前后miR-381的表達。 結果 酶切與測序結果證明成功構建重組質粒,并成功包裝成慢病毒,實驗組病毒滴度為2×108TU/ml,空白陰性對照組病毒滴度為2×108TU/ml。TE10細胞轉染過表達慢病毒后miR-381的表達升高,TE10-381組has-miR-381的表達豐度是TE10組的456.05倍。 結論 LV3-hsa-miR-381慢病毒載體構建成功,并能明顯增加TE10細胞中miR-381的表達量。
miR-381; 慢病毒載體; 食管鱗癌; 基因轉染
食管癌的發病率和致死率在常見腫瘤中分別占第八和第六位,其中食管鱗狀細胞癌(esophageal squamous cell carcinoma,ESCC)在東亞地區占主要地位,約50%的ESCC病例發生在中國[1]。研究發現microRNAs(miRNAs)在惡性腫瘤的發生發展過程中發揮重要作用[2]。近年來研究發現,miR-381在多種腫瘤中如肝癌、卵巢癌、結直腸癌中發揮抑癌基因的功能,可以通過抑制肝受體同系物-1(liver receptor homolog 1,LRH-1)、轉錄因子Yin Yang 1(YY1)、Twist家族堿性螺旋-環-螺旋轉錄因子1(Twist1),發揮抑制細胞增殖、侵襲、遷移等抗腫瘤的作用[3-6]。研究miR-381在ESCC中的表達和作用,有助于對ESCC的深入了解,為其檢測、治療、預防等提供依據。本實驗構建has-miR-381過表達慢病毒載體(LV3-hsa-miR-381),通過熒光顯微鏡、實時熒光定量PCR(real-time quantitative PCR,qPCR)驗測TE-10細胞的轉染效率,為研究miR-381在ESCC中的調控作用奠定基礎。
1 材料與方法
1.1 細胞系
食管鱗癌細胞株TE10、人胚腎上皮細胞株293T購于中國科學院上海細胞庫。
1.2 載體和主要試劑
混合包裝載體質粒(pGag/Pol、pRev、pVSV-G)和慢病毒載體pGLV3/H1/GFP+Puro載體(LV3)購自上海吉瑪制藥技術有限公司;大腸桿菌菌株DH5α為西安交通大學醫學院中心實驗室保存;DMEM、胎牛血清、胰酶Trypsin-EDTA Solution和鏈霉素(10 000 μg/ml)/青霉素(10 000 U/ml)購自美國GIBCO公司;質粒抽提試劑盒購自日本Takara公司;BamHⅠ、EcoRⅠ內切酶、T4 DNA連接酶、Marker購自加拿大Fermentas公司;瓊脂糖、DNA凝膠回收試劑盒、Taq聚合酶購自北京天根生化科技有限公司;PrimeScript RT試劑盒、SYBR酶購自美國ABI公司;Lipofectamine 2000、Trizol購自美國Invitrogen公司;LB培養基購自美國ATCC公司。
1.3 細胞分組
根據后期實驗轉染情況,分為TE10組(空白TE10細胞)、TE10-NC組(轉染陰性LV3-NC病毒)、TE10-381組(轉染過表達LV3-hsa-miR-381病毒)。
1.4 hsa-miR-381的基因擴增
根據GeneBank提供的hsa-miR-381基因組序列的信息數據,設計has-mir-381上游引物:GCGAGGTTGCCCTTTGTA;hsa-miR-381下游引物:CACTTCCTCAGCACTTGTTGGTAT。目的基因上下游引物分別加上BamHⅠ和EcoRⅠ及保護堿基,用于慢病毒載體的亞克隆。引物由上海吉瑪基因技術有限公司合成,按照PCR試劑盒操作說明提取TE10細胞miR-381的互補DNA(complementary deoxyribonucleic acid,cDNA)、以得到的cDNA為模板進行目的基因的大量擴增。擴增條件:95 ℃預變性3 min,95 ℃ 30 s、62 ℃ 40 s、72 ℃ 30 s,循環40次。PCR產物經聚丙烯酰胺凝膠電泳,切膠回收基因片段。
1.5 LV3-hsa-miR-381重組質粒的構建、轉化、篩選和鑒定
將擴增的has-miR-381基因片段及載體質粒LV3在37 ℃下用BamHⅠ和EcoRⅠ進行雙酶切2 h,酶切完成后按照凝膠回收試劑盒進行膠回收。二者在T4連接酶的作用下,16 ℃過夜連接。將連接產物轉化感受態細胞,挑取單菌落,搖菌,提取質粒,將抽提好的質粒用BamHⅠ、EcoRⅠ限制性內切酶進行雙酶切并鑒定。取測序正確后的克隆,搖菌擴大培養,用除內毒素大提試劑盒大量抽提陽性重組質粒。
1.6 慢病毒的包裝
在轉染前24 h,取在10 cm培養皿中培養至80%-90%融合時的293T細胞,接種至15 cm培養皿。轉染前2 h將培養基更換為無血清的新鮮培養基。利用脂質體將含目的基因的重組質粒(LV3-hsa-miR-381)和包裝質粒pGag/Pol、pRev、pVSV-G共轉染293T細胞(構建實驗組慢病毒),同時利用脂質體將不含目的基因的質粒(LV3-NC)和包裝質粒pGag/Pol、pRev、pVSV-G共轉染293T細胞(構建陰性對照組慢病毒),在在37 ℃、5% CO2培養箱中溫育4-6 h,更換為含10%FBS的DMEM培養液。37 ℃、5% CO2繼續培養72 h。包裝后產生過表達hsa-miR-381的慢病毒(LV3-hsa-miR-381)和空白陰性對照慢病毒(LV3-NC)。
1.7 慢病毒的收獲、濃縮
將上述培養72 h的293T細胞上清液收集到50 ml離心管中,于4 ℃,4 000 r/min離心4 min;將離心管上清液倒入50 ml 注射器內,用0.45 um過濾器過濾。濾液于4 ℃,20 000 r/min離心2 h。將濃縮液收集分裝,-80 ℃保存。
1.8 慢病毒滴度的測定
用培養基將指數生長期的239T細胞制備成單細胞懸液,按3×104個/孔接種至96孔板中,混勻后于37 ℃ 5% CO2培養24 h。將慢病毒原液10 μl,用10% FBS的DMEM 培液10倍稀釋4個梯度。吸去96孔板中的培養液,每孔加入100 μl稀釋的病毒液,同時設立空白對照組,于37 ℃、5% CO2培養24 h。吸棄96孔板中的稀釋病毒液,每孔加入100 μl 10% FBS的DMEM培液,于37 ℃ 5% CO2繼續培養72 h。通過熒光顯微鏡計數熒光細胞,結合稀釋倍數計算病毒滴度,計算病毒滴度(病毒滴度=熒光細胞數/病毒原液量),病毒LV3-hsa-miR-381b和LV3-NC的滴度分別為2×108TU/ml和2×108TU/ml。
1.9 慢病毒轉染ESCC TE10細胞
將對數生長期的TE10細胞,按1×106個/孔接種至6孔板中,于37 ℃、5% CO2培養箱中培養24 h,細胞長至密度約為40%時侵染病毒。將侵染TE10細胞的慢病毒原液用10% FBS的1640培養液按梯度1 ∶10稀釋3個梯度,加入終濃度為5 μg/ml的聚凝膠以增加轉染率。吸去6孔板中的原培養液,加入上述稀釋的病毒液,同時設立空白對照組。培養24 h更換成正常培養基,繼續培養72 h,倒置熒光顯微鏡觀察綠色熒光表達并拍照。
1.10 實時qPCR檢測TE10細胞miR-381的表達水平
嚴格按照產品說明書進行實時qPCR檢測轉染后的TE10組、TE10-NC組和TE10-381組細胞中miR-381的表達水平。細胞中加入1 ml Trizol,按說明提取細胞總RNA并測定其純度和濃度。按照PrimeScript RT試劑盒的操作說明,以RNA為模板通過逆轉錄合成cDNA。在SYBR酶的作用下進行PCR反應。實時qPCR循環95 ℃變性3 min,95 ℃ 30 s、62 ℃ 40 s、72 ℃ 30 s,循環40次。
1.11 統計學分析
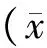
2 結果
2.1 hsa-miR-381的PCR擴增產物
凝膠電泳分析顯示:PCR擴增的特異性條帶在113 bp左右,與Genebank發布的結果相符(見圖1)。
2.2 重組質粒LV3-hsa-miR-381的鑒定
挑取1個陽性克隆進行擴增和抽提質粒,用BamHⅠ和EcoR Ⅰ對陽性克隆的重組質粒進行雙酶切,電泳后得到的陽性克隆條帶見圖2。表明質粒所在8 000 bp大小的為陽性重組質粒LV3-hsa-miR-381。

1-4.PCR產物;5.空白對照;6.Marker圖1 瓊脂糖凝膠電泳分析hsa-miR-381的PCR擴增產物Figure 1 Analysis of PCR-amplified products of hsa-miR-381 by agarose gel electrophoresis

1.pGLV3/H1/GFP+Puro質粒(LV3);2.LV3-hsa-miR-381重組質粒Bam HⅠ和EcoR Ⅰ雙酶切;3.Fermentas SM0331GeneRuler DNA Ladder Mix圖2 重組質粒LV3-hsa-miR-381電泳后得到的陽性克隆條帶鑒定結果Figure 2 Identification of the positive clones of recombinant plasmid LV3-hsa-miR-381 after electrophoresis
2.3 DNA測序鑒定
過表達載體LV3-hsa-miR-381陽性克隆測序結果見圖3,4,通過Blast證實其基因序列與miR-381序列匹配,表明miR-381的基因正確地插入到了載體LV3中。

紅字斜體顯示為插入的has-miR-381前體序列圖3 LV3-hsa-miR-381過表達載體陽性克隆測序結果Figure 3 The sequencing of LV3-hsa-miR-381-overexpressed vector

測序波峰圖顯示has-miR-381前體序列正確插入質粒圖4 LV3-hsa-miR-381過表達載體陽性克隆測序波峰圖Figure 4 DNA sequencing of LV3-hsa-miR-381-overexpressed vector
2.4 各組細胞轉染結果
TE10-381組感染過表達LV3-hsa-mir-381病毒,TE10-NC組感染空白陰性對照慢病毒LV3-NC,病毒感染96 h后進行熒光拍照。各組細胞熒光拍照結果見圖5,可見病毒感染成功。

圖5 穩轉細胞株轉染后熒光蛋白表達情況 (×100)Figure 5 Expression of green fluorescent protein in stable transgenic cell line after transfection (×100)
2.5 PCR 驗證TE10細胞中轉染LV3-hsa-miR-381過表達病毒效率的結果
以U6為內參,TE10組為基準,校正計算各組2-ΔΔCt值。TE10組為1.00±0.47,TE10-NC組為2.95±1.26,TE10-381組為456.05±96.64。上述結果顯示TE10-381組細胞與TE10組、TE10-NC組細胞相比,miR-381的含量明顯升高,TE10-381組has-miR-381的表達豐度是TE10組的456.05倍,差異具有統計學意義(P<0.05,見圖6)。

與其他兩組比較,*P<0.05圖6 實時qPCR檢測各組細胞中miR-381表達結果Figure 6 qRT-PCR expression of miR-381 in cells by real-time qPCR
3 討論
miRNA作為一類非編碼單鏈小分子RNA,參與調控細胞增殖和凋亡等生物學行為相關的基因表達,且研究證實許多miRNA與腫瘤的發展、侵襲、轉移等惡性生物學行為及腫瘤耐藥相關[7]。近年來關于miRNA的功能研究越來越多。隨著miRNA研究的逐漸深入,發現miR-381在腫瘤和正常組織中呈差異性表達,且在腫瘤的發生發展過程中扮演著重要角色。miR-381在肺腺癌中表達下調,靶向調控分化抑制蛋白1(inhibitor of differentiation 1,ID1)影響細胞遷移和侵襲[8]。結腸癌組織中miR-381的表達明顯下降,其發揮抑癌基因的功能,調控腫瘤的增殖、侵襲、遷移及上皮細胞間質轉型(epithelial-mesenchymal transitions,EMT)能力[4,6,9]。課題組的前期研究發現miR-381的表達下調和食管鱗癌細胞株的惡性表型如增殖、侵襲能力增加,放療抵抗增加相關[10]。正是由于miR-381在消化道組織中的表達特異性,提示miR-381在食管癌的發展過程中發揮抑制腫瘤的作用。
常用的慢病毒載體是在人類免疫缺陷病毒1型基礎上修飾改造而得到的一種多用途、安全的轉基因載體[11]。慢病毒可以高效地感染內皮細胞、腫瘤細胞等多種類型的細胞,將需要的目的基因重組到慢病毒載體,然后通過重組載體轉染靶細胞,可以實現目的基因在宿主細胞的持久表達。相對于非病毒載體,病毒載體具有如下優勢[12]:①慢病毒載體可轉染有絲分裂期包括分裂終末期的細胞;②維持目的基因在靶細胞中長期而穩定的表達;③實現從時間性、空間性的精確調控目的基因的表達;④實現功能相關的數個基金的共表達;⑤免疫反應小,安全性高。
為進一步闡明mir-381在調控食管癌的發生與發展中的可能分子機制,本研究選擇應用重組慢病毒載體技術構建了能夠穩定而持久過表達外源mir-381的重組質粒,經PCR擴增測序,顯示其基因序列與miR-381序列匹配,說明miR-381的基因正確地插入到了載體中;重組過表達慢病毒轉染食管鱗癌TE10細胞,通過熒光顯微鏡觀察熒光蛋白的表達情況,看到重組的過表達慢病毒質粒能夠高效的感染目的細胞;通過實時qPCR檢測發現轉染后的TE10細胞中miR-381的表達顯著升高,為研究miR-381對ESCC發生發展中的相關信號通路以及生物學功能的作用機制奠定了基礎。
[1] Siegel R,Naishadham D,Jemal A.Global cancer statistics,2013[J].CA Cancer J Clin,2013,63(1):11-30.
[2] Nana-Sinkam SP,Croce CM.Clinical applications for microRNAs in cancer[J].Clin Pharmacol Ther,2013,93(1):98-104.
[3] Zhang Q,Zhao S,Pang X,etal.MicroRNA-381 suppresses cell growth and invasion by targeting the liver receptor homolog-1 in hepatocellular carcinoma[J].Oncol Rep,2016,35(3):1831-1840.
[4] Liang Y,Zhao Q,Fan L,etal.Down-regulation of MicroRNA-381 promotes cell proliferation and invasion in colon cancer through up-regulation of LRH-1[J].Biomed Pharmacother,2015,75:137-141.
[5] Xia B,Li H,Yang S,etal.MiR-381 inhibits epithelial ovarian cancer malignancy via YY1 suppression[J].Tumour Biol,2016,37(7):9157-9167.
[6] He X,Wei Y,Wang Y,etal.MiR-381 functions as a tumor suppressor in colorectal cancer by targeting Twist1[J].Onco Targets Ther,2016,9:1231-1239.
[7] Wang XC,Zhang ZB,Wang YY,etal.Increased miRNA-22 expression sensitizes esophageal squamous cell carcinoma to irradiation[J].J Radiat Res,2013,54(3):401-408.
[8] Rothschild SI,Tschan MP,Jaggi R,etal.MicroRNA-381 represses ID1 and is deregulated in lung adenocarcinoma[J].J Thorac Oncol,2012,7(7):1069-1077.
[9] 尹慧,王偉,張強,等.MicroRNA-381的表達下降促進結腸癌的增殖與侵襲[J].西南國防醫藥,2016,26(7):697-700.
[10] Zhou S,Ye W,Ren J,etal.MicroRNA-381 increases radiosensitivity in esophageal squamous cell carcinoma[J].Am J Cancer Res,2015,5(1):267-277.
[11] Zufferey R,Dull T,Mandel RJ,etal.Self-inactivating lentivirus vector for safe and efficientinvivogene delivery[J].J Viral,1998,72(12):9873-9880.
[12] Mátrai J,Chuah MK,Vanden Driessche T.Recent advances in lentiviral vector development and applications[J].Mol Ther,2010,18(3):477-490.
Construction,transfection and expression of hsa-miR-381 over-expressed lentivirus vector
ZHOU Suna1,2,YE Wenguang2,CUI Yaoyou1,LIANG Jun1#,ZHANG Mingxin2*
(1DepartmentofRadiotherapy,TangduHospital,FourthMilitaryMedicalUniversity,Xi’an710061,China;2TumorInstitute,FourthMilitaryMedicalUniversity;3DepartmentofGastroenterology,TangduHospital,FourthMilitaryMedicalUniversity;*Correspondingauthor,E-mail:zmx3115@163.com;#Co-correspondingauthor,E-mail:liangjtangdu@163.com)
ObjectiveTo construct hsa-miR-381-over-expressed lentivirus vector,and to investigate the regulation effect of miR-381 in esophageal squamous cell carcinoma TE10 cells after transfection.MethodsThe miR-381 sequence was obtained by PCR amplification,and then inserted into the lentiviral vector LV3 with Green&Puro.The miR-381 sequence was confirmed by double-enzyme cleavage and DNA sequencing and extracted.The recombinant lentivirus plasmid and packaging plasmid pGag/Pol,pRev,and pVSV-G were co-transfected into 293T cells by liposomes.The viral yielded by 293T cell was transfected into TE10 cells.The status of transfection was observed by fluorescence microscope,and the expression of miR-381 was detected by real-time quantitative PCR before and after transfection.ResultsRestriction enzyme digestion and sequencing results showed that recombinant plasmid was successfully constructed and packaged to lentivirus.The miR-381 sequence was confirmed by restriction enzyme digestion and DNA sequencing,and successfully inserted into the vector.The viral titer was 2×108TU/ml.After transfection,the expression of miR-381 was significantly up-regulated in TE10 cells,and the expression abundance of hsa-miR-381 in TE10-381 increased by 456.05 times.ConclusionThe LV3-has-miR-381 lentiviral vector is successfully constructed,and it could significantly increase the miR-381 expression in TE10 cell.
miR-381; lentivirus vector; esophageal squamous cell carcinoma; gene transfection
國家自然科學基金資助項目(81301922)
周蘇娜,女,1983-09生,博士,主治醫師,E-mail:annyzhou0913@163.com
2016-12-08
Q78
A
1007-6611(2017)03-0241-05
10.13753/j.issn.1007-6611.2017.03.009

